Урок № 4 Тема. Солі, їх склад і назви. Поширеність солей у природі та їхнє практичне значення.
Тема. Солі, їх склад і назви. Поширеність солей у природі та їхнє практичне значення.
Мета уроку:
-розширити знання про класифікацію неорганічних речовин і номенклатуру неорганічних речовин на прикладі солей;
-сформувати вміння складати формули солей та їх назви;
-сформувати уявлення про фізичні властивості солей, їх поширеність у природі, значення солей в житті людини;
-розвивати логічне, творче мислення.
Основні класів неорганічних сполук. 8 клас
Урок № 4
Тема. Солі, їх склад і назви. Поширеність солей у природі та їхнє практичне значення.
Мета уроку:
- розширити знання про класифікацію неорганічних речовин і номенклатуру неорганічних речовин на прикладі солей;
- сформувати вміння складати формули солей та їх назви;
- сформувати уявлення про фізичні властивості солей, їх поширеність у природі, значення солей в житті людини;
- розвивати логічне, творче мислення.
Базові поняття та терміни: основи, кислоти, металічні елементи, кислотний залишок, фізичні властивості.
Тип уроку: комбінований.
Методи навчання: пояснювально-ілюстративні – бесіда, розповідь; наочні – демонстрації, лабораторний дослід; практичні – виконання завдань; репродуктивні; частково-пошукові, ігрові; методи контролю.
Матеріали: зразки солей: NaCl, CuSO4, BaCl2, Na2CO3, KMnO4, KNO3.
Обладнання: періодична система хімічних елементів Д.І.Менделєєва, таблиця розчинності.
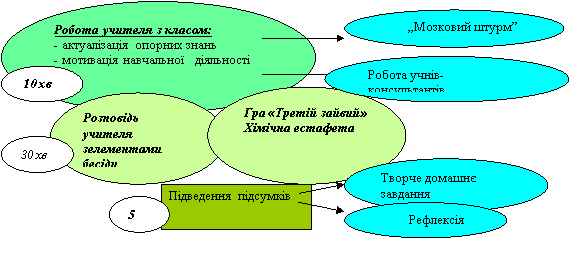
Хід уроку
І. Організаційний етап
Привітання, перевірка готовності учнів до уроку.
ІІ. Перевірка домашнього завдання.
“Мозковий штурм»:
а) дайте визначення основам;
б) що таке луги, якими фізичними властивостями вони характеризуються?
в) як виявляють луги у розчинах?
г) Що необхідно робити при потраплянні лугів на шкіру або слизові оболонки?
«Допоможіть знайти своє місце»
Учням пропонується із переліку речовин виписати окремо кислоти, оксиди, основи у три стовпчика. Під час перевірки учні усно дають назву речовини.
Перелік речовин: Н2О, КОН, H2SO4, HCl, NaCl, CO2, CaCO3, HNO3, Fe(OH)2, BaSO4, Ba(OH)2, MgO, H3PO4, Mg(OH)2, Al(NO3)3, Al2O3, NaOH, H2SiO3, FeCl3.
ІІІ. Актуалізація опорних знань.
Питання:
- Які основні класи неорганічних сполук ми вивчили? Дайте їм визначення. Завдання.
- Які формули із переліку не ввійшли ні до одного із знайомих вам класів? Як ви вважаєте, до якого класу неорганічних сполук відносяться ці речовини?
Тема нашого уроку: Солі.
Учні формулюють завдання уроку.
ІV. Вивчення нового матеріалу.
- Поняття про солі, склад і назви.
Демонстрація. Зразки солей.
- NaCl – кухонна сіль
- CuSO4 – мідний купорос
- Na2SO4 – каустична сода
- KMnO4 - марганцівка
- KNO3 – калійна селітра
(на склянках наведені тривіальні назви).
У побуті ми звикли мати справу лише з однією сіллю – кухонною, тобто натрій хлоридом NaCl. Однак у хімії солями називають цілий клас сполук.
З формул, які вписані в попередньому завданні, видно, що солі складаються з атомів металічних елементів та кислотних залишків:
NaCl, CaCO3, BaSO4, AgNO3, FeCl3
Солі – складні речовини, що складаються з атомів металічних елементів і кислотних залишків.
Відповідно сучасної української номенклатури солі називають таким чином:
Назва металу (валентність, якщо змінна) + назва кислотного залишку
Назвемо солі, які ми роздивилися:
1)NaCl – натрій хлорид
2)CuSO4 – купрум (ІІ) сульфат
3)Na2SO4 –натрій сульфат
4)KMnO4 – калій перманганат
5)KNO3 – калій нітрат
Аналогічно можна скласти формули солей, знаючи їхню назву, валентність металу й валентність кислотного залишку.
Ферум (ІІ) хлорид – FeCl2
Натрій фосфат – Na3PO4
Алюміній сульфат – Al2(SO4)3
- Фізичні властивості солей
Солі мають немолекулярну будову, тому всі солі – за звичайних умов тверді кристалічні речовини з високими температурами плавлення. Багато солей добре розчинні у воді, але багато з них практично не розчиняються. Щоб дізнатися про розчинність тієї чи іншої солі, можна скористуватися таблицею розчинності солей у воді.
Солі можуть мати різний колір. Багато солей є безбарвними речовинами, але деякі мають характерний колір. Наприклад, ферум(ІІ) сульфат має зелений колір, ферум (ІІІ) хлорид – темно червоний, ферум (ІІ) сульфат має зеленний колір, ферум (ІІІ) хлорид – темно-червоний, а калій хромат – яскраво-жовтий.
Завдання.
- Які з наведених солей є розчинними: Na2SO4 , AgCl, Fe(OH)3, MgCl2, CuSO4, NaBr, BaSO4, K2S, Mg3(PO4)2.
- Поширеність у природі та використання солей.
Використовуються ілюстрації із мережі Інтернет.
У природі міститься чимало різних солей. Вони складають різні ґрунти і породи, мінерали. Більшість солей – це силікати. Численні солі утворюють цінні руди, з яких добувають чисті метали – цинк сульфід ZnS, плюмбум сульфід PbS, арсен (ІІІ) сульфід. Багато різних солей розчинено в морській воді.
Натрій хлорид незамінний у приготуванні їжі. Крім того він є важливою сировиною в хімічній промисловості для добування хлору, хлоридної кислоти, натрій гідроксиду та соди. В природі він перебуває у вигляді мінералу - галіту, а також у великій кількості міститься у воді морів, океанів та солених озер.
Натрій карбонат (Na2CO3) більше відомий як сода, у природі зустрічається у вигляді кристалогідрату Na2CO3 ·10Н2О (кристалічної соди), з неї добувають безводну сіль – кальциновану соду. Сода є ефективним засобом для миття і чищення посуду, прання білизни.
Калій карбонат (K2CO3, поташ) також використовується для прання завдяки тому, що наявність його у розчині створює лужне середовище, в якому полегшується прання.
До революції поташ добували із золи рослин (зола стебел соняшника містить до 30% поташу).
Натрій сульфат (Na2CO4 ·10 Н2О, глауберова сіль або мірабіліт) – цінний реактив для лабораторної практики, використовується для виготовлення скла.
Калій перманганат (KMnO4), у побуті відомий як марганцівка, є цінною речовиною, що використовується як дезінфекційний засіб та для промивання шлунка при отруєннях. Калій перманганат є також цінним реактивом в лабораторній практиці.
Широке застосування мають солі нітратної кислоти – нітрати (в промисловості їх також називають селітрами). Нітрати Калію, Натрію та Кальцію входять до складу пороху та інших піротехнічних сумішей, використовується для добування кисню в лабораторії. В сільському господарстві широко використовуються нітратні добрива. Аргентум нітрат (AgNO3, ляпіс) здавна використовують для виготовлення дзеркал.
Дуже поширеними солями у природі є солі Кальцію. Вони трапляються у вигляді багатьох порід і мінералів. Кальцій сульфат у вигляді кристалогідрату з двома молекулами води – це мінерал гіпс (CaSO4· 2Н2О). обпалений гіпс використовують у будівництві для приготування різних сумішей та у медицині для фіксації переламаних кінцівок. Найпоширеніша сіль Кальцію – це карбонат. Кальцій карбонат складає вапняк, крейду, а також мінерали кальцит та мармур. Крім того, кальцій карбонат складає оболонку яєць (шкаралупу), мушлі багатьох молюсків тощо. Вапняк використовують у будівництві для зведення будинків. Прожарюванням вапняку добувають вапно. Крейдою пишуть на твердих поверхнях, використовують для побілки стін, додають у зубну пасту, а також використовують (разом із содою і піском) для виготовлення скла.
Різні солі застосовують у промисловості для одержання металів, кислот, у виробництві скла. У сільському господарстві вони служать добривами й засобами для боротьби із хворобами й шкідниками рослин. Деякі солі використовують як будівельні матеріали й ліки.
Фізкультхвилинка:
За вікном осінь. Відбувається круговорот речей в природі. Вода перебуваючи у газоподібному агрегатному стані піднімається високо в небо і там під дією низьких температур конденсується та збирається в дощові тучі і ось у нас за вікном піднявся вітер (терти долоні).
- Починає накрапати дощ (клацання пальцями).
- Дощ посилюється (почергове плескання по грудях).
- Починається справжня злива (плескання по ногах).
- А ось гроза, справжня буря (тупотіння ногами).
- Але що це? Буря почала вщухати (плескання по ногах).
- Злива перетворюється на дощ (плескання долонями по грудях).
- Рідкі каплі падають на землю (клацання пальцями).
- Вщухає вітер (терти долоні).
- З’являється сонечко (руки догори).
V. Узагальнення знань
1. Гра «Третій зайвий»
На дошці записані три рядки хімічних формул. Учні знаходять «зайвого».
А) NaCl, Mg(OH)2, FeSO4, AlPO4
Б) CaCO3, NaCl, NaNO3, NaF
В) MgSO4, CaCO3, NaNO3
2. Гра «Утвори пару». Скласти можливі формули солей.
Fe,SO4 ,Na, К, Cl, PO4 , Li, Ca, SO3, S, Mg.
3.Гра «Естафета».
Заповнюємо таблицю. Для цього об`єднаємо клас у групи й проведемо естафету. Завдання естафети: скласти формули солей і назвати їх. Формулу солі записати у відповідній квадрат
|
|
HCl |
HNO3 |
HPO3 |
H2SO3 |
H2S |
H3PO4 |
|
I Na |
|
|
|
|
|
|
|
II Са |
|
|
|
|
|
|
|
III Al |
|
|
|
|
|
|
|
II Fe |
|
|
|
|
|
|
VІ. Домашнє завдання.
Опрацювати ![]() 8 параграф. Виконати вправи: дост. рівень - №74-75 ст. 48, вис. рівень: Творче завдання.
8 параграф. Виконати вправи: дост. рівень - №74-75 ст. 48, вис. рівень: Творче завдання.
- Складіть формули солей Калію з усіма кислотними залишками в таблиці і дайте їм назви.
- Створіть буклет про використання солей.
Рефлексія.
Ті, кому сподобався урок – плескайте в долоні, а ті , кому ні – по ногах, імітуючи дощ. Таким чином ми дізнаємося, що переважає: овації чи злива.


про публікацію авторської розробки
Додати розробку
