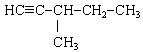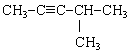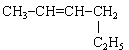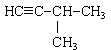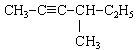Урок "Алкіни, ізомерія, номенклатура, хімічні властивості"
Тема: Вуглеводні.
Тема уроку: Алкіни, ізомерія, номенклатура, хімічні властивості.
Мета уроку:
навчальна: розширити і поглибити знання учнів/учениць про хімічні властивості алкінів на прикладі етину, пояснити суть реакції приєднання за
місцем потрійного зв’язку, продовжувати формувати вміння складати
рівняння хімічних реакцій, в які вступають алкіни.
розвиваюча: розвивати вміння порівнювати, робити висновки, узагальнювати, передбачувати властивості речовин на основі їх будови та навпаки.
виховна: виховувати цілеспрямованість, самостійність.
корекційна: формувати вміння робити логічні висновки, працювати самостійно; конструювати моделі молекул вуглеводнів.
Тип уроку: урок засвоєння нових знань.
Форми роботи: фронтальна робота, самостійна робота учнів.
Методи навчання: словесні (бесіда, пояснення), демонстрація, практичні
(виконання вправ).
Ключові компетентності: вільне володіння державною мовою, компетентності в галузі природничих наук, техніки і технологій.
Обладнання: моделі молекул вуглеводнів.
ХІД УРОКУ
Організаційний етап
Перевірка домашнього завдання
1. Охарактеризуйте просторову будову молекул алкенів.
2. Чим зумовлена ізомерія алкенів? З кого починається ізомерія?
3. У реакції якого типу вступають ненасичені вуглеводні?
4. Порівняйте активність алкенів з активністю алканів: хто більш реакційно
здатний?
Вивчення нового матеріалу
АЛКІНИ
- Алкіни (ацетиленові вуглеводні) – вуглеводні, молекули яких містять один потрійний зв'язок.
Загальна формула алкінів СnH2n-2.
Найпростіші представники:
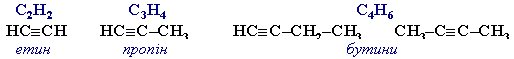
Потрійний зв'язок ![]() здійснюють 6 загальних електронів:
здійснюють 6 загальних електронів: ![]() .
.

Будова потрійного зв'язку ![]()
Потрійний зв'язок є комбінацією однієї σ і двох π-зв'язків, утворюваних двома sp-гібридизованими атомами Карбону.
π -Зв'язки розташовуються у взаємно перпендикулярних площинах.
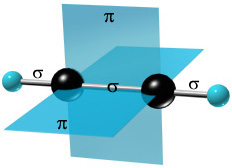
σ -Зв'язки, що утворюються sp–гібридними орбіталями Карбону, розташовуються на одній прямій (під кутом 180° один до одного). Тому молекула ацетилену має лінійну будову:
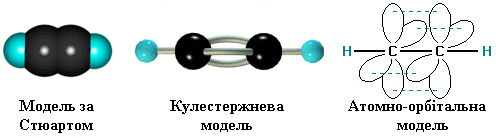
Довжина потрійного зв'язку становить 0,120нм, і значно коротша за довжину C–C (0,154нм) для алкану і C=C (0,133нм) для алкену.
Номенклатура алкінів
Назви ацетиленових вуглеводнів утворюють від назв відповідних алканів (з тим же числом атомів Карбону) шляхом заміни суфікса –ан на –ін (-ин):
2 атома С етан етин; 3 атома С пропан пропин і т.д.
Головний ланцюг вибирається так, щоб він обов'язково включав потрійний зв'язок (тобто він може бути не найдовшим).
Нумерацію атомів Карбону починають з ближнього до потрійного зв'язку кінця ланцюга. Цифра, що позначає положення потрійного зв'язку, ставиться звичайно після суфікса –ин. Наприклад:
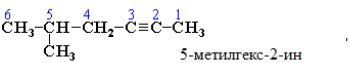
Ізомерія алкінів
Структурна ізомерія
- Ізомерія положення потрійного зв'язку (починаючи з С4Н6):

- Ізомерія карбонового скелета (починаючи з С5Н8):
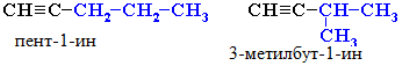
- Міжкласова ізомерія. Алкіни є ізомерами алкадієнів – сполук з двома подвійними зв’язками.
Властивості алкінів
Фізичні властивості. Температури кипіння і плавлення ацетиленових вуглеводнів збільшуються із зростанням їх молекулярної маси. За звичайних умов алкіни С2Н2-С4Н6 – гази, С5Н8-С16Н30 – рідини, з С17Н32 – тверді речовини. Температури кипіння і плавлення алкінів вище, ніж у відповідних алкенів (табл.1).
Таблиця1. Фізичні властивості алкенів і алкінів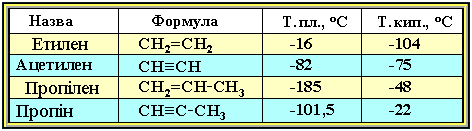
Алкіни погано розчинні у воді, краще – в органічних розчинниках. Наявність потрійного зв'язку в ланцюзі приводить до підвищення температури кипіння, густини і розчинності їх у воді в порівнянні з алканами.
Розвантажувальна вправа «Пошук спільного». Діти об’єднується в пари, члени якої знаходять певну кількість загальних ознак (в одязі, звичках, рисах характеру тощо), потім двійки об’єднуються в четвірки з тією ж метою і т.д. Далі на свій розсуд вчитель/вчителька може зупинити процес на четвірках, вісімках тощо.
Хімічні властивості зумовлені наявністю в їх молекулі потрійного зв’язку
-С≡С-. Цей зв’язок – поєднання одного - та двох -зв’язків. Атоми Карбону, які утворюють такий зв’язок перебувають у стані sp-гібридизації. Довжина зв’язку -С≡С- 1,205Å, довжина зв’язку ºС–Н – 1,059Å. Енергія -С≡С- 836 кДж/моль, і значно менша ніж сума енергій трьох одинарних зв’язків. Хімічні властивості алкінів схожі з алкенами, що обумовлено їхньою ненасиченістю.
Реакції приєднання до алкінів
1. Гідрування
У присутності каталізаторів (Pt, Ni) алкіни приєднують водень з утворенням алкенів (розривається перший π-зв'язок), а потім алканів (розривається другий π-зв'язок):
![]()
При використовуванні менш активного каталізатора [Pd/CaCO3/Pb(CH3COO)2] гідрування зупиняється на стадії утворення алкенів.
2. Галогенування
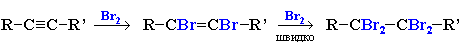
Алкіни знебарвлюють бромну воду (якісна реакція). https://www.youtube.com/watch?v=uY_l0QTgJQs
3. Гідрогалогенування
Продукти приєднання до несиметричних алкінів визначаються правилом Марковнікова:
![]()
Гідрохлорування ацетилену використовується в одному з промислових способів отримання вінілхлорида:
![]()
Вінілхлорид є початковою речовиною (мономером) у виробництві полівінілхлориду (ПВХ).
4. Гідратація (реакція Кучерова)
Приєднання води відбувається у присутності каталізатора солі меркурію(II) і йде через утворення нестійкого спирту, який ізомеризується в оцтовий альдегід (у разі ацетилену):
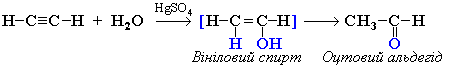
або в кетон (у разі інших алкінів): 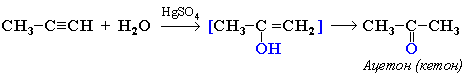
5. Циклізація
1. Димерізація під дією водно-амоніачного розчину CuCl:
![]()
2. Тримерізація ацетилену над активованим вугіллям приводить до утворення бензену (реакція Зелінського):
![]()
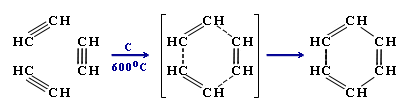
Окиснення алкінів
Алкіни знебарвлюють розчин KMnO4, що використовується для їх якісного визначення. http://surl.li/gogfx
При згоранні (повному окисленні) ацетилену виділяється велика кількість тепла:
![]()
https://www.youtube.com/watch?v=VJQv82KGNOM
Температура ацетиленово-кисневого полум'я досягає 2800- 30000 С. На цьому засновано застосування ацетилену для зварювання і різання металу. Ацетилен утворює з повітрям і киснем вибухонебезпечні суміші. В стислому, і особливо в зрідженому, стані він здатний вибухати від удару. Тому ацетилен зберігається в сталевих балонах у вигляді розчинів в ацетоні, яким просочують азбест або кизельгур.
Утворення алкінідів (ацетиленідів).
Завдяки "кислому" характеру атома Гідрогену біля потрійного зв'язку алкіни здатні вступати в реакції заміщення. В алкінів кислотні властивості проявлені сильніше ніж в амоніаку і алкенах, але слабше ніж в спиртах. Вони утворюють солі, які називаються ацетиленідами.
Алкіни здатні реагувати з багатьма металами з утворенням алкінідів або ацетиленідів. Ацетиленіди d-металів нестійкі і вибухають від удару. Атом Гідрогену біля атома Карбону з потрійним зв’язком заміщується на метал:
СН≡СН + 2NaNH2 → 2NH3 + Na–C≡С–Na
натрій ацетиленід
2HC≡CH + 2K → 2HC≡CK + H2 (калій ацетиленід)
СН≡СН + 2[Cu(NH3)2]OH → 4NH3 + 2H2O + Cu–C≡С–Cu купрум(І) ацетиленід.
Ацетиленіди здатні утворювати лише ацетилен та алкіни, що місять кінцевий потрійний зв’язок R–C≡СH.
CH3-C≡CH + [Ag(NH3)2]OH → CH3–C≡CAg + H2O + 2NH3
Ізомеризація. Під дією сильних основ алкіни здатні ізомеризуватись.
Застосування алкінів
Найбільше практичне значення мають ацетилен ![]() і вінілацетилен
і вінілацетилен ![]() (бутен-3-ін-1).
(бутен-3-ін-1).
Ацетилен використовується для отримання найрізноманітніших речовин:
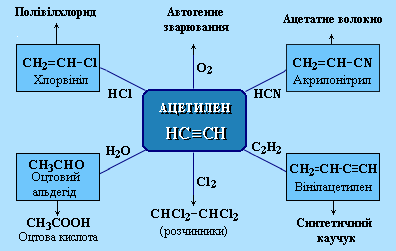
Вінілацетилен є важливим проміжним продуктом у виробництві масло- і бензостійкого синтетичного хлоропренового каучуку:
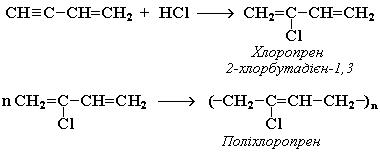
Закріплення вивченого матеріалу:
- Індивідуально: створити моделі пент-1-ину; пент2-ину.
- У двох посудинах пропан і пропен, як їх можна розрізнити?
- Закінчити рівняння реакцій:
С4Н6 + НBr → …
С3Н4 + 2Н2 →…
С2Н2 + …→ C2H2Cl4
Домашнє завдання: параграф 7.
1. Які з наведених сполук відносяться до алкінів:
|
а) |
г) |
Відповідь 1: а, б, в
Відповідь 2: б, в, г
Відповідь 3: а, в, д
Відповідь 4: а, в
Відповідь 1: трьох σ-зв'язків
Відповідь 2: одного σ- і двох π-зв'язків
Відповідь 3: двох σ- і одного π-зв'язку
Відповідь 4: трьох π-зв'язків
3. Ізомерами 3-метилпент-1-ина є . . .
|
а) |
б) |
в) |
|
г) |
д) |
е) |
Відповідь 1: а, в
Відповідь 2: б, в
Відповідь 3: г, д
Відповідь 4: д, е
4. Вибухова речовина утворюється в реакції . . .
Відповідь 1: ![]()
Відповідь 2: ![]()
Відповідь 3: ![]()
Відповідь 4: ![]()
- Написати рівняння реакцій відповідно до перетворень:
![]()
![]() С2Н2 С2Н4 С2Н6 СО2
С2Н2 С2Н4 С2Н6 СО2
С2Н2Вr4 С2Н4Cl2


про публікацію авторської розробки
Додати розробку