Урок "Багатоманітність речовин та хімічних реакцій. Взаємозв’язки між речовинами та їхні взаємоперетворення"
Мета уроку
Навчальна. Узагальнити знання учнів про речовини та їх багатоманітність, взаємозв'язки між речовинами та їх взаємоперетворення, сприяти доведенню думки про єдність живої та неживої природи, цілісність світу, продовжувати формувати між предметні зв'язки з біологією.
Розвивальна. Розвивати в учнів інтерес до вивчення хімії, логічне мислення, аналізувати і робити висновки.
Виховна. Виховувати повагу до думки інших, вміння висловлюватися, акуратність, спостережливість, самостійність.
Тема. Багатоманітність речовин та хімічних реакцій. Взаємозв’язки між речовинами та їхні взаємоперетворення
Мета уроку.
Навчальна. Узагальнити знання учнів про речовини та їх багатоманітність, взаємозв’язки між речовинами та їх взаємоперетворення, сприяти доведенню думки про єдність живої та неживої природи, цілісність світу, продовжувати формувати між предметні зв’язки з біологією.
Розвивальна. Розвивати в учнів інтерес до вивчення хімії, логічне мислення, аналізувати і робити висновки.
Виховна. Виховувати повагу до думки інших, вміння висловлюватися, акуратність, спостережливість, самостійність.
Тип уроку: вивчення нового матеріалу.
Хід уроку
I. Організація класу
II. Мотивація навчальної діяльності
- Як запобігти негативному впливу забруднювачів у побуті?
- Як запобігти негативному впливу забруднювачів у сільському господарстві?
- Як запобігти негативному впливу забруднювачів у промисловості?
ІІІ. Вивчення нового матеріалу
Матерія — фундаментальне поняття, пов’язане з будь-якими об’єктами, що існують у природі. Один з основних видів матерії — речовина, яка може бути у вигляді фізичних тіл (матеріальних об’єктів), що мають масу, об’єм і відділені від інших фізичних тіл границями поділу.
Речовина складається з атомів (від давньогр. ατομος — неподільний). Цю ідею вперше висловив давньогрецький філософ Левкіпп, а розвинув його учень Демокріт 2400 років тому (а ще задовго до них — давньоіндійські філософи).
Уже в ХХ ст науковці з’ясували, що атом складається з невеликого позитивно зарядженого (протонно-нейтронного) ядра та електронів, що рухаються навколо нього. У ядрі зосереджена майже вся маса атома.
Атоми певного виду називають хімічними елементами.
Елемент — це сукупність атомів з однаковим зарядом ядер (Z).
Зі 118 відомих нині хімічних елементів 94 виявлені в природі, інші — створені штучно за останні кілька десятиріч у лабораторіях як результат складних фізичних експериментів.
Завдяки хімічним зв’язкам атоми можуть об’єднуватись у молекули і формувати прості речовини. Кожний хімічний елемент утворює як мінімум одну просту речовину. Однак іще у XVІІІ ст. було з’ясовано, що деякі елементи утворюють кілька простих речовин. Усі дані про такі речовини 1840 р. узагальнив шведський хімік Й. Берцеліус. Він же і дав назву цьому явищу: алотропія (давньогр. αλλος — інший, τροπος — властивість) — утворення елементом кількох простих речовин. Самі ж прості речовини назвали алотропічними видозмінами (модифікаціями). Сьогодні відомо близько 400 простих речовин. Їх утворюють неметалічні (Сульфур, Карбон, Оксиген, Селен, Фосфор, Бор, Арсен, Германій) та металічні елементи (Кaльцій, Скандій, Tитан, Mанган, Фeрум, Кoбальт, Стронцій тощо).
За нормальних умов одинадцять елементів (H, He, N, O, F, Ne, Cl, Ar, Kr, Xe, Rn) утворюють газоподібні прості речовини, два (Br, Hg) — рідини, решта — тверді тіла.
Отже, слід розрізняти речовину як вид матерії та речовини як хімічні сполуки.
Хімічні властивості елемента визначають електрони зовнішнього енергетичного шару атома.
Згідно з теорією хімічного зв’язку, належність хімічних елементів до металічних чи неметалічних визначається здатністю їх атомів віддавати або приєднувати електрони в хімічних реакціях.
Найсильніше металічні властивості виражені в тих елементів, атоми яких найлегше віддають електрони. Металічність елемента (здатність виявляти металічні властивості) залежить від енергії, яку необхідно витратити для того, щоб відірвати від атома найслабше зв’язаний з ядром електрон і перетворити атом у позитивно заряджений йон (енергії йонізації). Що менша енергія йонізації, то легше атом віддає електрон і відповідно сильніше виявляє металічні властивості.
Неметалічні властивості проявляють елементи, здатні притягувати до себе електрони. Кількісною характеристикою неметалічності хімічного елемента є енергія, яка виділяється в разі приєднання електрона до нейтрального атома під час перетворення останнього в негативно заряджений іон (спорідненість до електрона).
Молекула — це найдрібніша частинка речовини, що складається із двох та більше атомів, має постійний якісний і кількісний склад. Молекула є найменшою частинкою речовини, що зберігає її хімічні властивості.
Є елементи, атоми яких не сполучаються один з одним. Прості речовини, які вони утворюють, складаються з окремих атомів. Групу таких газоподібних речовин називають інертними (благородними). Атоми решти елементів не можуть навіть короткий час перебувати в ізольованому стані. Вони вступають у взаємодію один з одним або з іншими елементами.
Молекули складних речовин (хімічних сполук) утворені різними елементами. Їх хімічні властивості залежать від типу атомів, з яких утворені молекули, їх кількості, характеру зв’язку між ними та їх просторового розташування. Ці обставини є причиною практично безмежного різноманіття хімічних сполук. Сьогодні їх відомо понад 100 млн. Зазвичай їх отримують штучно в результаті хімічних реакцій.
Хімічні реакції розрізняють:
- за типом перетворення реагентів (сполучення, розкладу, заміщення, обміну);
- за тепловим ефектом (ендо- й екзотермічні);
- за ознакою зміни ступенів окиснення (окисно-відновні й такі, що відбуваються без зміни ступеня окиснення елементів);
- за оборотністю (оборотні та необоротні).
Під час сполучення атомів виникає хімічний зв’язок.
Хімічний зв’язок — це явище взаємодії атомів, зумовлене перекриванням (усуспільненням) їх електронних хмар, що супроводжується зменшенням повної енергії системи.
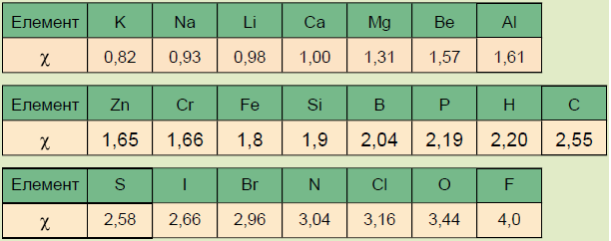
Залежно від того, як здійснюється перерозподіл електронної хмари між атомами, розрізняють ковалентний, йонний, металічний та водневий види хімічного зв’язку. Цей перерозподіл відбувається відповідно до значень електронегативнос-тей елементів, що беруть участь в утворенні сполуки.
Електронегативність — це умовна величина, яка характеризує здатність атомів елемента в хімічних сполуках притягувати до себе електрони, що беруть участь в утворенні хімічних зв’язків.
Що менша енергія йонізації елемента, то менша його електронегативність. Що більша спорідненість елемента до електрона, то більша його електронегатив-ність. Сам термін, поняття і першу шкалу відносних електронегативностей увів американський хімік Л. Полінг. Значення електронегативності елементів коливається в межах від 0,7 у Франція до 4 у Флуора.
Виникнення ковалентного зв’язку відбувається завдяки утворенню між атомами неметалічних елементів однієї або кількох спільних електронних пар.
Спільні електронні пари між атомами виникають завдяки наявності неспаре-них електронів зовнішнього енергетичного рівня (валентних), які й беруть участь в утворенні хімічного зв’язку.
Залежно від того, які атоми утворюють між собою спільні електронні пари — різних елементів чи однакових, — ковалентний зв’язок може бути полярним чи неполярним. Відповідно до цього і молекули будуть полярними або неполярними.
Якщо спільна електронна пара розміщена на однаковій відстані від атомних ядер обох атомів, такий зв’язок називають ковалентним неполярним. Він виникає між однаковими атомами (одного елемента) з утворенням простої речовини (Н2, F2, N2).
Якщо зв’язок утворюють різні елементи, спільна електронна пара дещо зміщена в бік одного з атомних ядер (більш електронегативного елемента). Унаслідок цього атоми набувають часткового заряду: більш електронегативний — часткового негативного (дельта мінус, δ–), менш електронегативний — часткового позитивного заряду (дельта плюс, δ+). Такий зв’язок називають ковалентним полярним.
Що більша різниця електронегативностей в атомів елементів, які зв’язуються, то сильніше відбувається зміщення електронної густини до більш електронегативного елемента.
Низка сполук з полярним ковалентним зв’язком, які містять Гідроген та елемент з високою електронегативністю (найчастіше Оксиген, Флуор, Нітроген), утворюють водневий зв’язок. Це різновид невалентного міжмолекулярного зв’язку, який виникає між атомами Гідрогену однієї молекули з поляризованим атомом іншої молекули внаслідок набуття ними протилежних часткових електричних зарядів.
Якщо різниця електронегативностей пари атомів, що утворюють зв’язок, не менша ніж 2,1 (за Полінгом), між ними утворюється йонний зв’язок.
Зазвичай йонний зв’язок утворюється між металічними і неметалічними елементами. Атоми металічних елементів віддають електрони і перетворюються на катіони. Атоми неметалічних елементів приєднують електрони і перетворюються на аніони. За звичайних умов такі сполуки — тверді кристалічні речовини.
Більшість речовин у твердому стані утворює кристали. Кожний кристал має просторовий каркас правильної форми у вигляді кристалічних ґраток.
У вузлах молекулярних ґраток містяться молекули; вони зв’язані між собою міжмолекулярними зв’язками. Це речовини з ковалентним зв’язком: майже всі прості речовини-неметали (за винятком речовин, утворених атомами Карбону і Силіцію), багато складних неорганічних сполук (H2O, NH3, HF тощо), усі органічні речовини з нейонним зв’язком.
У вузлах атомних ґраток розміщено атоми. Це так само речовини з ковалентним зв’язком. До них належать: алмаз, карборунд SiС, силіцій(ІV) оксид SiО2, деякі інші неорганічні речовини. Такі речовини тверді, нелеткі, не розчиняються у воді, виявляють властивості діелектриків або напівпровідників.
Йонні ґратки формують речовини з йонним типом зв’язку; вони зв’язані між собою електростатичними силами (ці сили міцніші за молекулярні, але слабші за атомні). Такі речовини тверді, крихкі, нелеткі, з доволі високими температурами плавлення й кипіння, у водних розчинах і в розплавах — провідники електричного струму.
Атоми металів відносно легко віддають валентні електрони не лише під час хімічних реакцій металів з іншими речовинами, а й під час утворення простих речовин (металів, їх сплавів). Електрони стають спільними. У речовинах, які утворені металічними хімічними елементами, між атомами виникає металічний зв’язок. Йони в кристалі розміщуються дуже щільно, але кристалічні ґратки різних металів різняться просторовою структурою і компактністю упаковки частинок, що й впливає на фізичні властивості цих металів.
Між класами речовин — простими (металами і неметалами) і складними (оксидами, кислотами, основами, солями) — наявний зв’язок і можливість взаємного переходу.
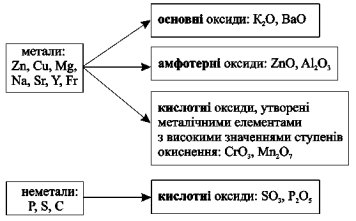
Зв’язки між класами неорганічних речовин, які ґрунтуються на одержанні речовин одного класу з речовин іншого класу, називають генетичними:
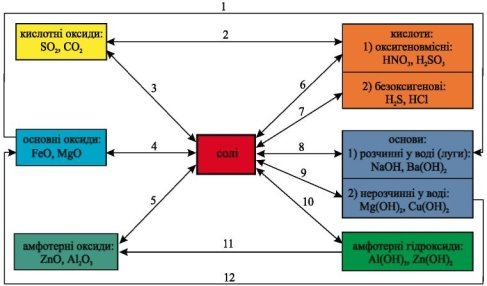
Аналогічні зв’язки наявні й між класами органічних речовин.
IV. Закріплення вивченого матеріалу.
Контрольні запитання
- Дайте визначення атома.
- Які складові частини атома?
- Чому простих речовин є значно більше, ніж хімічних елементів?
- Які речовини називають простими, а які — складними? Наведіть приклади.
- На які групи поділяють прості речовини? Наведіть приклади.
- Які є типи хімічних зв’язків? Наведіть приклади.
- Які особливості будови йонних сполук?
- Чи можна сказати «молекула калій хлориду»? Відповідь аргументуйте.
- Хімічна формула кальцій хлориду СаCl2. Яку інформацію несе ця формула?
10. Які загальні фізичні властивості металів?
Вправи та задачі
1. Напишіть рівняння реакцій, за допомогою яких можна здійснити перетворення: K2О ![]() KOH
KOH ![]() K2СО3
K2СО3 ![]() KCl
KCl ![]() KNO3.
KNO3.
Укажіть тип кожної з них. Чи є серед них окисно-відновні?
2. Укажіть формули речовини, які мають йонний тип зв’язку: OF2, KF, K2O, СО2, BaCl2, NaCl. Відповідь поясніть.
Йонний зв'язок: KF, K2O, BaCl2, NaCl.
3. Напишіть рівняння реакцій, за якими, маючи лише цинк, сірку, натрій, купрум(ІІ) сульфат і воду, можна одержати: а) дві основи; б) чотири солі.
a) Na + H2O = NaOH + H2↑
NaOH + CuSO4 = Na2SO4 + Cu(OH)2↓ (основа)
Zn + CuSO4 = ZnSO4 (сіль) + Cu
NaOH + ZnSO4 = Na2SO4 (сіль) + Zn(OH)2↓ (основа)
б)
Zn + S = ZnS (сіль)
Na + ZnS = Zn + Na2S (сіль)
4. Напишіть рівняння реакцій, за допомогою яких можна здійснити перетворення: алюміній ![]() алюміній хлорид
алюміній хлорид ![]() алюміній гідроксид
алюміній гідроксид ![]() алюміній оксид
алюміній оксид ![]() алюміній сульфат
алюміній сульфат ![]() магній сульфат
магній сульфат ![]() калій сульфат. Укажіть тип кожної з них. Чи є серед них окисно-відновні? Які?
калій сульфат. Укажіть тип кожної з них. Чи є серед них окисно-відновні? Які?
2Al + 6HCl = 2AlCl3 + 3H2↑ - заміщення, окисновідновна.
AlCl3 + 3NaOH = Al(OH)3↓ + 3NaCl – обміну, безокисновідновна.
2Al(OH)3↓ ![]() Al2O3 + 3H2O – розкладу, безокисновідновна.
Al2O3 + 3H2O – розкладу, безокисновідновна.
Al2O3 + 3SO3 = Al2(SO4)3 – сполучення, безокисновідновна.
Al2(SO4)3 + 3Mg = 3MgSO4 + 2Al – заміщення, окисновідновна.
MgSO4 + 2K = K2SO4 + Mg – заміщення, окисновідновна.
5. Укажіть формули речовини, які мають ковалентний полярний вид зв’язку: Н2О2, Na2O, PCl3, K3N, Cl2, N2, NF3, CaF2. Відповідь поясніть.
Ковалентний полярний вид зв’язку: Н2О2, PCl3, NF3,
6. Наведіть приклади металічних елементів, назви яких відрізняються від назв утворених ними металів.
Ферум (залізо), Гідраргірум (ртуть), Аурум (золото), Супрум (мідь), Аргентум (срібло)…
7. Визначте невідомі речовини у схемі перетворень:
Cu ![]() CuO
CuO ![]() X
X ![]() X1
X1 ![]() CuO
CuO ![]() X2
X2 ![]() ZnSO4.
ZnSO4.
Напишіть рівняння відповідних реакцій, укажіть тип кожної з них. Які з них є окисно-відновними? Чи однозначні відповіді для речовин X і X2? Якщо ні, то наведіть приклади.
2Cu + O2 = 2CuO – сполучення, окисновідновна.
CuO + H2SO4 = CuSO4 + H2O – обміну, безокисновідновна.
CuSO4 + 2KOH = Cu(OH)2↓ + K2SO4 – обміну, безокисновідновна.
Cu(OH)2 = CuO + H2O – розкладу, безокисновідновна.
H2SO4 + CuO = CuSO4 + H2O – обміну, безокисновідновна.
Zn + CuSO4 = ZnSO4 + Cu – заміщення, окисновідновна.
V. Підбиття підсумків уроку
VІ. Домашнє завдання.
Опрацювати § 43. Виконати № 1 ст. 218.


про публікацію авторської розробки
Додати розробку
