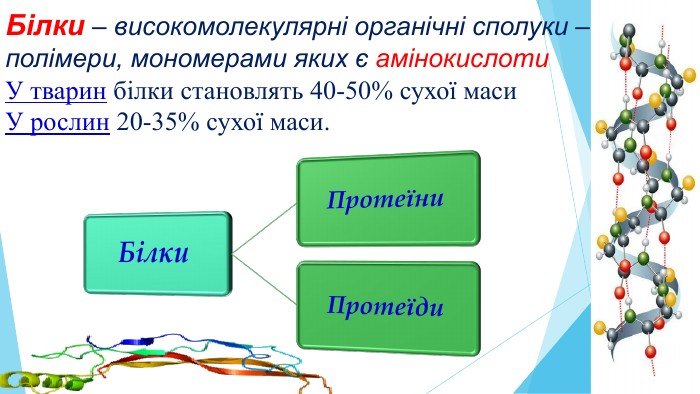
Урок. Білки, їх структура, властивості, значення для існування живих організмів




























Антуан Франсуа де Фуркруа. Білкові речовини були відомі ще з давніх часів. На початку XIII ст. було встановлено, що речовини, які знаходяться в соках рослин, екстрактах тваринних тканин, мають однакову природу. На початку XVIII ст (1728р) французький хімік Антуан де Фуркруа детально вивчив склад білків сироватки крові – фібрин. У той час були досліджені такі білки, як альбумін з яєчних білків, глютен із зерна пшениці. Голландський хімік Герріт Мульдер провів аналіз складу білків і виявив, що практично всі білки мають однакову емпіричну формулу. В 1839р Г. Мульдер назвав білки протеїнами (грец. перший)М’язи-80%; шкіра-63%; печінка-57%; кістки-28%; головний мозок-45%
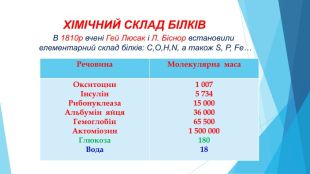
{5 C22544 A-7 EE6-4342-B048-85 BDC9 FD1 C3 A}Речовина. Молекулярна маса. ОкситоцинІнсулін. Рибонуклеаза. Альбумін яйця. Гемоглобін. Актоміозин. Глюкоза. Вода1 0075 73415 00036 00065 5001 500 00018018 ХІМІЧНИЙ СКЛАД БІЛКІВ В 1810р вчені Гей Люсак і Л. Біснор встановили елементарний склад білків: C,O,H,N, а також S, P, Fe… ppt_x
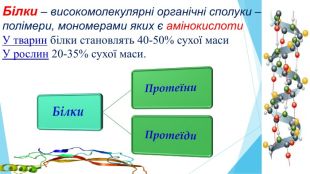
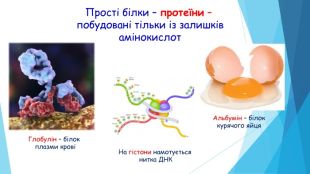
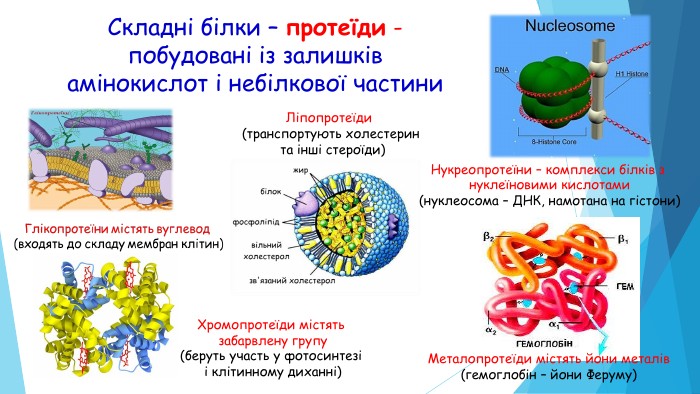
Складні білки – протеїди - побудовані із залишківамінокислот і небілкової частини. Ліпопротеїди (транспортують холестерин та інші стероїди)Хромопротеїди містять забарвлену групу(беруть участь у фотосинтезі і клітинному диханні)Нукреопротеїни – комплекси білків з нуклеїновими кислотами(нуклеосома – ДНК, намотана на гістони)Металопротеїди містять йони металів(гемоглобін – йони Феруму)
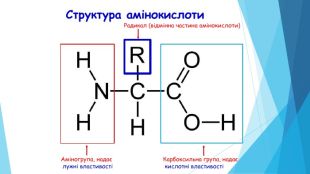
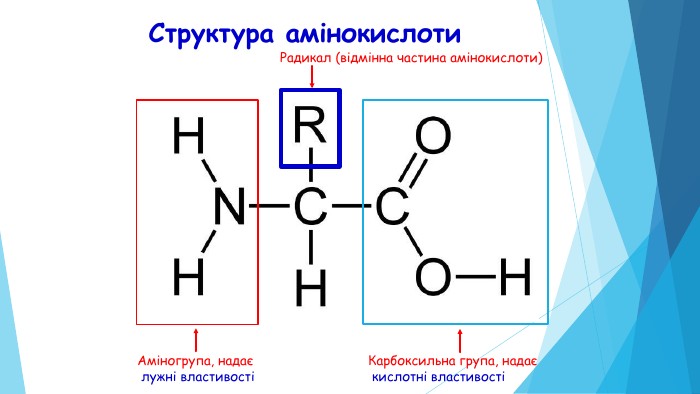
20 амінокислот, з яких будуються білки живих організмів, поділяють на: замінні – амінокислоти, що синтезуються організмом людини і тварин (10) незамінні – амінокислоти, що не синтезуються, а надходять з їжею (10)L (довжина АК) складає 0,35нм. Mr (відносна молекулярна маса амінокислоти) дорівнює 100 Да (а.о.м.)
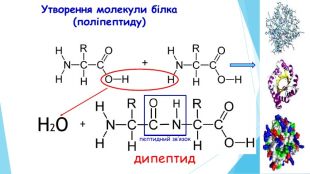
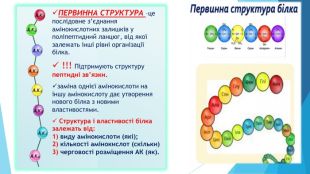
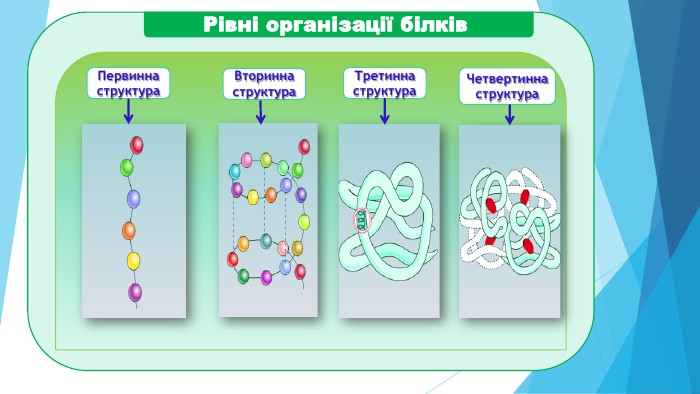
ПЕРВИННА СТРУКТУРА –це послідовне з’єднання амінокислотних залишків у поліпептидний ланцюг, від якої залежать інші рівні організації білка. !!! Підтримують структуру пептидні зв’язки.заміна однієї амінокислоти на іншу амінокислоту дає утворення нового білка з новими властивостями. Структура і властивості білка залежать від:1) виду амінокислоти (які); 2) кількості амінокислот (скільки) 3) черговості розміщення АК (як).
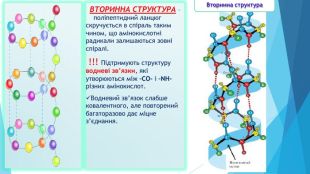
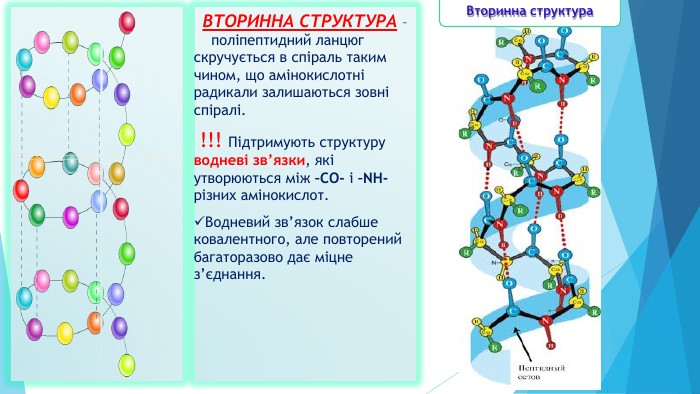
ВТОРИННА СТРУКТУРА – поліпептидний ланцюг скручується в спіраль таким чином, що амінокислотні радикали залишаються зовні спіралі. !!! Підтримують структуру водневі зв’язки, які утворюються між –СО- і –NH- різних амінокислот. Водневий зв’язок слабше ковалентного, але повторений багаторазово дає міцне з’єднання. Вторинна структура
Фізичні властивості білків. Дуже різноманітні: Білок курячого яйця – це в’язка безбарвна речовина, яка частково розчиняється у воді або в розчині кухонної соліМ’які, добре розчинні (альбумін);Тверді, не змішуються з водою, стійкі (кератин - роги, копита, нігті, пір’я; хітін – панцирі крабів, павуків);Інші білки не стійкі, при дії різних чинників середовища ( підвищення t, опромінювання, механічна дія, дія ряду хімічних речовин…) руйнуються. Слабкі зв’язки, які підтимують вторинну, третинну , четвертинну структури руйнуються і молекула білка розкручується – це приводить до порушення природної структури білка – денатурації.ppt_x
Денатурація - складний процес порушення природної структури білка, при якому молекула білка розкручується. Ренатурація – процес відновлення молекули білка до природної структури.!!! Можливий при збереженні первинної структури (пептидних зв’язків)Деструкція - це необоротний процес руйнування первинної структури білка.
Функції білківкаталітична. Ферменти – біологічні каталізатори білкової природи, що в сотні разів прискорюють хімічні реакції. БУВАЮТЬ: Прості ферменти містятьтільки амінокислоти:пепсин,трипсин, амілаза. Складні ферменти містятьактивну частину (білкову) – апофермент та небілкову – кофермент (не діє без активного центра)!!! Властивості ферментів: 1) дія фермента специфічна;2) ферменти прискорюють швидкість хім. реакції, але самі в реакції не витрачаються; 3) невелика кількість ферменту сприяє перебудові великої кількості субстрату; 4) активність ферменту залежить від: t, Ph середовища, тиску, концентрації речовини та фермента…;5) Присутність фермента не впливає ні на властивості, ні на природу субстрату та кінцевого продукту.


про публікацію авторської розробки
Додати розробку