Урок: "Будова атома: ядро й електронна оболонка. Склад атомних ядер"
- Урок5.ppt ppt
- Урок№5.doc doc
- Фильм_0002.wmv wmv
- Фильм_0003.wmv wmv
Урок №4
Тема. Будова атома: ядро й електронна оболонка. Склад атомних ядер
Мета: поглибити знання про будову атома. Порівняти властивості елементарних частинок: протонів, нейтронів, електронів. Розвивати вміння використовувати ці знання для характеристики будь-якого атома хімічного елемента Періодичної системи.
Обладнання: Мультимедійна дошка зі звуковими колонками
хід уроку
- Організація класу
Перевірка домашнього завдання, гра «Хрестики-нулики»
- Актуалізація опорних знань
- Що таке атом?
- На що вказує порядковий номер елемента у ПС?
- Який розмір ядра, порівняно з розміром атома?
- Що відбувається з атомами під час проходження хімічної реакції?
- Що означає «атом» в перекладі з грецької?
- Мотивація навчальної діяльності
Саме усвідомлення складної будови атома допоможе зрозуміти суть періодичного закону і широко використовувати ПС як джерело інформації про хімічні елементи та їх сполуки. Але сьогоднішній урок – це лише початок цього усвідомлення. Отже запишемо тему уроку.
- Вивчення нового матеріалу
Встановлення складної будови атомів. (Розповідь учителя)
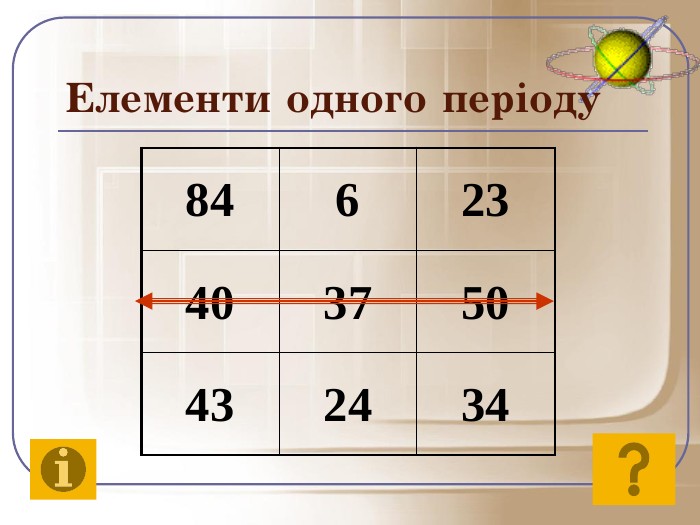
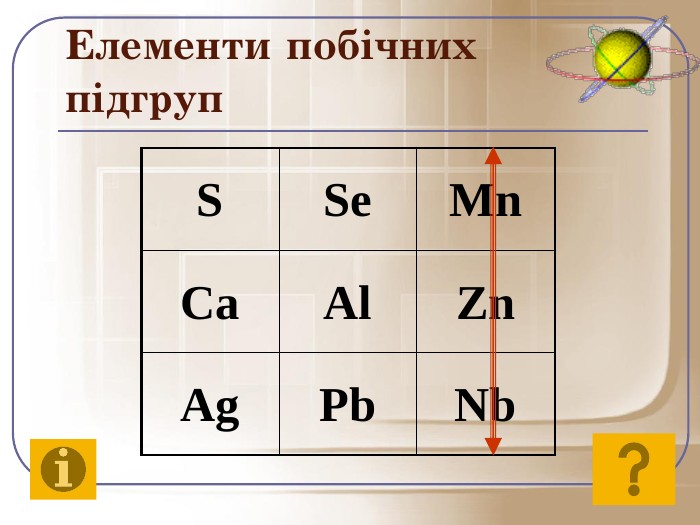
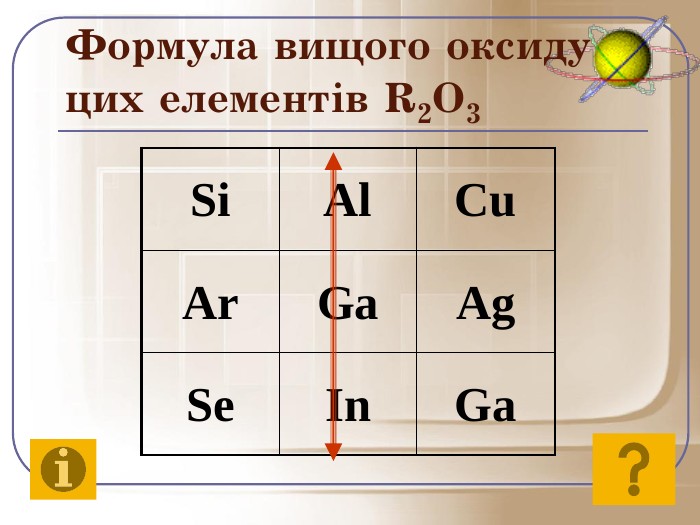
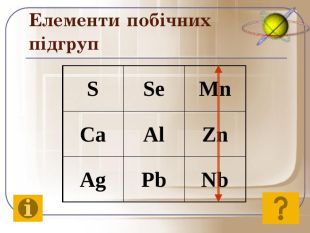
До початку ХХ століття була відома лише одна кількісна характеристика атомів – відносна атомна маса, що була взята за основу при класифікації хімічних елементів. Але цим не можна було пояснити причини періодичності їх властивостей. Було не зрозуміло, чому атоми із близькою масою, наприклад Алюміній і Силіцій, сильно відрізняються за властивостями, у той час як атоми з різними масами, наприклад Літій і Натрій, можуть мати подібні властивості. Це наводило на думку про те, що атом має складну будову. Відкриття періодичного закону підштовхнуло вчених до нових досліджень з метою глибшого його розуміння.
Найбільших успіхів у вивченні будови атома досяг англійський учений Ернест Резерфорд (перегляд відеофрагменту).
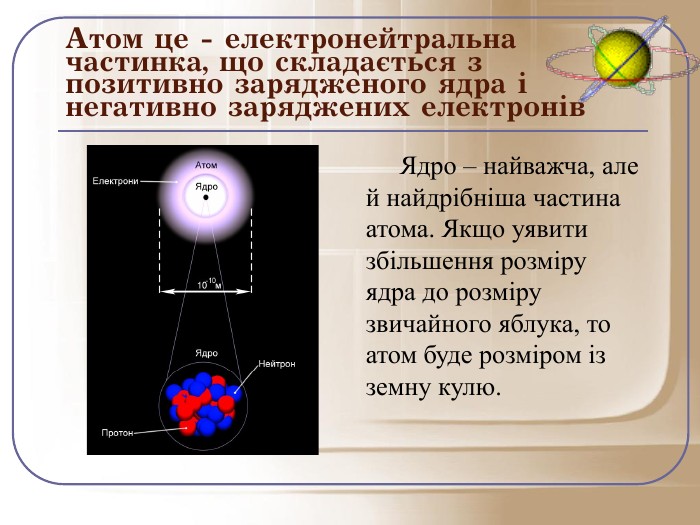
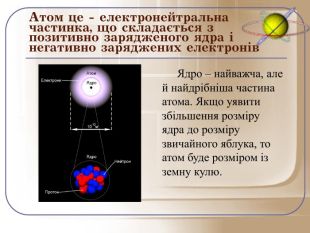
Ядро – найважча, але й найдрібніша частина атома. Маса ядра становить близько 99,97% від маси атома, а його радіус приблизно в сто тисяч разів менше радіуса атома. Якщо уявити збільшення розміру ядра до розміру звичайного яблука, то атом буде розміром із земну кулю.
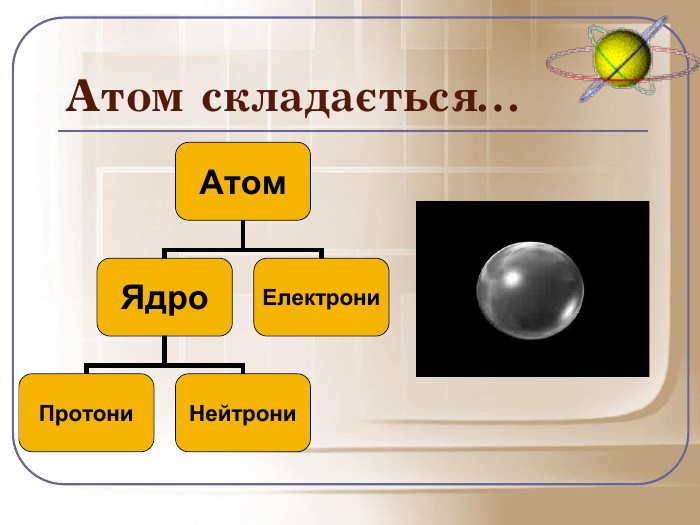
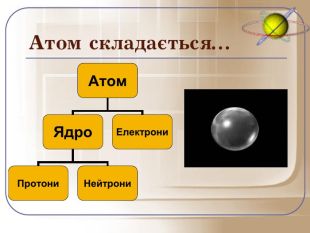
Отже, давайте попробуємо пригадати почуте і дати ще раз визначення атома: це електронейтральна частинка, що складається з позитивно зарядженого ядра і негативно заряджених електронів.
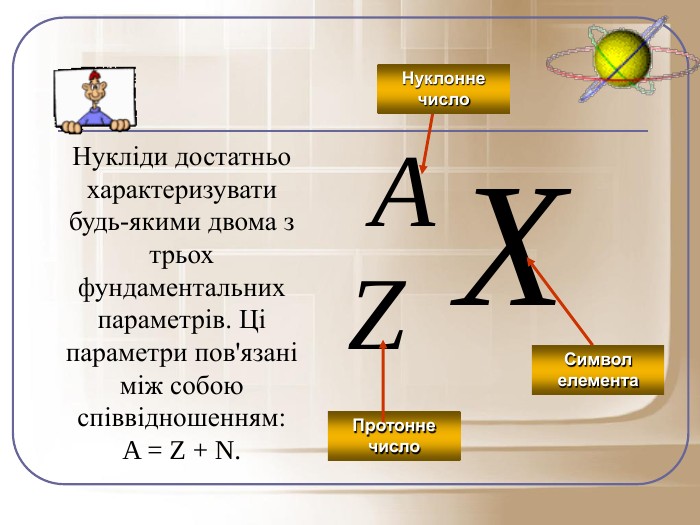
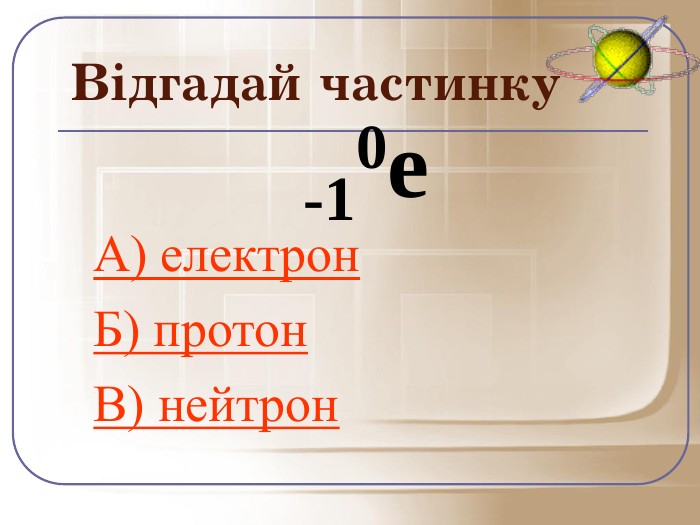
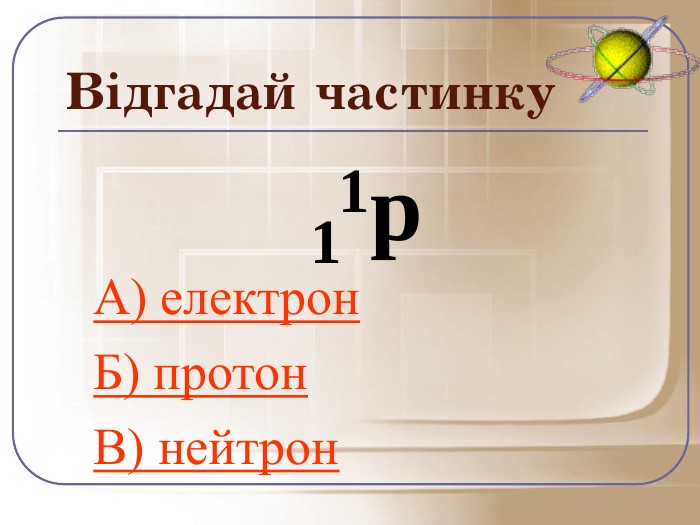
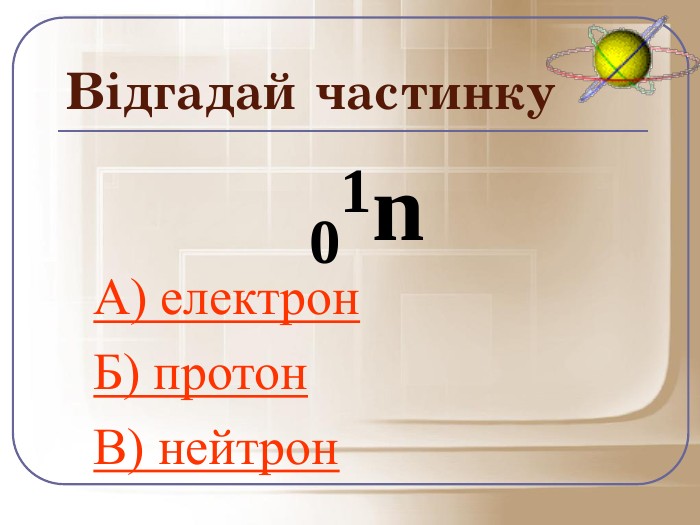
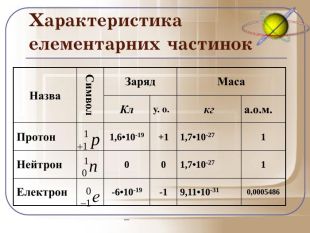
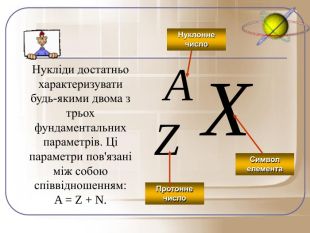
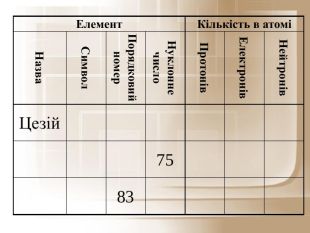
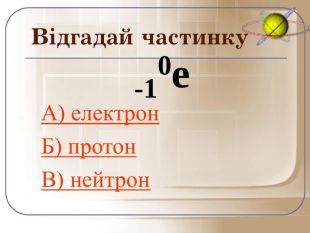
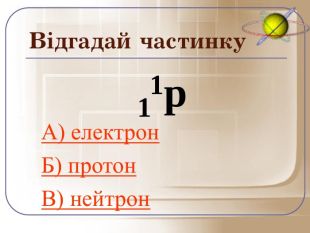
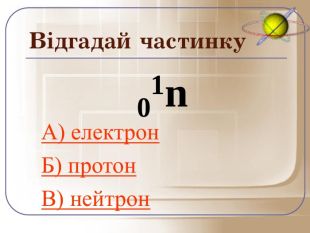
Загальне число протонів і нейтронів у ядрі визначає масу атома та називається нуклонним числом . Різні види атомів мають загальну назву — нукліди. Нукліди достатньо характеризувати будь-якими двома з трьох фундаментальних параметрів: — масове число, Z — заряд ядра, що дорівнює числу Протонів, N — число нейтронів у ядрі. Ці параметри пов'язані між собою співвідношенням:
A = Z + N.
Спробуємо свої сили виконуючи вправу 203(ст.. 143) підручника.
- Осмислення вивченого
А зараз ми пограємо у гру відгадай частинку. Якщо відгадаєте правильно то почуєте аплодисменти, а якщо ні… То і звук буде іншим.
- Рефлексія
Ви бачите на дошці картинку, уважно придивіться і впізнайте в одному з чоловічків себе, свій стан на уроці вийдіть до дошки і зафарбуйте його, якщо він виявиться зафарбованим то обведіть його (Як варіант при бракові часу можна просто ставити певну позначку біля того чоловічка з яким асоціює себе учень.) (аналізуючи відповіді учнів вчитель робить оцінку ефективності уроку)
- Домашнє завдання
Вивчити §23, Впр. 204


про публікацію авторської розробки
Додати розробку