Урок "Будова електронних оболонок"
Будова електронних оболонок атомів. Енергетичні рівні і підрівні. 8 клас
Цілі й завдання: Розширити уявлення учнів про будову атомів; навчити складати електронні формули, схеми розподілу електронів по квантових комірках для елементів І—III періодів; формувати вміння учнів визначати електронну будову атома за його положенням у періодичній системі; формувати уявлення учнів про завершений і незавершений енергетичний рівень.
Тип уроку: узагальнювальний із засвоєнням нових знань (комбінований).
Обладнання: мультимедійна дошка, проектор, Періодична система хімічних елементів Д.І. Менделєєва.
Методи та прийоми: інтерактивна технологія «Мікрофон», гра «Назвіть елемент», тестовий контроль, розповідь вчителя, складання опорного конспекту, робота з таблицями (додаток 2,3).
План уроку:
І. Організаційний момент.
ІІ. Перевірка знань і вмінь.
ІІІ. Актуалізація опорних знань.
ІV. Мотивація навчальної діяльності.
V. Вивчення нового матеріалу.
VІ. Закріплення отриманих знань.
VІІ. Підсумок уроку.
VІІІ. Домашнє завдання.
Хід уроку
І. Організаційний момент.
Добрий день, дорогі діти! Розпочати урок я хочу з загадки:
На базарі їх не купиш,
На дорозі не знайдеш,
Їх не зважиш на терезах
І ціни не підбереш.
Про що ж таке важливе й дорогоцінне йде мова? (Знання). Так, дійсно. Ми з вами продовжуємо вивчати тему «Періодичний закон і періодична система хімічних елементів Д.І. Менделєєва. Будова атома» . І сьогодні на уроці, хто з вас буде уважним, отримає цілий оберемок знань, а дехто – малесеньку жменьку. Тому бажаю вам збагатитися знаннями, які будуть оцінюватися балами. За кількістю зароблених балів ви отримаєте оцінку за урок.
ІІ. Перевірка знань і вмінь.
Інтерактивна технологія «Мікрофон». Дати пояснення таким поняттям, датам, термінам.
- 1869 рік.
- Атомна маса.
- Група.
- Період.
- Електрони.
- Протони.
- Нейтрони.
- Нуклонне число.
- Протонне число.
- 1986 рік.
- Спін.
- Орбіталь.
- Хімічний елемент.
- Ізотопи.
- Ядро.
- Радіонукліди.
(За вірні відповіді в «Картку самооцінювання» учні виставляють бали.
Ш. Актуалізація опорних знань.
Учитель: Із періодичної системи ми отримуємо багато інформації про елемент, властивості простих та складних речовин, які утворює цей елемент. За допомогою гри «Укажіть елемент» перевіряємо уміння користуватися періодичною системою.
- Порядковий номер елемента 13.
- Заряд ядра атома + 20.
- Відносна атомна маса елемента 52.
- 3агальна кількість електронів у атомі 15.
- У ядрі цього атома 21 протон.
- Елемент II періоду V групи.
- Радіоактивний елемент VII періоду II групи головної підгрупи.
- Елемент II групи, атом якого має 2 енергетичні рівні.
- Сума протонів та нейтронів у атомі цього елемента – 24.
- Сума протонів та нейтронів у атомі цього елемента – 48.
- Хімічний елемент входить до складу сульфатної кислоти, мешкає в III періоді VI групи.
- Заряд ядра атома +17.
- Кількість електронів у атомі 25.
- Елемент, що відповідає за міцність кісток людини. Його відносна атомна маса – 40.
- У ядрі атома 29 протонів.
- Загальна кількість електронів у атомі 7.
- Нуклонне число в атомі елемента 65.
- Існування цього елемента передбачив і описав його властивості Д.І. Менделєєв. Елемент знаходиться в ІV періоді III групи головної підгрупи.
- Хімічний елемент IV періоду VIII групи побічної підгрупи, що входить до складу крові людини.
Учитель: Ви добре справились із грою, яка була свого роду розминкою перед тестовим контролем.
Тестовий контроль.
- Частину простору в атомі, де перебування електрона наймовірніше називають:
а) орбітою;
б) орбіталлю;
в) енергетичним рівнем;
г) енергетичним підрівнем.
- Орбіталі, що мають сферичну форму називають:
а) s — орбіталями;
б) р — орбіталями;
в) d - орбіталями;
г) f— орбіталями.
- Електрони, що перебувають на р - орбіталі називають:
а) s - електронами;
б) р - електронами;
в) d - електронами;
г) f - електронами.
- На другому енергетичному рівні максимально можуть розміщуватися:
а) 2 електрони;
б) 4 електрони;
в) 8 електронів;
г) 18 електронів.
- Другий енергетичний рівень складається з підрівнів:
а) s;
б) s, р;
в) s, р, d;
г) s, р, d, f .
- На р підрівні максимально можна розмістити:
а) 2 електрони;
б) 6 електронів;
в) 8 електронів;
г) 10 електронів.
7. Кількість енергетичних рівнів у атомі відповідає:
а) номеру группи, в якій розміщений елемент;
б) номеру періода;
в) порядковому номеру елемента.
8. Елементом III періоду IV групи є:
а) А1;
б) Sі;
в) Р;
г) Gа.
9. Елементом, атом якого містить 16 електронів є:
а) S;
б) Р;
в) В;
г) С.
10. Елементом у атомі якого сума протонів і нейтронів дорівнює 20 є:
а) К;
б) Са;
в) Аr;
г) Nе.
Взаємоперевірка тестового контролю ( на екрані наведено відповіді, учні виставляють бали в «Картку самооцінювання»).
ІV. Мотивація навчальної діяльності.
Ми вже маємо уявлення про особливості руху електронів у атомі, ознайомилися з характеристикою деяких орбіталей, з'ясували, що таке спін електрона, навчилися розпізнавати s та р електрони за формою їх орбіталей. Сьогодні ми навчимося розташовувати електрони за орбіталями навколо ядра у елементів І - III періодів, навчимося прогнозувати валентність елемента за кількістю електронів на зовнішньому енергетичному рівні, установимо залежність між номером періода та кількістю енергетичних рівнів у атомі елемента.
V. Вивчення нового матеріалу.
Учитель: Усе в навколишньому світі прагне перейти в стан із найменшою енергією. Електрони в атомі розміщуються так, щоб їх енергія була мінімальною. Розглянемо, як заповнюють електрони енергетичні рівні та підрівні у елементів І-ІІІ періодів. Для кращого запам'ятовування скористаємось алгоритмом.
Алгоритм складання електронної формули:
- Визначаємо кількість електронів за протонним числом (порядковим номером).
- Визначаємо кількість енергетичних рівнів за номером періода.
- З'ясовуємо за таблицею (додаток 2) кількість підрівнів і їх позначення.
-
Визначаємо максимальну кількість електронів на енергетичних рівнях за формулою
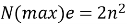 .
.
- Пам'ятаємо, що на одній орбіталі одночасно може знаходитись не більше 2-х електронів.
Учитель: Назвіть елемент І періоду?
Визначте який заряд ядра у атома Гідрогена?
Скільки електронів у атома Гідрогена?
![]()
![]() Навколо позитивно зарядженого ядра рухається 1 електрон, що розташований на першому енергетичному рівні. Проілюструємо вище сказане електронною і графічною формулою:
Навколо позитивно зарядженого ядра рухається 1 електрон, що розташований на першому енергетичному рівні. Проілюструємо вище сказане електронною і графічною формулою: ![]() .
.
Завдання: Складіть електронні та графічні формули для атомів Гелію, Літію (робота учня біля дошки за наведеним алгоритмом).
Висновок: у атома Літію електрони розташовуються на двох енергетичних рівнях — перший рівень внутрішній, а другий рівень — зовнішній. Електрони, розміщені на зовнішньому енергетичному рівні називають зовнішніми.
Учитель: У періодичній системі використовують скорочений запис електронної формули. Для атома Літію він є таким: [Не]![]() . Символ елемента Гелію у квадратних дужках означає, що внутрішня частина електронної оболонки атома Літію така сама, як і електронна оболонка атома Гелію (
. Символ елемента Гелію у квадратних дужках означає, що внутрішня частина електронної оболонки атома Літію така сама, як і електронна оболонка атома Гелію (![]() ). Скорочені записи електронних формул атомів містяться в короткому варіанті періодичної системи.
). Скорочені записи електронних формул атомів містяться в короткому варіанті періодичної системи.
Завдання. Складіть електронні та графічні формули для атомів: Be, B, C, N, O, F, Ne (робота учнів біля дошки, розбираємо принципи заповнення електронних орбіталей, використовуючи додаток 2,3).
Завдання. Проаналізуйте, за наведеними формулами, чи існує взаємозв’язок між кількістю електронів на зовнішньому енергетичному рівні, валентністю та номером групи.
Висновок: Кількість електронів на зовнішньому енергетичному рівні у атомі вказує на можливе значення валентності елемента та відповідає номеру групи.
Вчитель: В атомі елемента № 11 Натрію починається заповнення третього енергетичного рівня. На ньому з’являється один електрон:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() 3s 3p 3d
3s 3p 3d
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() 2s 2p
2s 2p
![]()
![]()
![]() 1s
1s
![]() 1s22s22p63s1, або [Ne]3s1
1s22s22p63s1, або [Ne]3s1
Стан атома, в якому орбіталі заповнені електронами згідно з принципом найменшої енергії, називають основним. (Основний і збуджений стан атому карбону роздивляємося на наступному уроці.)
VІ. Закріплення отриманих знань.
- Знайдіть електронну формулу Нітрогену.
а) 1s22s22p61s22s5;
б) 1s22р5;
в) 1s2р5;
г) 1s22s22р3.
- Яка електронна конфігурація відтворює будову атома Оксигену?
а) 1s22s23s23p2;
б) 1s2;
в) 1s22s32p4;
г) 1s22s22p4; .
- Яка електронна конфігурація відтворює будову атома Сульфуру?
а) 1s22s22p63s23p23d2;
б) 1s22s22p63s23d4;
в) 1s22s22p43d23s23p4;
г) 1s22s22p63s23p4.
- Яка конфігурація зовнішнього електронного шару відповідає будові атома Кальцію?
а) 3s23p23d2;
б) 2s22p2;
в) 4s2;
г) 3s2.
- Яка конфігурація зовнішнього електронного шару відповідає будові атома Арсену?
а) 3s23p63d3;
б) 4s24p3;
в) 4s24p2;
г) 3s23p3.
- Атому якого елемента відповідає електронна формула 1s22s22p63s23p3?
а) Нітроген;
б) Силіцій;
в) Фосфор;
г) Сульфур.
- Атому якого елемента відповідає електронна формула ... 3s23p5?
а) Флуор;
б) Хлор;
в) Натрій;
г) Магній.
VІІ. Підсумок уроку. Аналіз роботи учнів. Виставлення оцінок
Користуючись «Карткой самооцінювання», учні оцінюють за трибальною системою рівень своїх знань з питань, що розглядались на уроці. Аналіз карток дасть можливість виявити, що саме діти не засвоїли та ліквідувати прогалини на наступному уроці
VІІІ. Домашнє завдання.
Вивчити параграф 26 (ст. 157-161), складіть електронно-графічну формулу для елементів із порядковими номерами 12-18.
Література:
- Т.М. Гранкіна, О.В. Григорович, Ю.В. Ісаєнко. Хімія. 9 клас. – Х.: «Ранок» , 2003. – 320ст.
- О.В. Григорович, А.В. Віценцик, О.М. Гостиннікова. Хімія. 8 клас. – Х.: «Ранок», 2008. – 272ст.
- В.Є. Данільченко, Є.В. Халімон. Хімія. Навчальний посібник. 8 – 9 класи. – Х.: «Країна мрій», 2008. – 128ст.
- Критерії оцінювання навчальних досягнень учнів у системі загальноосвітніх середніх шкіл. – К.: «Ірпінь», 2004. – 176ст.
- П.П. Попень, Л.С. Крикля. Хімія. Підручник для 8 класу загальноосвітніх навчальних закладів. – К.: ВЦ «Академія», 2008. – 232ст.


про публікацію авторської розробки
Додати розробку
