Урок "Директорська контрольна робота за І семестр"
І варіант
Рівень І (Кожне завдання оцінюється в 1 бал)
1. Установіть відповідність.
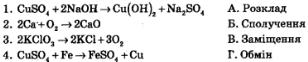
2. Виберіть формулу сильного електроліта:
а) CuS04; б) НС1, в) LiОН, г) С
3. Речовина, що приєднує електрони в окисно-відновній реакції, називається:
а) відновником; в) окисником;
б) ізотопом; г) приймачем.
4. Установіть відповідність.
A. СаСІ2 Б.NaOH B. HN03
1. Н+, N03- 2. Са2+, 2С1- 3. Na+, ОН-
5. Сильні електроліти в розчині:
а) дисоціюють поетапно; б) дисоціюють повністю; в) не дисоціюють
Рівень ІІ (Кожне завдання оцінюється в 1.5 бали)
1. Напишіть у молекулярній, йонній формах рівняння взаємодії:
ZnSO4 й NaOH
2. Виставте ступені окиснення та розставте коефіцієнти в рівняннях реакцій методом електронного балансу, вкажіть окисники й відновники, а також процес окиснення та процес відновлення.
Со + HNO3→ Co(NO3)2 + N2+ H2O
Рівень ІІІ (Кожне завдання оцінюється в 2 бали)
1. При спалюванні магнію масою 30г виділилось 751, 5 кДж теплоти. Складіть термохімічне рівняння горіння магнію.
2. Обчисліть об'єм газу (н. у.), що виділиться внаслідок дії надлишку HCl на розчин Na2CO3 масою 400 г
з масовою часткою 37,4%.
І варіант
Рівень І (Кожне завдання оцінюється в 1 бал)
1. Установіть відповідність.
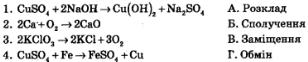
2. Виберіть формулу сильного електроліта:
а) CuS04; б) НС1, в)LiОН, г) С
3. Речовина, що приєднує електрони в окисно-відновній реакції, називається:
а) відновником; в) окисником;
б) ізотопом; г) приймачем.
4. Установіть відповідність.
A. СаСІ2 Б.NaOH B. HN03
1. Н+, N03- 2. Са2+, 2С1- 3. Na+, ОН-
5. Сильні електроліти в розчині:
а) дисоціюють поетапно; б) дисоціюють повністю; в) не дисоціюють
Рівень ІІ (Кожне завдання оцінюється в 1.5 бали)
1. Напишіть у йонній формі рівняння взаємодії:
ZnSO4 й NaOH
2. Виставте ступені окиснення та розставте коефіцієнти в рівняннях реакцій методом електронного балансу, вкажіть окисники й відновники, а також процес окиснення та процес відновлення.
Со + HNO3→ Co(NO3)2 + N2+ H2O
Рівень ІІІ (Кожне завдання оцінюється в 2 бали)
1. При спалюванні магнію масою 30г виділилось 751, 5 кДж теплоти. Складіть термохімічне рівняння горіння магнію.
2. Обчисліть об'єм газу (н. у.), що виділиться внаслідок дії надлишку HCl на розчин Na2CO3 масою 400 г
з масовою часткою 37,4%.
Варіант ІІ
Рівень І (Кожне завдання оцінюється в 1 бал)
1.Установітьвідповідність
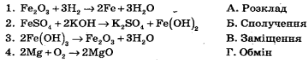
2. Виберіть формулу кислоти - електроліта:
a)NaOH; б) MgCl2; в)С02; г)H2S04.
3. Речовина, що віддає електрони в окисно-відновній реакції, називається:
а) відновником; б) ізотопом; в) окисником; г) приймачем
4. Установіть відповідність.
A. Ва(ОН)2 Б. Na2S04 B. H2S04
1. Ва2+,20Н" 2. 2Н+ , S042- 3. 2Na+, S042-
5. На розчинність речовин у воді впливає:
а) забарвлення розчину; б)природа речовини;
в) температура; г) агрегатний стан речовини
Рівень ІІ (Кожне завдання оцінюється в 1.5 бали)
1. Напишіть у йонній формі рівняння взаємодії:
Na2CO3 й HCl
2. Виставте ступені окиснення та розставте коефіцієнти в рівняннях реакцій методом електронного балансу, вкажіть окисники й відновники, а також процес окиснення та процес відновлення.
Сu + H2SO4→ CuSO4 + SO2+ H2O
Рівень ІІІ (Кожне завдання оцінюється в 2 бали)
1.При розкладанні 24,4г CaCO3 поглинулось 35,5 кДж теплоти. Напишіть термохімічні рівняння розкладу кальцій карбонату.
2. Обчисліть масу осаду, одержаного в результаті взаємодії розчину CuCl2 масою 120 г з масовою часткою солі 37,5 % і розчину NaOH.
Варіант ІІ
Рівень І (Кожне завдання оцінюється в 1 бал)
1.Установітьвідповідність
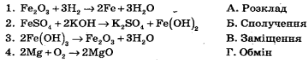
2. Виберіть формулу кислоти - електроліта:
a)NaOH; б) MgCl2; в)С02; г)H2S04.
3. Речовина, що віддає електрони в окисно-відновній реакції, називається:
а) відновником; б) ізотопом; в) окисником; г) приймачем
4. Установіть відповідність.
A. Ва(ОН)2 Б. Na2S04 B. H2S04
1. Ва2+,20Н" 2. 2Н+ , S042- 3. 2Na+, S042-
5. На розчинність речовин у воді впливає:
а) забарвлення розчину; б)природа речовини;
в) температура; г) агрегатний стан речовини
Рівень ІІ (Кожне завдання оцінюється в 1.5 бали)
1. Напишіть у йонній формі рівняння взаємодії:
Na2CO3 й HCl
2. Виставте ступені окиснення та розставте коефіцієнти в рівняннях реакцій методом електронного балансу, вкажіть окисники й відновники, а також процес окиснення та процес відновлення.
Сu + H2SO4→ CuSO4 + SO2+ H2O
Рівень ІІІ (Кожне завдання оцінюється в 2 бали)
1.При розкладанні 24,4г CaCO3 поглинулось 35,5 кДж теплоти. Напишіть термохімічні рівняння розкладу кальцій карбонату.
2. Обчисліть масу осаду, одержаного в результаті взаємодії розчину CuCl2 масою 120 г з масовою часткою солі 37,5 % і розчину NaOH.


про публікацію авторської розробки
Додати розробку
