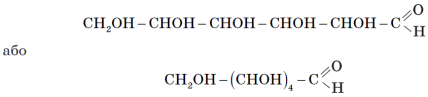Глюкоза. Будова, властивості, застосування.
Тема уроку. Глюкоза. Будова, властивості, застосування
Мета:
навчальна: вивчити будову глюкози, її особливості як представника речовин із подвійними властивостями з позиції причинно-наслідкової залежності між складом, будовою та характеристиками; розглянути її поширеність у природі та значення для життєдіяльності організму;
розвивальна: продовжити формувати вміння учнів порівнювати та узагальнювати на прикладах матеріалу про будову і властивості альдегідів та спиртів; формувати вміння складати рівняння хімічних реакцій, що характеризують властивості глюкози, уміння виконувати лабораторні досліди, робити висновки із спостережень;
виховна: виховувати ініціативність, наполегливість у досягненні кращих результатів навчання.
Тип уроку: комбінований урок засвоєння знань, умінь і навичок і творчого застосування їх на практиці.
Форми роботи: проблемний виклад матеріалу (бесіда) із застосуванням особистісно зорієнтованого підходу у вивченні хімії, демонстрація, експериментальне дослідження, групова робота, повідомлення учнів.
Лабораторний дослід. Взаємодія глюкози з купрум (II) гідроксидом.
І. Організація класу
ІІ. Перевірка домашнього завдання. Актуалізація опорних знань
Завдання для обговорення записуються або проектуються на дошці.
1) З перелічених сполук виберіть ті, що можуть утворюватися в результаті гідролізу жирів:
а) одноатомні спирти;
б) гліцерин;
в) етиленгліколь;
г) мурашина кислота;
д) пальмітинова кислота.
2) Як зміниться температура плавлення жиру зі збільшенням умісту ненасичених кислот?
3) Масляноізоаміловий естер має запах ананасів. Напишіть формулу цього естеру, запропонуйте спосіб його практичного використання.
4) Чому жири належать до біологічно активних речовин?
6) Напишіть структурні формули двох можливих ізомерів жиру, до складу якого входять один залишок пальмітинової та два залишки стеаринової кислоти.
ІІІ Мотивація навчальної діяльності
Створення проблемної ситуації шляхом використання запитань
Перед вами на столі – дві коробки. В одній із них знаходиться річ, без якої не уявляє життя прекрасна половина людства. Якби ця річ зникла, то всі жінки світу, напевно, були б у розпачі. В іншій коробці – речовина, яку всі люблять, вона тане в руках, але слід залишає на губах. Ці речі об’єднує одна хімічна речовина. Що ж це за речі, в ході уроку ви здогадаєтеся й назвете ці предмети.
Проблемні запитання
- Чому нестача глюкози в організмі викликає непритомність?
- Чому для угамування спраги краще пити виноградний сік?
- Що знаходиться в коробках?
ІV. Повідомлення теми та мети уроку
- Що ми будемо робити на сьогоднішньому уроці?(Вивчимо будову та властивості глюкози)
- Як ми це будемо робити? (За допомогою експерименту).
- Для чого ми це робитимемо? (Щоб навчитись застосовувати закони і теорії для встановлення залежності між властивостями та будовою речовини, знати практичне використання глюкози , вміти виявити її у продуктах харчування)
V. Вивчення нового матеріалу
1. Історичні відомості
- У 1870 р. німці Рудольф Фіттіг і Адольф Байєр вивели хімічну формулу глюкози, виходячи з її властивостей.
- У 1890 р. німець Еміль Фішер синтезував глюкозу, тим самим довівши її будову.
- У 1902 р. француз Луї Жозеф Пруст отримав глюкозу з винограду.
2. Визначення молекулярної формули глюкози.
Спробуємо визначити молекулярну формулу глюкози, розв’язавши розрахункову задачу.( Індивідуально розв’язує учень на дошці)
3. Глюкоза
Розповідь учителя
Найпростіший представник вуглеводів — глюкоза, має молекулярну формулу C6H12O6. За своєю будовою глюкоза — складна багатофункціональна сполука, що містить п’ять гідроксильних груп і одну альдегідну групу (− COH):
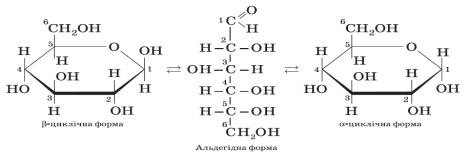
Як показали дослідження, у розчині глюкози є молекули лінійної й циклічної будови.
До якого класу органічних сполук можна зарахувати глюкозу? (Багатоатомні спирти, альдегіди)
Розгляньмо схему ізомеризації молекули глюкози:
Глюкоза — цінна поживна речовина. У результаті її окиснення в тканинах вивільняється енергія, необхідна для нормальної життєдіяльності організмів. Реакцію окиснення можна описати сумарним рівнянням: C6H12O6 + 6O2 → 6CO2 + 6H2O
Глюкоза застосовується в медицині для приготування лікувальних препаратів, консервування крові, внутрішньовенного вливання тощо. Вона широко застосовується в кондитерському виробництві, у виробництві дзеркал та іграшок (сріблення). Нею користуються під час фарбування й апретування тканин і шкір.
Як довести, що глюкоза має п’ять гідроксильних груп?
Взаємодія глюкози з купрум(II) гідроксидом
Приготуємо купрум(II) гідроксид, додамо до одержаного осаду розчин глюкози. Що спостерігаємо? Про що свідчать розчинення і яскраво-синє забарвлення розчину? (Глюкоза — багатоатомний спирт)
Тепер, дотримуючись правил нагрівання, підігріємо пробірку. Що спостерігаємо? Зміна забарвлення пов’язана з відновними властивостями альдегідної групи. Рівняння можна сумарно записати так:
Купрум (I) оксид яскраво-оранжевого кольору. Цю реакцію використовують як якісну реакцію на глюкозу.
Як альдегід глюкоза вступає в реакції приєднання (відновлюється):
Важливе значення для життєдіяльності людини й тварин мають реакції бродіння глюкози.
Спиртове бродіння:
5. Це цікаво
В організмах деяких жаб глюкоза знайшла незвичайне застосування. У зимовий час інколи можна знайти жаб, які повмерзали в льодяні глиби, але після розмерзання земноводні оживають. Який же тут секрет? З настанням холодів у крові жаб у 60 разів збільшується кількість глюкози. Це й заважає утворення всередині організму кристалів льоду, що було б для них смертельним.
6.Поширення в природі
(презентація учнівського проекту)
VІ. Експериментальна робота
Тема. Виявлення глюкози у продуктах харчування.
Мета: виявити глюкозу в продуктах харчування.
Обладнання: пробірки із соками, розчин меду, розчини: купрум сульфату та натрій гідроксиду.
Хід роботи
1) Приготувати розчин купрум гідроксиду.
2) Додати розчин у пробірку з соком.
3) Нагріти пробірку.
4) Зробити висновок.
VI. Презентація учнівських проектів
(Учні попередньо отримали завдання – підготувати інформацію про глюкозу в побуті та медицині.)
VII. Підбиття підсумків уроку
Давайте дамо відповіді на питання, що турбували нас на початку уроку.
Рефлексія
- Які у вас виникли труднощі?
- Що здалося найбільш цікавим?
- Що вас здивувало?
- Які знання допомогли вам дослідити глюкозу?
VIII. Домашнє завдання

про публікацію авторської розробки
Додати розробку