Урок " Дослід Резерфорда. Протонно - нейтронна модель атома"
9 клас
Тема. Дослід Резерфорда. Протонно – нейтронна модель атома.
Мета: ознайомити учнів із дослідами Резерфорда та новим видом взаємодії між компонентами ядра атома – ядерними силами, ввести поняття стійкості ядер ; поглибити та розширити знання учнів про будову атома ; формувати у учнів інформаційну компетентність; розвивати творчий потенціал учнів, вміння аналізувати науковий матеріал ; виховувати культуру спілкування.
Міжпредметні зв’язки: математика, хімія, інформатика.
Тип уроку. Урок засвоєння нових знань та умінь.
Обладнання та наочність: відеофільм « Дослід Резерфорда», інтерактивні симуляції з фізики PhET, періодична таблиця хімічних елементів, пластилінові кульки червоного та синього кольору для моделювання ядер атомів, освітня платформа « На Урок»
Формування ключових компетентностей:
*Математична грамотність
*Компетентності в природничих науках і технологіях
*Уміння навчатися впродовж життя
Хід уроку
І. Організація початку уроку.
Створення психологічної атмосфери уроку. Привітання. Ознайомлення учнів з планом проведення уроку.
ІІ. Актуалізація опорних знань
- Інтерактивна вправа « Фізичне доміно’’Закінчи фрази’’ »
Скласти речення з словами «атом», «ядро» користуючись знаннями попередніх класів.
Атом складається з …
Всі атоми хімічних елементів розміщщені у …
Ядро складється з …
Заряд атома…
Позитивний йон…
- Розшифруй анаграми
|
торпон |
протон |
|
релонект |
електрон |
|
трейнон |
нейтрон |
ІІІ.Мотивація навчальної діяльності.
Алхіміки середньовіччя мріяли про філософський камінь, що перетворював би всі речовини на золото. «Сучасна алхімія» - так назве Е.Резерфорд свою книгу про перетворення атомних ядер. Про те, як змінюється ядро під час радіоактивного випромінювання і за якими законами відбувається цей процес, дізнаємось згодом. А сьогодні ми проаналізуємло дослід Резерфода і удосконалимо знання про будову атома.
Оголошення теми та мети уроку
ІV. Вивчення нового матеріалу.
- Повідомлення учня (Історична довідка )
Історію виникнення загальних уявлень про атом починається з часів грецького філософа Демокріта( близько 460- 370 р. до нашої ери), який багато розмірковував про найменшу частинку речовини. « Всі тіла складаються з найдрібніших, невидимих і вічно рухомих частинок- атомів»
Джозеф Джон Томсон відкрив електрон ще в 1897 році. Виходячи з того, що атом електрично нейтральний, вчений створив модель: атом складається з позитивно зарядженої кулі, заряд якої рівномірно розподілений по всьому об’єму, і негативно заряджених електронів, розкиданих по об’єму. Її назвали « Модель пудинга».
 Виходячи з моделі атома Томсона, можна було пояснити явища йонізації атомів, електролізу, періодичну систему елементів.
Виходячи з моделі атома Томсона, можна було пояснити явища йонізації атомів, електролізу, періодичну систему елементів.
Німецький фізик Ф. Ленард у 1903 р. запропонував модель “порожнього” атома, в середині якого літають нейтральні частинки, складені із взаємно зрівноважених позитивних і негативних зарядів.
Розв’язанню проблеми будови атома присвятили своє життя видатні вчені світу Е. Резерфорд, Х. Гейгер, Н. Бор та інші.
У 1908–1911 рр. під керівництвом Ернеста Резерфорда досвідчений дослідник Ганс Ґейґер (1882–1945) і молодий аспірант Ернест Марсден (1889– 1970) проводили серію дослідів щодо з’ясування структури атома. Для дослідів учені використали речовину, із якої з великою швидкістю вилітали позитивно заряджені частинки — так звані α-частинки (альфа-частинки).
Вузький пучок α-частинок зі свинцевого контейнера спрямовувався на тонку золоту фольгу, а далі потрапляв в екран, покритий шаром кристалів цинку сульфіду. Якщо на такий екран влучала α-частинка, то в місці її влучання відбувався слабкий спалах світла.
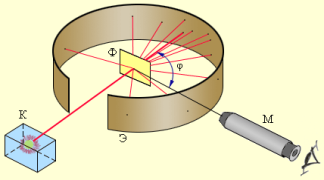
2) Перегляд та обговорення відеофільму « Дослід Резерфорда».
Результати досліду:
- Більшість α-частинок проходила крізь фольгу, не змінюючи напряму або відхилившись на невеликий кут.
- Деякі α-частинки відхилялись на кут 1350-1500; одна із 20000 α-частинок поверталася назад.
Резерфорд: «Це було так неймовірно, ніби ви вистрілили 15-дюймовим снарядом в аркуш папіросного паперу, а снаряд повернувся б назад і потрапив у вас».
Методичний прийом «Мікрофон»
Які б висновки ви зробили із досліду Резерфорда?
- В атомі є пустоти;
- α-частинка проходить біля якихось заряджених частинок;
- α-частинка взаємодіє із позитивно зарядженою частинкою, але більшої маси.
На основі цього Резерфорд запропонував планетарну модель атома:
- Атом складається з позитивно зарядженого ядра, у якому сконцентрована майже вся маса атома. Розміри ядра порядку 10-14-10-15м (атом—10-10м).
- Навколо масивного ядра по замкнених орбітах рухаються легкі електрони, загальний негативний заряд яких дорівнює позитивному заряду ядра атома.
Але подальші дослідження показали, що ядро теж має складну будову.
- Будова атома
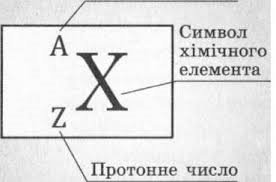
- Ядро складається з позитивно заряджених частинок(протонів - р) і нейтральних частинок (нейтронів - п). Протони і нейтрони, що входять до складу ядра атома, називають нуклонами, ядра атомів узагальнено називають нуклідами. Сумарну кількість протонів і нейтронів в атомі називають нуклонним (або масовим) числом та позначають символом А.
- Кількість протонів у ядрі називають протонним (або зарядовим)
числом та позначають символом Z. Його легко визначити, скориставшись “Періодичною системою хімічних елементів Д. І. Менделєєва”. Порядковий номер хімічного елемента у періодичній таблиці відповідає кількості протонів у ядрі (протонному числу).
![]()
При позначенні ядра атома (нукліда) хімічного елемента перед символом елемента вгорі вказується нуклонне число А, а внизу - протонне число Z.
Види атомів одного хімічного елемента, ядра яких містять однакову кількість протонів, але різну кількість нейтронів, називають ізотопами даного хімічного елемента.
Наприклад, елемент Гідроген має три ізотопи: Протій, Дейтерій, Тритій.
Розвязати задачі.
1.Визначити кількість протонів та нейтроні у атомах 612 С; 73 108Та
2. Ядро атома містить 6 протонів та 7 нейтронів. Який це елемент?
3. Загальна кількість нуклонів у ядрі Оксигену 16. Скільки електронів рухаються навколо ядра?
4) Моделювання
Записати у зошиті кількість протонів, нейтронів та електронів для Берилію 4 9Ве та Літію 3 7Li
Два учні збирають біля дошки моделі з різнокольорових пластилінових кульок
5) Робота з комп’ютером
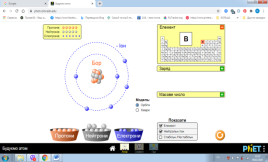
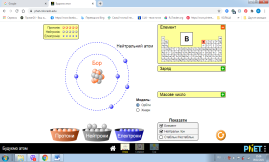
На платформі PhET у фізичних симуляціях знайти « Будуємо атом».
Завдання 1
Змоделювати такі атоми Бору B та Нітрогену N використовуючи символи :
- Нейтральний атом
- Позитивний йон
- Негативний йон
Завдання 2.
У розділі « Гра» виконати тестові завдання 2 та 4.
6) Сильні взаємодії
Сили, які утримують частинки в ядрі, називають ядерними силами.
Основні властивості ядерних сил
- є тільки силами притягання;
- є близькодіючими: вимірювання показали, що ядерні сили між нуклонами виявляються лише на відстанях, які приблизно дорівнюють розмірам нуклона;
- не залежать від заряду: на однаковій відстані сили, що діють між двома протонами, між двома нейтронами або між протоном і нейтроном, є однаковими;
- мають властивість насичення: нуклон виявляється здатним до ядерної взаємодії одночасно лише з невеликою кількістю
нуклонів-«сусідів».
V. Запитання на закріплення.
1.Як визначити кількість протонів і нейтронів у ядрі? Наведіть приклад.
2.Що таке нуклід?
3.Які нукліди називають ізотопами? Назвіть ізотопи Гідрогену.
4. Використання освітньої платформи «На Урок».
Виконання самостійної роботи « Дослід Резерфорда. Будова атота» у реальному часі.
Д/з : вивчити п. 22, виконати впр. 22 №( 1-4)
високий рівень №5

про публікацію авторської розробки
Додати розробку
