Урок. "Електричний струм у рідинах. Застосування електролізу §37-38."
Електричний струм у рідинах.
Застосування електролізу §37-38.
(8 кл.)
Мета: Ввести поняття електроліту, ознайомити з особливостями проходження електричного струму в розчинах і розплавах електролітів. навчити застосовувати закони електролізу Фарадея під час розв’язування задач.
______________________________________________________________________
1. Питання для самоконтролю. ( дати усну відповідь)_________________
1. Чому нагріваються провідники, в яких тече електричний струм?
2. Сформулюйте закон Джоуля — Ленца. Чому він має таку назву?
3. Як математично записують закон Джоуля — Ленца?
4. Які перетворення енергії відбуваються всередині електронагрівника в разі його ввімкнення в електричне коло?
5. Що таке коротке замикання?
6. З якою метою застосовують запобіжники?
2. Прочитати та законспектувати параграф--§37-38..( конспект)___
1). Електроліти
Електроліти — це тверді або рідкі речовини, які мають йону провідність. Розпад речовин на йони внаслідок дії полярних молекул розчинника називають електролітичною дисоціацією (від латин. Dissociatio — роз’єднання, розділення).
Якщо прибрати зовнішнє електричне поле, то іони знов з’єднаються в одну молекулу солі – цей процес називається рекомбінацією.
2). Природа електричного струму в електролітах.
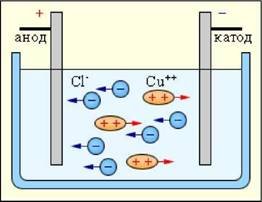 Електрод, з’єднаний із позитивним полюсом джерела струму, називають анодом, а електрод, з’єднаний із негативним полюсом, — катодом.
Електрод, з’єднаний із позитивним полюсом джерела струму, називають анодом, а електрод, з’єднаний із негативним полюсом, — катодом.
Провідність електролітів є іонною, тобто обумовлена рухом в них позитивних і негативних іонів, які утворюються з нейтральної молекул шляхом її розпаду на дві частини, які заряджені рівними за модулем і протилежними за знаком зарядами.
Електричний струм в електролітах являє собою напрямлений рух позитивних і негативних йонів.
Катіонами називають позитивні йони що, рухаються до негативного електрода — катода
Аніонами називають негативні йони ,що рухаються до позитивного електрода — анода
3) Даємо означення електролізу.
Процес виділення речовин на електродах, пов’язанийз окисно -відновними реакціями, які відбуваються на електродах під час проходження струму, називають електролізом.
4). Закон Фарадея
Перший закон Фарадея: Маса речовини, яка виділилась на електроді під час електролізу, прямо пропорційна силі струму та часу, проходження струму через електроліт:
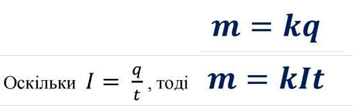
m- маса речовини, яка виділилась на електроді; q - заряд, який пройшов через електроліт; І - сила струму, який іде через електроліт;
k- ( таблиця-8 ст. 231) коефіцієнт пропорційності, який залежить від речовини, яка виділяється на електроді.
Одиниця вимірювання: [k] = 1кг/Кл.
Електрохімічний еквівалент чисельно дорівнює масі певної речовини, яка виділя- ється на електроді внаслідок проходження через електроліт заряду 1 Кл 5). § 38. Застосування електролізу.
Рафінуванням називають спосіб очищення металів за допомогою електролізу. Гальваностегією називають електролітичний спосіб покриття виробу тонким шаром металів
Гальванопластика — це отримання за допомогою електролізу точних копій рельєфних виробів.
3. Вчимося розв’язувати задачі. (розглянути приклади)_____
Задача 1. Щоб покрити цинком металеві вироби, в електролітичну ванну вставили електрод, маса якого становить 0,01 кг. Який заряд має пройти крізь
ванну, щоб використався весь електрод? Для цинку ![]()

2було Задача 2. Під час електролізу сталеву деталь площею поверхні 800 см вкрито шаром нікелю товщиною 54 мкм. За якої сили струму проходив процес, якщо електроліз триває 4 год?
 m речовини можна знайти
m речовини можна знайти
Виникнуть питання по здачам пишемо на вайбер
Задача 3.4. Розглянути приклади у підручнику: -- ст. 202 та ст.206
4. Запитання на закріплення вивченого. ( усно)_______________
1. Що таке анод? катод?
2. Які речовини називають електролітами?
3. Дайте визначення електролітичної дисоціації.
4. Що є вільними носіями зарядів у розчинах електролітів (солей, кислот і лугів)?
5. Що таке електроліз?
6. Як змінюється кількість вільних носіїв зарядів в електролітах при зростанні температури?
7. Сформулюйте закон електролізу.
8. Поясніть механізм виникнення струму в електролітах
5. Вчимося розв’язувати (виконати у зошиті)._____________
Вивчити параграфи 37, 38; виконати вправу 37 (4, 5), 38 (3)
Задачі 37 (4, 5) – подібні до поданих задач 1,2 та на ст..202 також Вам потрібно буде скористатися таблицею №8 ст.231
Задача 38 (3) --- подібна до поданої задачі на ст..206 також вам потрібно буде скористатися таблицею №8 ст.231


про публікацію авторської розробки
Додати розробку
