Урок "Історія уявлення про будову атома"
Дану розробку уроку можна використовувати на уроках фізики у 11 а 9 класах при вивчені теми "Атомна і ядерна фізика". Розробка містить коспект з додатками для друку та презентацію.
- Сучасна модель атома.ppt ppt
- додаток 1.doc doc
- додаток 2.doc doc
- конспект уроку 11 клас.doc doc



































Конспект уроку 11 клас
Тема : Історія вивчення атома
Мета :
узагальнити знання учнів про будову атома, отриманих на уроках хімії та фізики середніх класів, познайомити учнів з основними етапами розвитку уявлення про будову атома, ввести поняття ядерних сил та сприяти розумінню їх властивостей;
продовжити формувати науковий світогляд через пояснення фізичних явищ у мікросвіті;
розвивати комунікативні вміння, поглиблювати навички роботи в локальних групах, вміння приймати рішення та бути відповідальним.
Обладнання : ПК, роздатковий матеріал.
План уроку
- Організаційний момент
- Актуалізація опорних знань
-
Вивчення нового матеріалу
- історія розвитку уявлень про будову атома
- будова атомного ядра
- ізотопи
- ядерні сили
- Первинне закріплення/інтерактивна вправа «Логічна пара»
- Розв’язування вправ
- Підсумок уроку
- Домашнє завдання.
«… відтепер мені відомо який вигляд має атом»
Е. Резерфорд
Хід уроку
- Організаційний момент
- Актуалізація опорних знань
Що ви знаєте про будову речовини?
Як розвивалось уявлення людства про будова атома?
- Вивчення нового матеріалу
3.1 Історія розвитку уявлень про будову атома
Ще 2,5 тисячі років тому Демокритом було висунуто твердження, що атом- це складова всіх речовин. Саме вони назвали атомом дрібну, неподільну частку, що утворює речовину. Речовина , стверджували вчені, утворюється в результаті зіткнення атомів та виникнення зв’язку між ними.
Платон – стверджував, що атоми мають форму правильних многогранників: куба(атом землі), тетраедра(атом вогню), октаедр(атом повітря), ікосаедр (атом води).
Учень Платона Аристотель вважав, що процес поділу речовини на складові часточки нескінченний. І його думка панувала протягом довгого терміну часу, близько 2000 років.
Існування атомів не визнавали і, навіть, під загрозою страти Парижський парламент заборонив атомістичну теорію.
З винайденням технічних приладів і подальшим розвитком науки теорію Аристотеля прийшлось переглянути.
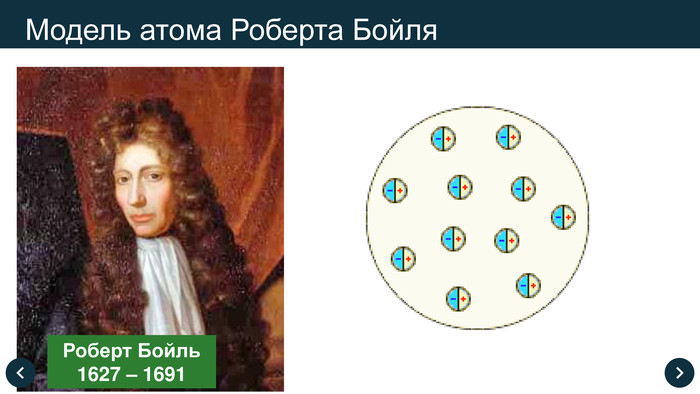
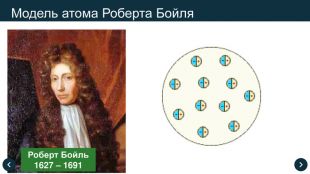
1661 рік Роберт Бойль сформував поняття хімічного елемента
1803 рік Джон Дальтон відкрив три закони що дозволили стверджувати, що атом – неподільна складова атома
1904рік після ряду великих відкриттів, таких як створення таблиці Д.І. Менделєєва , х- променів Рентгена Пулюя, радіоактивності Беккереля та відкриття електрона, Джосеф Томсон запропонував модель де атом представляли у вигляді позитивно зарядженої кулі, в яку вкраплено електрони. Модель отримала назву «,Пудинг з родзинками».
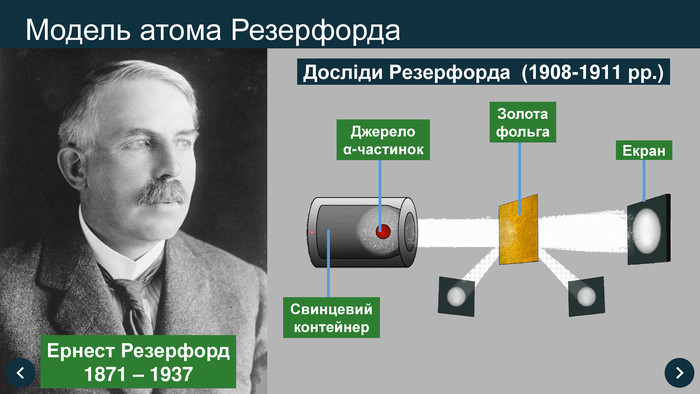
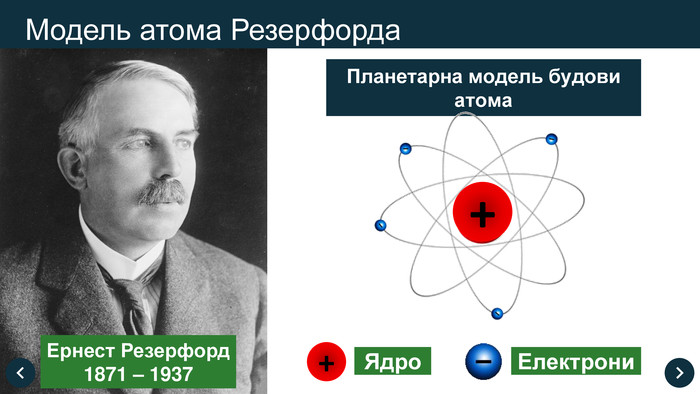
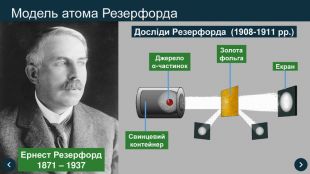
1911 рік Ернест Резерфорд експериментально довів, що атом має відмінний, від запропонованої Томсоном моделі, вид. Він стверджував, що у середині атома розташоване позитивно заряджене ядро, в якому сконцентрована практично вся маса атома, а навколо ядра, як планети навколо Сонця, обертаються електрони. (Планетарна модель атома)
Але така будова атома все ж таки не зовсім вписувалась в закони класичної фізики, згідно якої електрони з часом мали би припинити обертання і впасти на ядро.
1913рік датський вчений Нільс Бор доповнив планетарну модель Резерфорда. Ці доповнення відомі як постулати Бора. Одне з них говорить про те, що електрони обертаються навколо ядра по певних стаціонарних орбітах. При переході з однієї орбіти на іншу атом випромінює ч поглинає певну порцію(квант) енергії.(Квантова модель атома).В 1926 роцы Е.Шредінгер запропонував гіпоезу, що електрони не обертаються по сталим орбітам, а знаходяться в так званій хмарі. Його модель демонструє ядро, оточене хмарами електронної щільності. Таким чином, 1926 рік вважається роком формування сучасної протонно-нейтронної моделі атома, долучився до цього процесу і наш співвітчизник Дмитро Дмитрович Іваненко, уродженець Полтави, професор, який не зважаючи на репресії і імідж «соціально-небезпечного елемента» зробив вагомий внесок у розвиток світової науки.
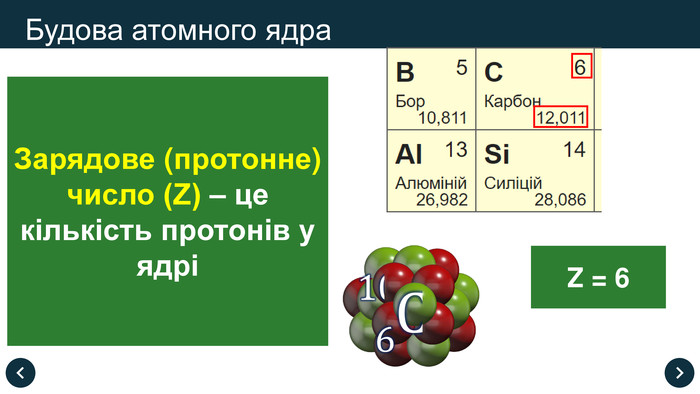
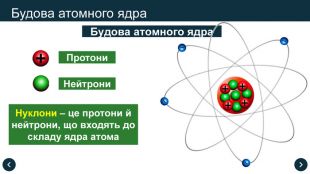
- Будова атома
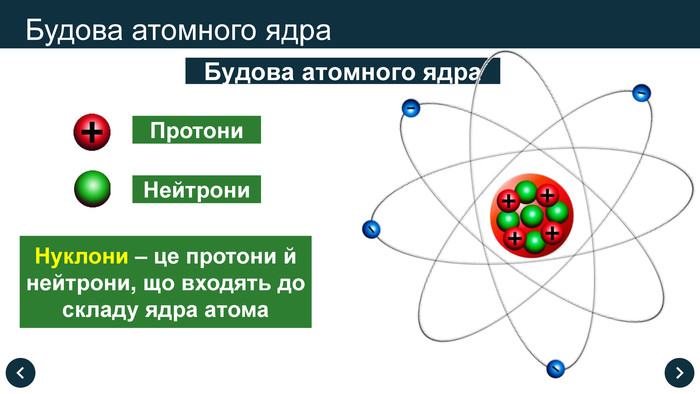
Атом ядро протони + нейтрони
Оболонка –електрони
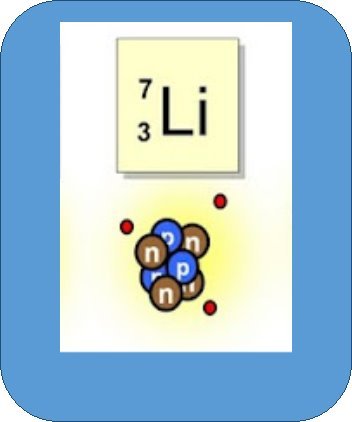
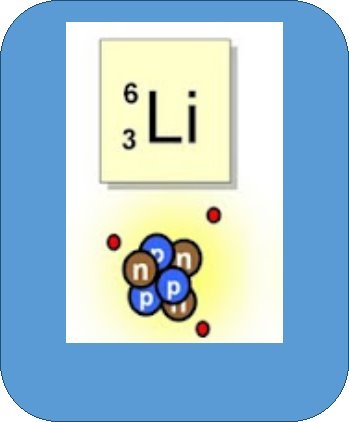
Нуклони – це протони й нейтрони, що входять до складу ядра атома
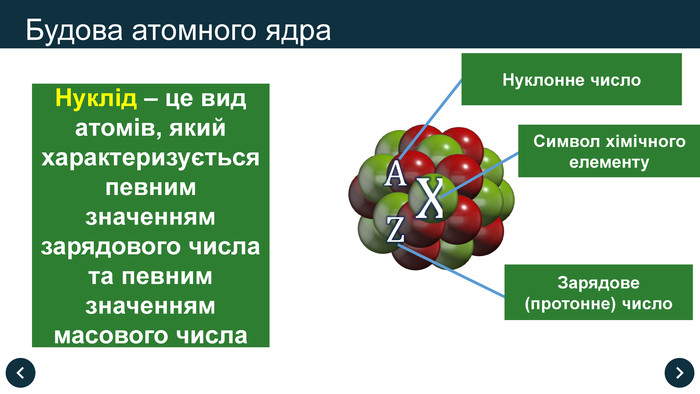
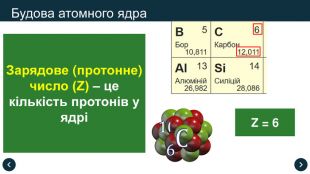
Нуклонне (масове) число (А) – це сумарна кількість протонів і нейтронів в атомі
Зарядове (протонне) число (Z) – це кількість протонів у ядрі
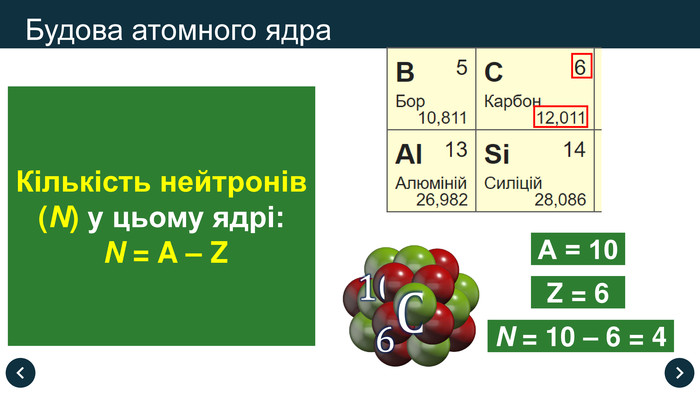
Кількість нейтронів (N) у цьому ядрі:
N = A – Z
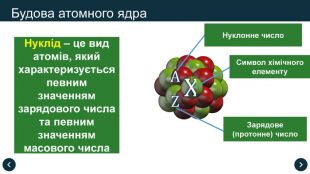
Нуклід – це вид атомів, який характеризується певним значенням зарядового числа та певним значенням масового числа
3.3 Ізотопи
Ізотопи – це різновиди атомів того самого хімічного елемента, ядра яких містять однакове число протонів, але різну кількість нейтронів
Гідроген має три ізотопи Н, Н, Н - протій, дейтерій, тритій.
У атомів хлору є два ізотопи С1-35 та С1-37 що зустрічаються у природі відповідному співвідношенні : 75% та 25% тому значення маси атома обчислюється наступним чином:
35*0,75+37*0,25=35,5 аом
В урана 12 ізотопів від 228 до 239.
Ізотопи бувають стабільними(в переважній більшості елементів поряковий номер меньший 89) і радіоактинийт(порядковий номер більший за 89)
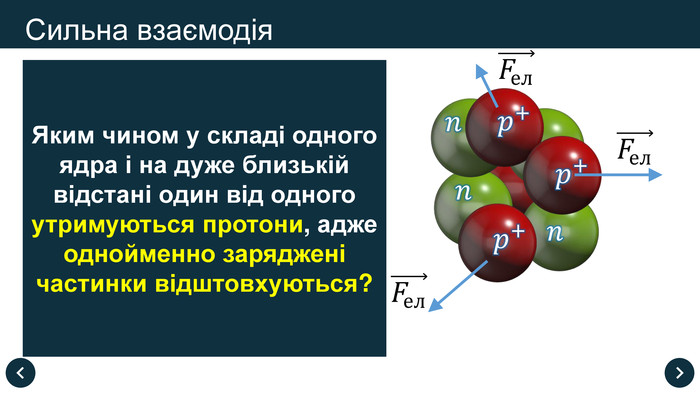
3.4 Яким чином у складі одного ядра і на дуже близькій відстані один від одного утримуються протони, адже однойменно заряджені частинки відштовхуються?
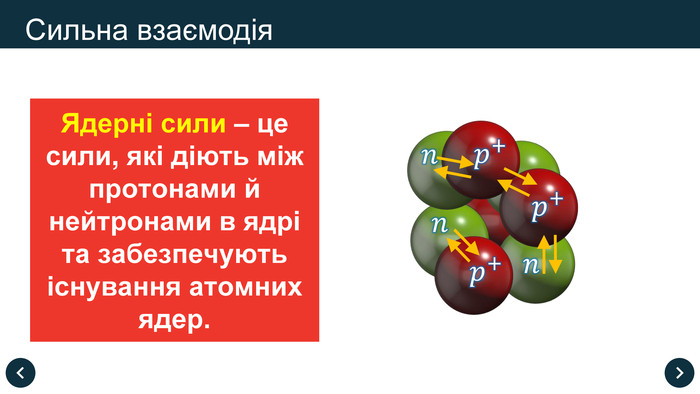
Ядерні сили – це сили, які діють між протонами й нейтронами в ядрі та забезпечують існування атомних ядер.
Властивості ядерних сил:
- діють тільки сили притягання
- не залежать від заряду
- є близькодіючими
- Первинне закріплення
Доберіть логічні пари та поясніть свій вибір(додаок 1)
- Розвязування вправ
Оберіть картку із запропонованих. Дайте відповідь на запитання.
Спробуйте знайти щасливу! (додаток 2)
- Підсумок уроку
- Домашнє завдання
-
Чудова розробка. Дякую!!!
-


про публікацію авторської розробки
Додати розробку