Урок "Електролітична дисоціація. Електроліти й неелектроліти"
Конспект уроку для здобувачів освіти 9 класу.
Мета.
Формування предметних компетентностей:
- сформувати поняття електроліт, неелектроліт, електролітична дисоціація;
- розкрити залежність електропровідності розчинів від виду хімічного зв'язку;
- дати уявлення про механізм електролітичної дисоціації, показати сутність дисоціації та роль води в цьому процесі;
- розвивати вміння встановлювати причинно-наслідкові зв'язки.
Формування ключових компетентностей:
- комунікативна;
- здоров`язбережувальна;
- уміння вчитись впродовж життя;
- спілкування державною мовою.
Тема. Електролітична дисоціація. Електроліти й неелектроліти
Мета:
Формування предметних компетентностей:
- сформувати поняття електроліт, неелектроліт, електролітична дисоціація;
- розкрити залежність електропровідності розчинів від виду хімічного зв’язку;
- дати уявлення про механізм електролітичної дисоціації, показати сутність дисоціації і роль води в цьому процесі;
- розвивати вміння встановлювати причинно-наслідкові зв’язки.
Формування ключових компетентностей:
- комунікативна;
- здоров`язбережувальна;
- уміння вчитись впродовж життя;
- спілкування державною мовою.
Тип уроку. Вивчення нового матеріалу.
Обладнання: підручник, ППЗ «Хімія, 9 клас», таблиця розчинності кислот, солей і основ у воді, прилад для дослідження електропровідності розчинів, хімічні склянки, вода, кристалічні натрій хлорид, натрій гідроксид, цукроза.
Перебіг уроку
І. Організаційний момент.
Перевірка присутніх та готовності учнів до уроку
ІІ. Мотивація навчальної діяльності.
Вчитель. Доброго дня! Я рада вітати вас на нашому уроці! Як ви можете побачити, на демонстраційному столі лежить фен для волосся. В інструкції до цього приладу у розділі «Правила безпеки» написано: «Берегти від води». Спробуйте пояснити: «Чому?».
Учні. (Тому що водопровідна вода проводить електричний струм.)
Вчитель. Про те, які речовини проводять електричний струм, як вони називаються і яким чином відбувається цей процес, ми дізнаємось сьогодні на уроці.
IІІ. Повідомлення теми, мети, завдань уроку.
Вчитель. Тема нашого уроку «Електролітична дисоціація. Електроліти й неелектроліти».
Працювати ми з вами будемо за планом:
- Електроліти та неелектроліти.
- Електролітична дисоціація.
- Причини електролітичної дисоціації.
- Механізм дисоціації речовин.
ІV. Актуалізація опорних знань.
Метод «Мікрофон»
Але перед тим, як приступити до вивчення нової теми, згадаємо:
- Що таке речовина?
- На які дві групи за складом поділяються речовини?
- Які види хімічного зв’язку вам відомі?
- Наведіть приклади речовин з різними типами хімічного зв’язку.
- Який тип хімічного зв’язку характерний для молекули води?
- Що таке електричний струм?
V. Сприйняття учнями нового матеріалу.
Вчитель. На початку 19 століття в Лондоні в лабораторії Королівського інституту двоє учених: Гемфрі Деві та Майкл Фарадей проводили досліди з визначення електропровідності розчинів, використовуючи спеціальний прилад.
Сьогодні ми маємо можливість провести подібні дослідження в нашій лабораторії. Доведемо, що водопровідна вода проводить електричний струм. Для цього скористаємося приладом для дослідження електропровідності. Якщо речовина проводить електричний струм, то лампочка загоряється, якщо не проводить – то ні.
Спостерігаємо, що лампочка загорілася, значить водопровідна вода дійсно проводить електричний струм.
А тепер проведемо дослід з дистильованою водою.
Спостерігаємо, що лампочка не загоряється.
- Який висновок можна зробити
Учні. Дистильована вода не проводить електричний струм.
Вчитель. Чому водопровідна вода проводить електричний струм, а дистильована – ні?
Дослідимо електропровідність деяких речовин та їх розчинів та результати дослідження запишемо у таблицю.
ППЗ «Хімія, 9 клас» Скріншот 1
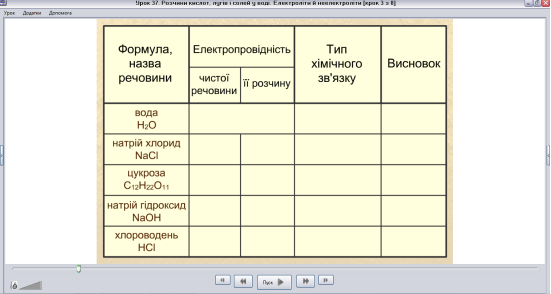
Скріншот 1
Перевіряємо електропровідність запропонованих речовин.
Для перевірки електропровідності хлороводню скористаємося медіа фрагментом ППЗ «Хімія, 9 клас» Скріншот 2
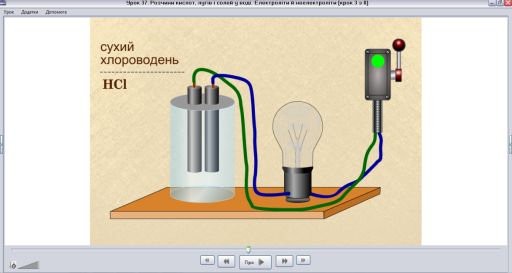
Скріншот 2
Вчитель. Подивіться на результати які ми отримали в колонці електропровідність і зробіть висновок.
Учні. Одні речовини проводять електричний струм, інші – ні. Речовини в твердому агрегатному стані електричний струм не проводять.
Вчитель. Речовини, розчини або розплави яких проводять електричний струм, називаються електролітами, а речовини, розчини або розплави яких не проводять електричний струм, називаються неелектролітами.
Уперше поділив речовини на електроліти та неелектроліти Майкл Фарадей.
Учні. Повідомлення про Майкла Фарадея.
Вчитель. А тепер зверніть увагу на колонку «Тип хімічного зв’язку» (скріншот 3) і зробіть висновок: речовини з яким типом хімічного зв’язку є електролітами та до якого класу сполук вони відносяться, а який тип хімічного зв’язку характерний для неелектролітів та до якого класу сполук вони відносяться?
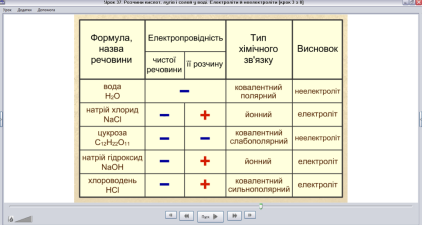
Скріншот 3
Учні. Висловлюють свої думки. Вчитель. Електроліти – речовини з йонним та ковалентним сильно полярним типом хімічного зв’язку ( водні розчини або розплави солей, лугів, кислот).
Неелектроліти - речовини з ковалентним неполярним або слабополярним типом хімічного зв’язку (більшість органічних сполук, прості речовини - неметали).
Вчитель.
- А зараз ми з’ясуємо чому розчини та розплави солей, кислот, лугів проводять електричний струм?
- Що ж трапляється з кристалом солі коли він потрапляє у воду?
Медіафрагмент ППЗ «Хімія, 9 клас» Скріншот 4
Механізм дисоціації сполук з йонним зв’язком
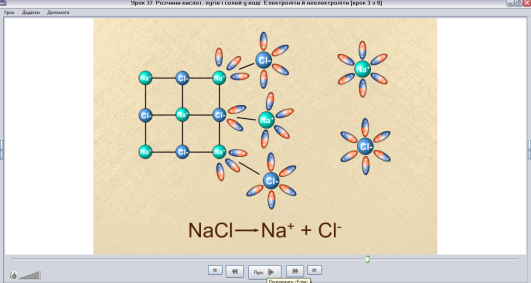
Скриншот 4.
Вчитель. Підсумуймо, послідовність процесу дисоціації речовин йонної будови.
- Орієнтація диполей води біля йонів кристалу.
- Гідратація - взаємодія молекул води з йонами
- Дисоціація (розпад) кристала на гідратовані йони.
Рівняння: NaCl ↔ Na+ + Cl-
Вчитель. Для хлороводню характерний ковалентний полярний тип хімічного зв’язку.
- Як ви вважаєте яким чином буде відбуватися дисоціація в розчині хлороводню?
Учні. Висловлюють свої припущення.
Вчитель. Розглянемо з вами цей процес.
Механізм дисоціації сполук з ковалентним полярним зв’язком
Медіафрагмент ППЗ «Хімія, 9 клас» (скриншот 5)
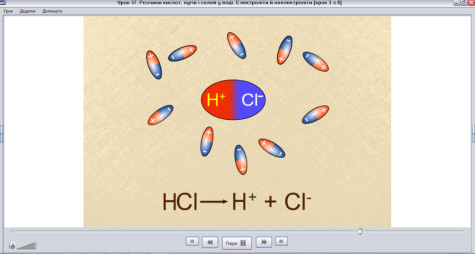
Скріншот 5.
Вчитель. Таким чином, послідовність процесів дисоціації хлороводню:
- Орієнтація диполей води навколо полюсів молекули НСl
- Гідратація - взаємодія молекул води з НСl
- Йонізація молекули електроліта (перетворення ковалентного зв’язку на йонний)
- Дисоціація (розпад) молекули електроліту на гідратовані йони.
Рівняння: НCl ↔ Н+ + Cl-
Отже, електрична провідність розчинів і розплавів електролітів зумовлена наявністю в них катіонів і аніонів. Катіони – позитивно заряджені йони. Аніони – негативно заряджені йони.
Електролітична дисоціація – процес розпаду електроліту на йони під впливом полярних молекул води або при розплавленні.
Першим пояснив процеси, що відбуваються під час електролітичної дисоціації, шведський вчений Сванте Арреніус у 1887 році. Вони ввійшли в науку як теорія електролітичної дисоціації, за що вченого у 1903 році було відзначено Нобелівською премією.
Сучасний зміст теорії сформульовано під впливом вчення про будову атома та хімічний зв’язок.
Основні положення ТЕД
- Електролітична дисоціація відбувається під впливом полярних молекул розчинника.
- Процес дисоціації є оборотним.
- При розчиненні у воді молекули електролітів дисоціюють на позитивно і негативно заряджені йони: катіони і аніони.
- Йони у водному розчині перебувають у хаотичному безперервному русі. Якщо у розчин електроліту занурити електроди і прикласти до них електричну напругу, то іони набудуть направленого руху: позитивно заряджені іони переміщуватимуться у напрямі до катода (негативно зарядженого електрода), а негативно заряджені іони у напрямку анода (позитивно зарядженого електрода).
VІ. Первинне усвідомлення учнями нового матеріалу.
Метод «Кластер»
Допишіть пропущені слова в клітини. (Скріншот 6)
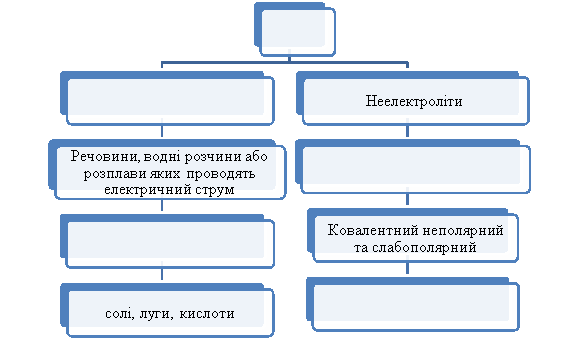
Скріншот 6.
2. Прийом «Вірю - невірю».
Робота з сигнальними картками (зелений колір – вірю, жовтий – не вірю)
- Електролітична дисоціація – це процес розпаду сполук на окремі атоми.
- Катіони – позитивно заряджені йони.
- Луги – електроліти.
- Розплав кухонної солі проводить електричний струм.
- Аніони заряджені позитивно.
6.Ацетон – електроліт.
7. Кристалічний цукор проводить електричний струм.
8. Водний розчин магній хлориду не проводить електричний струм.
3. Захист проєкту «Електроліти в сучасних акумуляторах»
VІІ. Підсумок уроку.
Рефлексія.
Учням кидається кубик на гранях якого написано початок речення. Їм потрібно продовжити те речення, яке випало. Після цього вони перекидають кубик будь-кому з своїх однокласників і так по ланцюжку.
Сьогодні на уроці:
Мені сподобалось…
Я дізнався (лась)…
Я запам’ятав(ла) …
Я навчився (лася)…
Я зміг (змогла) …
Настрій в мене ….
VІІІ. Домашнє завдання.
Опрацювати параграф 6,
завд. 45 виконати письмово.
Творче завдання. Скласти сенкани до понять «електроліти», «дисоціація».

про публікацію авторської розробки
Додати розробку
