Урок:"Електролітична дисоціація кислот, основ, солей у водних розчинах"
Тема уроку: Електролітична дисоціація кислот, основ, солей у водних розчинах.
Мета уроку: сформувати поняття про кислоти, основи, й солі виходячи з теорії електролітичної дисоціації; забезпечити формування навичок складання рівнянь дисоціації на прикладі розчинних кислот, основ, солей; розвивати логічне мислення; виховувати охайність, бережливість при проведені експерименту.
Тип уроку: засвоєння нових знань.
Обладнання та матеріали: таблиця розчинності, набір хімічних реактивів для лабораторних дослідів, малюнки молекул кислот, основ солей, картки «Йони», інструкція виконання лабораторного досліду, «Інструкція з правил техніки безпеки», мультимедійна презентація «Електролітична дисоціація кислот, основ, солей у водних розчинах», видеофрагмент лабораторного досліду «Дослідження речовин на електропровідність», картки для дидактичної гри, фішки для оцінювання.
ХІД УРОКУ
І. Організаційний момент
ІІ. Мотивація навчання учнів
Учитель: Доброго дня шановні учні та присутні гості нашого уроку. Сьогодні ми будемо з вами мандрувати країною Розчинів і зупинимось у містечку Електролітичне. Мешканці цієї країни дуже різні, навіть з протилежними характеристиками, але всі вони підпорядковані основним положенням теорії своєї країни (Теорія електролітичної дисоціації).
Зараз ми згадаємо матеріали минулих уроків. Розгадуючи кросворд ми віднайдемо ключове слово до теми нашого уроку.(Слайд)
Отже діти вирушаємо в нашу мандрівку. І так перше запитання:
- Що означає слово «дисоціація» в перекладі українською мовою?
- Однорідна система змінного складу, що містить два або кілька компонентів.
- Ім’я автора теорії електролітичної дисоціації.
- Продукт, що утворюється за високого нагрівання кристалічних тіл.
- Речовина, розчин або розплав якої проводять електричний струм.
- Прізвище автора електролітичної дисоціації.
- Речовина, розчин або розплав якої не проводять електричний струм.
- Розділ хімії, що вивчає електролітичні процеси.
Відповіді: 1. Розпад; 2. Розчин; 3. Сванте; 4. Розплав; 5. Електроліт;
6. Арреніус; 7. Неелектроліт; 8. Електрохімія.
Отже, діти подивіться ми з вами правильно відповіли на всі запитання і в нас з вами вийшло ключове слово теми нашого уроку «Дисоціація». А що ж це таке?
А тому і тема сьогоднішнього нашого уроку: «Електролітична дисоціація кислот, основ, солей у водних розчинах» (Слайд)
(Слайд) Мандруючи нашим містечком ми сформуємо поняття про основи, солі й кислоти, виходячи з теорії електролітичної дисоціації; будемо вчитися складати рівняння дисоціації на прикладі розчинних кислот, основ, солей;
Зверніть будь-ласка увагу у кожного з вас є путівник уроку. Запишіть будь-ласка дату сьогоднішнього уроку, своє прізвище та ім’я. Оцінювання роботи на уроці буде у вигляді фішок, кожна фішка буде дорівнювати 1 балу.
ІІІ. Вивчення нового матеріалу
І так, ми продовжуємо мандрівку і давайте завітаємо до нашої лабораторії. Де ми з вами проведемо дослідження складу кислот і лугів. Що дасть нам змогу сформувати поняття про основи, солі й кислоти, виходячи з теорії електролітичної дисоціації.
Інструктаж з техніки безпеки. (Слайд Техніка безпеки)
Діти Увага!!! Перед початком виконання досліду давайте повторимо правила техніки безпеки під час роботи з лугами і кислотами. Зверніть увагу у вас на столах лежать Правила техніки безпеки, передивіться їх. Працювати необхідно обережно, щоб розчини кислоти або лугу не потрапив на одежу, шкіру аби не отримати опіки. При попаданні кислоти або лугу на шкіру необхідно змити її великою кількістю води і обробити уражений участок нейтралізуючою речовиною
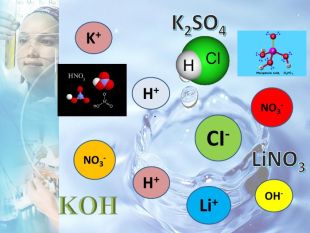
Погляньте перед вами є розчини кислот і лугу вам необхідно за допомогою індикаторів визначити які йони присутні в розчинах кислот і лугів. Група «Кислоти» за допомогою індикаторів фенолфталеїну, метилоранжу і універсального паперу будуть визначати присутність Гідроксид-йону Н+, а група «Основи» буде визначати Гідроксигрупу ОН-.
Групи кислоти. Дослід №1.
Перед вами три пробірки налийте в них приблизно по 2 мл розчину Н2SO4.
Додаємо до кожної пробірки з кислотою по 2-3 краплини індикаторів фенолфталеїн, метилоранж і опускаємо універсальний індикаторний папір у пробірку з розчином кислоти. Дивимось на зміну забарвлення.
Групи основи. Дослід №2.
Перед вами три пробірки налийте в них приблизно по 2 мл розчину NaOH.
Додаємо до кожної пробірки з лугом по 2-3 краплини індикаторів фенолфталеїн, метилоранж і опускаємо універсальний індикаторний папір у пробірку з розчином лугу. Дивимось на зміну забарвлення.
Універсальний індикатор визначає наявність йонів Н+ і ОН- у розчинах.
Фенолфталеїн - тільки йони ОН-.
Лакмус стає червоним за наявності йонів Н+ і синім - за наявності йонів ОН-
Метилоранж стає малиновим за наявності Н+ і жовтим – за наявності ОН-
Висновок: у розчинах кислот міститься Н+, у розчинах лугів - ОН-. Доведемо це, записавши рівняння дисоціації.
З курсу хімії 8 класу ви діти знаєте, що кислоти – це складні речовини, до складу молекул яких входить атом Гідрогену і кислотний залишок.
Картка з формулами Називаємо кислоти
Давай тепер з вами поглянемо яке визначення поняття кислоти з точки зору електролітичної дисоціації подане в підручнику.
Кислоти – це електроліти, у результаті дисоціації яких у розчинах утворюється лише один вид катіонів – йони Гідрогену Н+.
А основи – це складні речовини, до складу молекул яких входить атом металу та гідроксильна група ОН-.
Картка з формулами Називаємо основи
Враховуючи ТЕД, ми скажемо що основи – це електроліти, у результаті дисоціації яких у розчині утворюється один вид аніонів – йони ОН-.
Знову повертаючись до 8 класу, згадаємо, що солі – це складні речовини, до складу молекул яких входить атом металу та кислотний залишок
Картка з формулами Називаємо основи
Тепер давайте дамо визначення що ж таке солі з точки зору ТЕД.
Солі — це електроліти, у результаті дисоціації яких у розчині утворюються катіони металів і аніони кислотних залишків.
IV. Закріплення знань, умінь і навичок.
Далі ми продовжуємо вивчати тему і я пропоную переглянути відеозавдання
Завдання 1. (Слайд)
А тепер скажіть чому тверді речовини цукор, NaOH, NaCl не проводять електричний струм, а розчини відповідних речовин проводять.
Завдання 2. Задача
- Алюміній нітрат, кількістю речовини якого становить 2 моль, розчинили у воді. Вкажіть сумарну кількість речовини позитивно, негативно заряджених йонів в утвореному розчині:
а)6 моль; б)8 моль; в) 5 моль; г) 4 моль; д) 7 моль.
- Калій ортофосфат, кількістю речовини якого становить 3 моль, розчинили у воді. Вкажіть, яка кількість речовини позитивно заряджених йонів утворяться у разі повної дисоціації електроліту:
а)6 моль; б)8 моль; в) 9 моль; г) 7 моль; д) 5 моль.
Для домашніх роздумів над завданнями Д/з
- Опрацювати матеріали 10 параграфа
- Відповісти на запитання до нього
- Виконати завдання №2,3,4,8.
Завдання 3.
Проаналізуйте склад мінеральної води. Випишіть в свій путівничок катіони та аніони що містяться в розчині води. (Миргородська, Моршинська, Боржомі).
А вдома я вам пропоную провести дослідження, порівняти кількісний склад вмісту катіонів та аніонів у мінеральних водах. І за допомогою інтернету дізнатись корисність тієї чи іншої мінеральної води для організму людини.
Завдання 4. Інтерактивна гра «Віднайди йон»
А тепер ми з вами пограємо. У вас на столах є частики – йони. Я показую формулу молекули, а ви шукаєте в кошику відповідні йони, на які дисоціює ця сполука в розчині.
Вкажіть електроліти, під час дисоціації яких утворилися йони Zn2+,K+, Cl- CO 3 2-
а) NaCl, ZnCl2 , ZnCO3 б) ZnCO3, KCl, KHCO3 в) K2CO3 , ZnCO3 , NaCl г) KCl, K2CO3 , ZnCl2, д) KNO3 , ZnCO3 , KCl.
V. Підбиття підсумків уроку.
І так вже час завершувати нашу подорож містечком Електролітичне. Ми розглянули тему нашого уроку і ми вивчили поняття кислот, основ, солей з точки зору ТЕД. Давайте ще раз згадаємо що ж таке кислоти – це……., основи – це…….солі – це……Ми з вами навчились записувати рівняння дисоціації розчинних кислот, основ, солей.
І давайте з вами підрахуємо кількість набраних фішок. Відповідно 1 фішка – 1 бал. І порахуйте сумарну кількість балів усієї групи. Скажіть в кожній групі хто набрав найбільшу кількість балів. І виставте собі оцінку у путівнику. А на наступному уроці до набраних сьогодні балів ви додасте оцінку яку отримаєте за пошук повідомлення про корисність мінеральної води для організму людини, відповіді на теоретичні питання, розв’язок задачі.
Скажіть що нового ви для себе дізнались____________
Що найбільше сподобалось_____________
Запам’яталось________________
Заключне слово: Час вже завершувати , і я б хотіла подякувати вам за активну участь, творчу співпрацю. Мені сподобалось з вами працювати, ви всі молодці, вмієте змістовно висловлювати свої думки, аргументувати свою відповідь, маєте глибокі знання з предмету. І цим ви я разом з вами завдячуємо вашому учителю хімії Ользі Олексіївні. Дякую. Нехай вам щастить!

 Клас ________ П.І.П. учня ________________________________
Клас ________ П.І.П. учня ________________________________
Дата _____________________
Тема. Електролітична дисоціація кислот, основ, солей у водних розчинах
«Кросворд»
- Що означає слово «дисоціація» в перекладі українською мовою?
- Однорідна система змінного складу, що містить два або кілька компонентів.
- Ім’я автора теорії електролітичної дисоціації.
- Продукт, що утворюється за високого нагрівання кристалічних тіл.
- Речовина, розчин або розплав якої проводять електричний струм.
- Прізвище автора електролітичної дисоціації.
- Речовина, розчин або розплав якої не проводять електричний струм.
![]()
У розчинах кислот міститься Н+, у розчинах лугів – ОН -
Словничок
 Кислоти – це електроліти, у результаті дисоціації яких у розчинах утворюється лише один вид катіонів – йони Гідрогену Н+.
Кислоти – це електроліти, у результаті дисоціації яких у розчинах утворюється лише один вид катіонів – йони Гідрогену Н+.
HCl = H+ + Cl-
 Основи – це електроліти, у результаті дисоціації яких у розчині утворюється один вид аніонів – йони ОН-.
Основи – це електроліти, у результаті дисоціації яких у розчині утворюється один вид аніонів – йони ОН-.
KOH = K+ + Cl-
Солі — це електроліти, у результаті дисоціації яких у розчині утворюються катіони металів і аніони кислотних залишків.
 Nа2S04 ->2Nа++S042-
Nа2S04 ->2Nа++S042-
![]()
![]()
![]()
![]() А12(S04)з →2А13++3S042
А12(S04)з →2А13++3S042
Задача
Алюміній нітрат, кількістю речовини якого становить 2 моль, розчинили у воді. Вкажіть сумарну кількість речовини позитивно, негативно заряджених йонів в утвореному розчині:
а)6 моль; б)8 моль; в) 5 моль; г) 4 моль; д) 7 моль.

|
Дано
|
Розв’язання
|
|
|

Відповідь ___________________
Завдання
Вкажіть електроліти, під час дисоціації яких утворилися йони Zn2+,K+, Cl- CO 3 2-
а) NaCl, ZnCl2 , ZnCO3 б) ZnCO3, KCl, KHCO3 в) K2CO3 , ZnCO3 , NaCl г) KCl, K2CO3 , ZnCl2, д) KNO3 , ZnCO3 , KCl.
 «Продовжіть речення»
«Продовжіть речення»
Сьогодні на уроці я:
- дізнався…
 - зробив висновки…
- зробив висновки…
- цікавим було..
Домашнє завдання.
-
 Опрацювати матеріал параграфа,
Опрацювати матеріал параграфа,
- відповісти на запитання до нього,
- виконати вправи.
- Написати рівняння дисоціації в розчинах таких речовин:
- К2S04, Н2SO4, ВаС12, НВг, А1С13.
Кількість фішок _______кількість додаткових балів_____ Оцінка _______


про публікацію авторської розробки
Додати розробку