Урок:"Хімічні властивості кислот"
Дата проведення_______________
Опорний конспект учня до уроку
Класна робота
учня 8 -___ класу
_________________________________
«Зібратись разом – це початок,
Триматись разом – це прогрес,
Працювати разом – це успіх.»
Генрі Форд
Тема уроку: «Хімічні властивості кислот.»
![]() ХІД УРОКУ
ХІД УРОКУ
Теоретична лабораторія
«Хімічний ринг» (0,5 балів – 4б)
Сполука, молекула якої містить один чи декілька атомів Гідрогену, здатних під час хімічних реакцій заміщуватися на атоми металічного елемента________________________________________________
За вмістом Оксигену кислоти поділяють на _____________________________________________
Частину молекули кислоти, сполучену з атомом Гідрогену, називають______________________
Кількість атомів Гідрогену в молекулі кислоти визначає___________________________________
Елемент, що утворює кислоту, називають______________________________________________
Кількість атомів Гідрогену в молекулі кислоти називають_________________________________
За хімічною активністю кислоти поділяють на___________________________________________
![]() Для кожної оксигеновмісної кислоти існує відповідний оксид, його називають_________________
Для кожної оксигеновмісної кислоти існує відповідний оксид, його називають_________________
Практична лабораторія
Гра “Пасьянс”(1б)
________________________________________________________________________________
Гра “Третій зайвий” (1б)
Визначте у переліку зайву речовину і вкажіть ознаку, за якою вона відрізняється від інших.
HBr, HCl, H2SO3
________________________________________________________
Гра “Хрестики - нулики” (1б)
Виграшний шлях_______________________________
|
H2SiO3 |
HNO3 |
H3PO4 |
|
HCl |
H2CO3 |
HBr |
|
H2SO4 |
H3PO4 |
HI |
Технологія „Снігова куля” (1б)
|
Формула кислоти |
Назва кислоти |
Назва відповідної солі |
|
H3PO4 |
|
|
|
|
хлоридна |
|
|
|
|
карбонат |
|
H2SiO3 |
|
|
|
|
ортофосфатна |
|
|
|
|
нітрат |
|
HBr |
|
|
|
|
йодидна |
|
![]()
Експериментальна лабораторія.
Лабораторний дослід №1 “Дія кислот на індикатори”
_____________________________________________________________________________________________________________________________________________________________________________
Лабораторний дослід №2 “Взаємодія кислот з металами”(1,5)б
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________Реакція заміщення – це _________________________________________________________________
Дослід №3. “Взаємодія основних оксидів з кислотами”(0,5б)
______________________________________________________________________________________________________________________________________________________________________________
Реакція обміну - це_____________________________________________________________________
Дослід №4. “Взаємодія основ з кислотами” (0.5б)
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
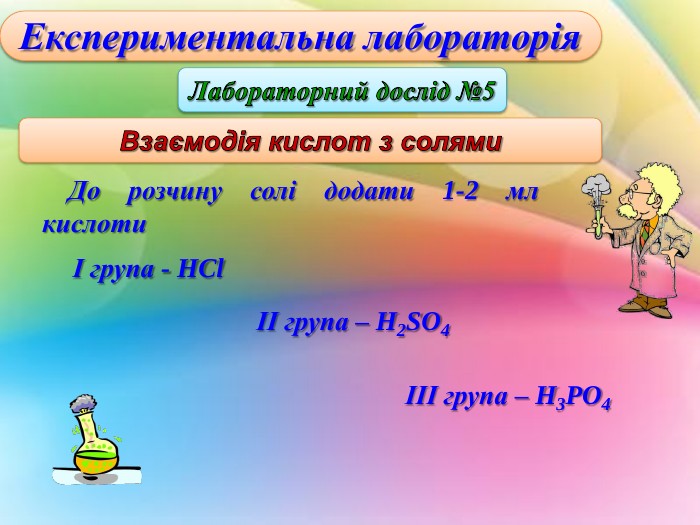
Дослід №5. “Взаємодія солей з кислотами”(0,5б)
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
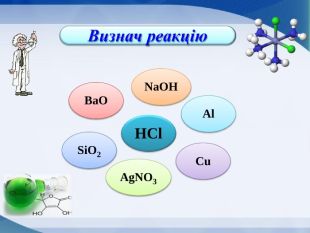
Визнач реакцію. З’єднайте стрілочками із центральною речовиною тільки ті речовини, що можуть із нею взаємодіяти та запишіть рівняння реакцій (1б.)
Сьогодні я на уроці дізнався, що______________________________________________________
Я навчився(лась)___________________________________________________________________
Я навчився здійснювати, складати, писати_____________________________________________
Мені найбільше сподобалось________________________________________________________
Кількість балів________
Для нотаток __________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Дата проведення_______________
Опорний конспект учня до уроку
Класна робота
учня 8-___ класу
_________________________________
«Зібратись разом – це початок,
Триматись разом – це прогрес,
Працювати разом – це успіх.
Генрі Форд
Тема уроку: «Хімічні властивості кислот.»
![]() ХІД УРОКУ
ХІД УРОКУ
Теоретична лабораторія
«Хімічний ринг» (0,5 балів – 4б)
Сполука, молекула якої містить один чи декілька атомів Гідрогену, здатних під час хімічних реакцій заміщуватися на атоми металічного елемента_________________________________________________
За вмістом Оксигену кислоти поділяють на _____________________________________________
Частину молекули кислоти, сполучену з атомом Гідрогену, називають_______________________
Кількість атомів Гідрогену в молекулі кислоти визначає___________________________________
Елемент, що утворює кислоту, називають_______________________________________________
Кількість атомів Гідрогену в молекулі кислоти називають_________________________________
За хімічною активністю кислоти поділяють на___________________________________________
![]() Для кожної оксигеновмісної кислоти існує відповідний оксид, його називають_____________
Для кожної оксигеновмісної кислоти існує відповідний оксид, його називають_____________
Практична лабораторія
Гра “Пасьянс”(1б)
____________________________________________________________________________________
Гра “Третій зайвий” (1б)
Визначте у переліку зайву речовину і вкажіть ознаку, за якою вона відрізняється від інших.
H2S, H2CO3, H2SO4
____________________________________________________________________________________
Гра “Хрестики - нулики” (1б)
Виграшний шлях_______________________________
|
HBr |
H2S |
H3PO4 |
|
HF |
H2SO4 |
HCl |
|
HNO3 |
H2CO3 |
HI |
Технологія „Снігова куля” (1б)
|
Формула кислоти |
Назва кислоти |
Назва відповідної солі |
|
H2SO4 |
|
|
|
|
хлоридна |
|
|
|
|
карбонат |
|
H2SiO3 |
|
|
|
|
ортофосфатна |
|
|
|
|
нітрат |
|
HBr |
|
|
|
|
йодидна |
|
![]()
Експериментальна лабораторія.
Лабораторний дослід №1 “Дія кислот на індикатори”
_____________________________________________________________________________________________________________________________________________________________________________
Лабораторний дослід №2 “Взаємодія кислот з металами”(1,5)б
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________Реакція заміщення – це ______________________________________________________________________________________________________________________________________________________________________________
Дослід №3. “Взаємодія основних оксидів з кислотами”(0,5б)
______________________________________________________________________________________________________________________________________________________________________________
Реакція обміну – це ____________________________________________________________________
Дослід №4. “Взаємодія основ з кислотами” (0.5б)
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Дослід №5. “Взаємодія солей з кислотами”(0,5б)
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
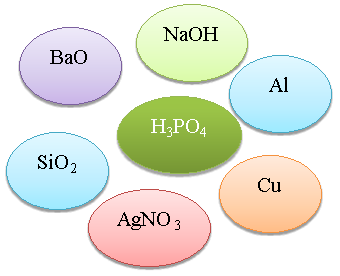
Визнач реакцію. З’єднайте стрілочками із центральною речовиною тільки ті речовини, що можуть із нею взаємодіяти та запишіть рівняння реакцій (1б.)
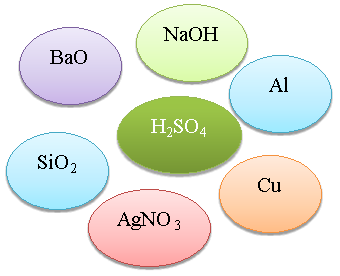
Сьогодні я на уроці дізнався, що______________________________________________________
Я навчився(лась)___________________________________________________________________
Я навчився здійснювати, складати, писати_____________________________________________
Мені найбільше сподобалось________________________________________________________
Кількість балів________
Для нотаток __________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Дата проведення_______________
Опорний конспект учня до уроку
Класна робота
учня 8 -___ класу
_________________________________
«Зібратись разом – це початок,
Триматись разом – це прогрес,
працювати разом – це успіх.»
Генрі Форд
Тема уроку: «Хімічні властивості кислот.»
![]() ХІД УРОКУ
ХІД УРОКУ
Теоретична лабораторія
«Хімічний ринг» (0,5 балів – 4б)
Сполука, молекула якої містить один чи декілька атомів Гідрогену, здатних під час хімічних
реакцій заміщуватися на атоми металічного елемента___________________________________
За вмістом Оксигену кислоти поділяють на ___________________________________________
Частину молекули кислоти, сполучену з атомом Гідрогену, називають______________________
Кількість атомів Гідрогену в молекулі кислоти визначає_________________________________
Елемент, що утворює кислоту, називають______________________________________________
Кількість атомів Гідрогену в молекулі кислоти називають________________________________
За хімічною активністю кислоти поділяють на__________________________________________
![]() Для кожної оксигеновмісної кислоти існує відповідний оксид, його називають_________________
Для кожної оксигеновмісної кислоти існує відповідний оксид, його називають_________________
Практична лабораторія
Гра “Пасьянс”(1б)
________________________________________________________
Гра “Третій зайвий” (1б)
Визначте у переліку зайву речовину і вкажіть ознаку, за якою вона відрізняється від інших.
HCl, H2S, H3PO4
________________________________________________________
Гра “Хрестики - нулики” (1б)
Виграшний шлях_______________________________
|
HCl |
HNO3 |
H3PO4 |
|
H2SiO3 |
H2S |
HBr |
|
H2SO4 |
H2CO3 |
HI |
Технологія „Снігова куля” (1б)
|
Формула кислоти |
Назва кислоти |
Назва відповідної солі |
|
HCl |
|
|
|
|
сульфатна |
|
|
|
|
карбонат |
|
H2SiO3 |
|
|
|
|
ортофосфатна |
|
|
|
|
нітрат |
|
HBr |
|
|
|
|
йодидна |
|
![]()
Експериментальна лабораторія.
Лабораторний дослід №1 “Дія кислот на індикатори”
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Лабораторний дослід №2 “Взаємодія кислот з металами”(1,5)б
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________Реакція заміщення – це ________________________________________________________________
_____________________________________________________________________________________
Дослід №3. “Взаємодія основних оксидів з кислотами”(0,5б)
______________________________________________________________________________________________________________________________________________________________________________
Реакція обміну - це ____________________________________________________________________
Дослід №4. “Взаємодія основ з кислотами” (0.5б)
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Дослід №5. “Взаємодія солей з кислотами”(0,5б)
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Визнач реакцію. З’єднайте стрілочками із центральною речовиною тільки ті речовини, що можуть із нею взаємодіяти та запишіть рівняння реакцій (1б.)
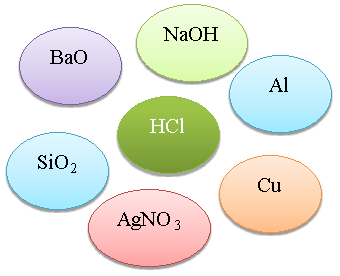
Сьогодні я на уроці дізнався, що_______________________________________________________
Я навчився(лась)____________________________________________________________________
Я навчився здійснювати, складати, писати______________________________________________
Мені найбільше сподобалось_________________________________________________________
Кількість балів________
Для нотаток __________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Тема: Хімічні властивості кислот.
Мета уроку:
- ознайомити учнів з фізичними властивостями кислот, закріпити вміння складати формули кислот;
- з’ясувати хімічні властивості кислот, пояснити використання індикаторів для визначення кислотного середовища;
- продовжити знайомити учнів з електрохімічним рядом напруг металів та його використанням під час складання рівнянь реакцій, в яких беруть участь метали;
- з’ясувати суть реакції обміну на прикладі взаємодії кислот з оксидами металів;
- продовжити роботу над закріпленням правил техніки безпеки під час роботи з кислотами;
- розвивати логічне та образне мислення учнів, пам’ять, уяву, уміння порівнювати, узагальнювати, виділяти головне;
- виховувати бережливе ставлення до хімічних реактивів, інтерес до хімії.
Тип уроку: комбінований.
Обладнання: хімічні прилади й реактиви, пробірки, картки з формулами кислот, розчини сульфатної, хлоридної та лимонної кислот, індикатори: лакмус, метилоранж, фенолфталеїн, універсальний; магній, мідь, купрум (ІІ) оксид, спиртівка, пробіркотримач, сірники
Методи: інтерактивні методи навчання: робота у групах, ігри “Хімічний ринг”, “Пасьянс”, “Третій зайвий”, “Хрестики-нулики”, технологія “Снігова куля”
Епіграф уроку:
«Зібратись разом – це початок,
триматись разом – це прогрес,
працювати разом – це успіх.»
Генрі Форд
Хід уроку
І. Організаційний момент, повідомлення теми і мети уроку
Доброго дня учні та шановні гості, сьогодні на уроці ми працюватимемо разом і кожному з вас я хочу побажати успіху. Чудовим виразом який імпонує темі нашого уроку є вислів Генрі Форда, який писав: «Зібратись разом – це початок, триматись разом – це прогрес, працювати разом – це успіх.» Тож успіху нам усім!
Темою сьогоднішнього уроку є «Хімічні властивості кислот.» Давайте разом з вами спробуємо визначити мету нашого уроку. Які б ви могли поставити задачі? (учні відповідають)
Ви сьогодні об’єднані у команди і будемо працювати в таких лабораторіях:
І - теоретична лабораторія;
ІІ - практична лабораторія;
ІІІ - експериментальна лабораторія;
Перед вами знаходиться ваш робочий зошит-путівник, який вам допоможе працювати в лабораторіях. На останній сторінці путівника є лист самооцінювання, в якому ви позначите отримані бали.
Всі налаштовані на роботу?
Слайд Теоретична лабораторія.
ІІ. Актуалізація і коригування знань учнів
Слайд Інтерактивна гра “Хімічний ринг” (0,5 балів, макс- 4б)
- Сполука, молекула якої містить один чи декілька атомів Гідрогену, здатних під час хімічних реакцій заміщуватися на атоми металічного елемента …
Кислота.
- За вмістом Оксигену кислоти поділяють на …
Оксигеновмісні та безоксигенові.
- Частину молекули кислоти, сполучену з атомом Гідрогену, називають …
Кислотним залишком.
- Кількість атомів Гідрогену в молекулі кислоти визначає …
Валентність кислотного залишку.
- Елемент, що утворює кислоту, називають …
Кислототворним.
- Кількість атомів Гідрогену в молекулі кислоти називають …
Основністю.
- За хімічною активністю кислоти поділяють на …
Сильні, середні та слабкі.
- Для кожної оксигеновмісної кислоти існує відповідний оксид, його називають …
Кислотним оксидом.
Слайд Практична лабораторія
В практичній лабораторії ми узагальнимо знання щодо складання хімічних формул кислот, їх назв та класифікації.
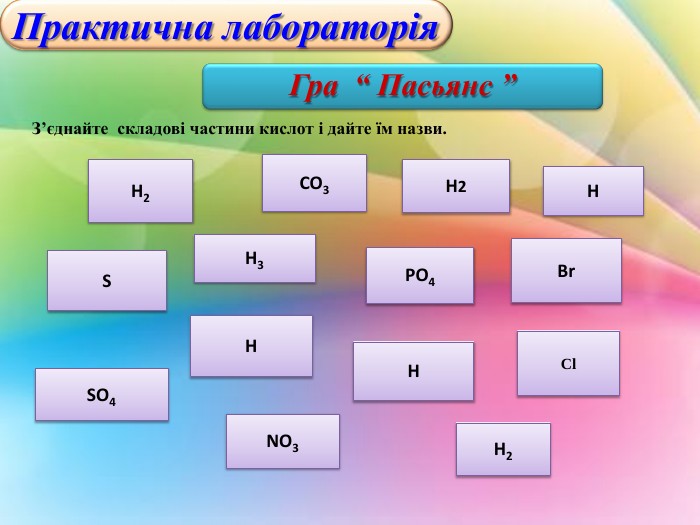
Отже, почнемо з завдання-гри «Пасьянс»
Слайд Гра “Пасьянс”(1б)
З’єднайте складові частини кислот і дайте їм назви.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
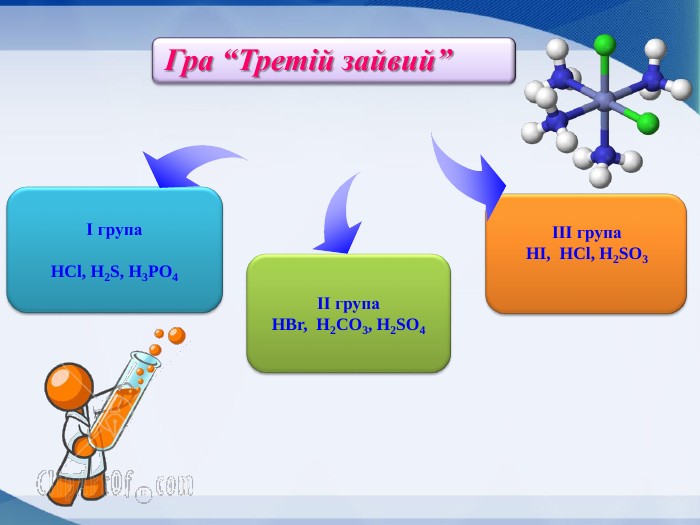
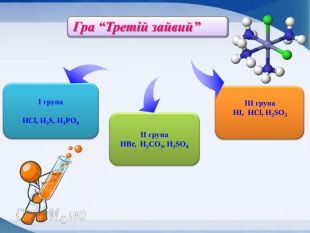
Слайд Гра “Третій зайвий” (визначте у переліку зайву речовину і вкажіть ознаку, за якою вона відрізняється від інших) (1б.)
І гр. HCl, H2S, H3PO4
ІІ гр. H2Se, H2CO3, H2SO4
ІІІгр. HBr, HCl, H2SO3
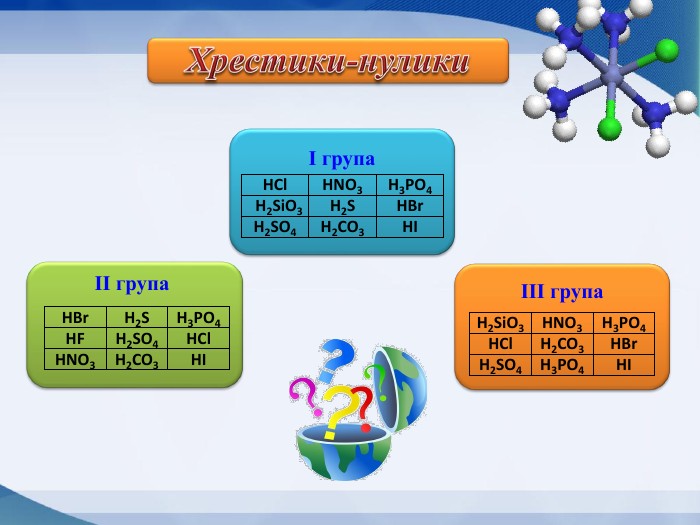
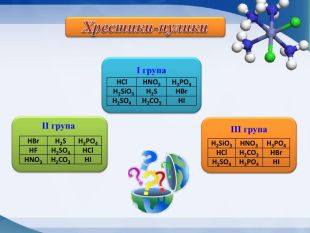
Слайд А тепер давайте проведемо гру “Хрестики-нулики”
Виграшний шлях – формули безоксигенових кислот. (1б)
|
HCl |
HNO3 |
H3PO4 |
|
H2SiO3 |
H2S |
HBr |
|
H2SO4 |
H2CO3 |
HI |
Ігр.
.
|
HBr |
H2S |
H3PO4 |
|
HF |
H2SO4 |
HCl |
|
HNO3 |
H2CO3 |
HI |
ІІгр.
|
H2SiO3 |
HNO3 |
H3PO4 |
|
HCl |
H2CO3 |
HBr |
|
H2SO4 |
H3PO4 |
HI |
ІІІгр.
Технологія „Снігова куля” (1б) Слайд
Групам учнів роздається картка із пропущеними формулами та назвами кислот, які учні повинні дописати, передаючи картку по ряду.
|
Формула кислоти |
Назва кислоти |
Назва відповідної солі |
|
H2SO4 |
|
|
|
|
хлоридна |
|
|
|
|
карбонат |
|
H2SiO3 |
|
|
|
|
ортофосфатна |
|
|
|
|
нітрат |
|
HBr |
|
|
|
|
йодидна |
|
|
Формула кислоти |
Назва кислоти |
Назва відповідної солі |
|
HCl |
|
|
|
|
хлоридна |
|
|
|
|
карбонат |
|
H2SiO3 |
|
|
|
|
ортофосфатна |
|
|
|
|
нітрат |
|
HBr |
|
|
|
|
йодидна |
|
|
Формула кислоти |
Назва кислоти |
Назва відповідної солі |
|
H2PO4 |
|
|
|
|
хлоридна |
|
|
|
|
карбонат |
|
H2SiO3 |
|
|
|
|
ортофосфатна |
|
|
|
|
нітрат |
|
HBr |
|
|
|
|
йодидна |
|
ІІІ. Пояснення нового матеріалу
Ми крокуємо до експериментальної лабораторії
Слайд Експериментальна лабораторія.
Ми з вами повторили назви та класифікацію кислот, а зараз розпочнемо вивчення теми : “Хімічні властивості кислот”. Але для початку згадаємо з вами правила техніки безпеки при роботі з кислотами. Слайд
- Уважно читайте етикетки на склянках
- Речовини для дослідів беріть не більше 1 - 2 мл (наливайте обов'язково над лотком!)
- Не залишайте склянки з кислотами відкритими
- Не виливайте залишки реактивів з пробірки назад у склянку, з якої він був узятий
- Якщо випадково кислота потрапила на руки чи на одяг - негайно змийте її великою кількістю води, нейтралізуйте розчином соди і знову змийте водою
- Нагріваючи кислоти, користуйся тримачем, стежте, щоб стінки пробірки над рідиною не перегрілися, а рівномірно прогрівалася вся пробірка.
- Якщо потрібно розбавити сульфатну кислоту, пам'ятайте правило:
„Спочатку вода,
Потім кислота.
Інакше - трапиться біда!”
Хімічні властивості кислот:
- Лабораторний дослід №1 “Дія кислот на індикатори”. Слайд
Учні випробовують розчини хлоридної, сульфатної та фосфатної кислот індикаторними папірцями, лакмусом, метилоранжем, фенолфталеїном.
Роблять висновок: Індикатори - це речовини, що змінюють свій колір в розчинах кислот, крім фенолфталеїну.
- Лабораторний дослід №2 “Взаємодія кислот з металами”. Слайд
У першу пробірку помістити декілька гранул чинку – Zn, у другу – Mg, у третю – Cu. До кожної пробірки долити 2-3 мл І група – хлоридної кислоти, ІІ група – сульфатної кислоти, ІІІ група – фосфатної кислоти. Що спостерігаєте? Напишіть рівняння реакцій, які відбуваються.(1,5б)
6HCl + 6Al = 2AlCl3 + 3H2
Mg + 2HCl = MgCl2 = H2
Cu + HCl = реакція не відбувається.
3H2SO4 + 2Al = Al2(SO4)3 + 3H2
H2SO4 + Mg = MgSO4 + H2
H2SO4 + Cu = реакція не відбувається.
H3 PO4 + Al = AlPO4 + H2
2H3 PO4 +3Mg = Mg3(PO4)2+ 3H2
H3 PO4 + Cu = реакція не відбувається.
Діти, що спільного в усіх рівняннях реакції? (Виділення Н2). Це реакція заміщення, під час якої атоми Гідрогену заміщуються на атоми меалів.
Робота з рядом активності металів (пояснення вчителя з використанням презентації) Слайд
Досліди показали, що метали за активністю витіснення водню можна розташувати в ряд, який називається витискувальним рядом металів, або рядом активності металів.
Li, K, Ba, Ca, Na, Mg, Be, Al, Mn, Cr, Zn, Fe, Ni, Sn, Pb, (H), Cu, Ag, Hg, Pt.
Дослід №3. “Взаємодія основних оксидів з кислотами” Слайд
Розглянемо ще одну властивість кислот. Виконаємо дослід. Але дотримуємося правил техніки безпеки.
У пробірку насипати трохи порошку купрум (ІІ) оксиду і додати хлоридної кислоти, а потім обережно нагріти. Що ви помітили? З’явилося зеленувато-блакитне забарвлення.
З оксидами металів у кислоти проблем менше. Отримуємо завжди сіль і воду, а тип реакції між ними – обміну. Давайте запишемо рівняння реакції.
CuO + 2HCl → CuCl2 + H2O (0,5 б)
MgO + H2SO4 → MgSO4 + H2O
Що таке реакція обміну? Це реакція між двома складними речовинами, за яких вони обмінюються складовими.
Дослід №4. “Взаємодія основ з кислотами” Слайд
До розчину кислоти додати кілька краплин індикатору метилоранжу, після появи забарвлення додати 1-2 мл розчину кислоти, І гр. – HCl, ІІ гр. - H2SO4 , ІІІ гр. - H3PO4
Які зміни відбулись? Реакція нейтралізації – це реакція взаємодії кислоти з основою, в результаті якої утворюються сіль та вода.
Дослід №5. “Взаємодія солей з кислотами”. Слайд
До розчину солі додати 1-2 мл кислоти. Скласти рівняння реакції.
Н2SO4 + 2NH4Cl = (NH4)2SO4 + 2HCl
HCl + CuSO4 = CuCl2 + H2SO4
2H3PO3 + 3CuSO4 = Cu3(PO4)2 + 3H2SO4
ІV. Закріплення нового матеріалу Слайд
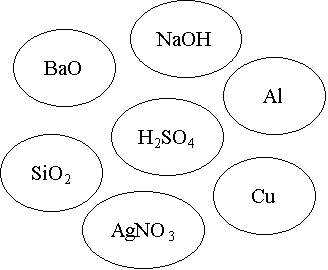 Завдання. З’єднайте стрілочками із центральною речовиною тільки ті речовини, що можуть із нею взаємодіяти та запишіть рівняння реакцій.
Завдання. З’єднайте стрілочками із центральною речовиною тільки ті речовини, що можуть із нею взаємодіяти та запишіть рівняння реакцій.
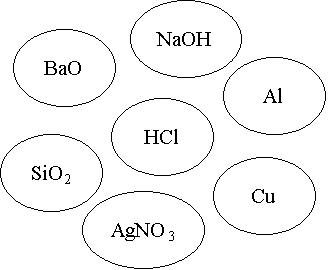
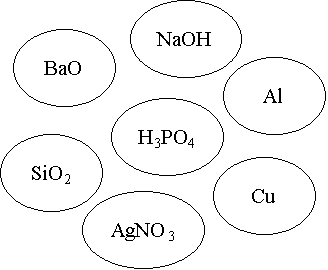
V. Рефлексія. Оцінювання діяльності класу.
Отже, наш урок добігає кінця і на завершення давайте підведемо підсумки, що вам найбільше запам’яталось, чого ви навчились. Для цього вам допоможуть незакінчені речення:
Сьогодні я на уроці дізнався, що____________________________________________
Я навчився(лась)________________________________________________________
Я навчився здійснювати, складати, писати___________________________________
Мені найбільше сподобалось_______________________________________________
Також у зошиті - путівнику підрахуйте кількість балів та оцініть себе. Сьогодні на уроці добре відповідали і працювали (П.І.)
VІ. Підбиття підсумків роботи на уроці
Домашнє завдання
Опрацювати §
Творче завдання: Написати казку або вірш про властивості кислот.
Підготувати повідомлення на тему : “Застосування кислот в сільському господарстві”


про публікацію авторської розробки
Додати розробку