Урок "енергетичні рівні та підрівні; їх заповнення електронами в атомах хімічних елементів № 1-20".
КОНСПЕКТ УРОКУ 8 КЛАС
Виконав: Безсмертний Богдан
Тема уроку: енергетичні рівні та підрівні; їх заповнення електронами в атомах хімічних елементів № 1-20.
Мета уроку: розширити уявлення учнів про будову атомів; навчитися складати електронні формули, схеми розподілу електронів по квантових комірках для елементів I—III періодів; формувати уміння учнів визначати електронну будову атома за його положенням у періодичній системі; розвивати творчі здібності учнів, уважність; робити логічно обумовлені висновки; розвивати навчально-пізнавальний інтерес до вивчення хімії.
Тип уроку: урок вивчення нового матеріалу.
Методи навчання: вербальні (пояснення, репродуктивна, евристична бесіда, полілог, індивідуальне опитування), наочні (ілюстрації, таблиця хімічних елементів), практичні (розв’язування доцільно підібраних завдань).
Обладнання: дошка, мультимедія, підручники, роздатковий матеріал.
Література:
1. http://svesaschool2.sumy.sch.in.ua/Files/downloads/Класифікація%20типів%20уроків .pdf
2. https://files.pidruchnyk.com.ua/uploads/book/8-klas-himiya-butenko-2021poglyb.pdf
3. https://files.pidruchnyk.com.ua/uploads/book/8-klas-himiya-popel-2021.pdf
4. https://files.pidruchnyk.com.ua/uploads/book/8-klas-himiya-grygorovych2021.pdf
ХІД УРОКУ
Організаційний момент (2-3 хвилини).
Підготовка вчителем класу до уроку. Визначення відсутніх; перевірка готовності учнів до уроку; перевірка наявності наочних посібників. Оголошення теми уроку.
Актуалізація опорних знань (3-5 хвилини).
1. З чого складається атом?
2. Що таке електрон та орбіталь?
3. Як визначити кількість електронів у атомі?
4. Чи всі електрони в атомі однакові? Чим вони відрізняються?
5. Яка максимальна кількість електронів може перебувати: на s-підрівні; на p-підрівні; на d-підрівні?
Мотивація навчальної діяльності (2-3 хвилини).
Повторюючи будову атома на попередньому уроці ми з вами більш детально зупинились на складі атомних ядер. Але під час хімічних реакцій ядро атома не змінюється, а змін зазнають оболонки атома, які називають електронними оболонками. Знаючи будову електронних оболонок можна пояснити властивості хімічних елементів. Сьогодні ми повторимо і поглибимо ваші знання про будову електронних оболонок атомів елементів, складемо електронні та електронно-графічні формули елементів.
Вивчення нового матеріалу (25-30 хвилин).
В електронних оболонках атомів орбіталі існують не хаотично. Вони утворюють чіткі структури, що різняться кількістю і типом орбіталей. Структуру орбіталей в атомі можна порівняти з багатоповерховим будинком, у якому окремі кімнати — це орбіталі. Кожний поверх — це енергетичний рівень, або енергетичний шар.
Сучасна модель атома враховує енергію електронів. У цій моделі електрони розподіляють за так званими енергетичними рівнями (схема 2).
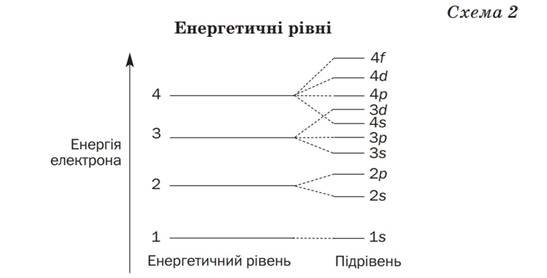
Кожний енергетичний рівень заповнюють електрони з однаковою чи дуже близькою енергією. Електрони першого рівня мають найменшу енергію; вони пере бувають найближче до ядра атома. Другий рівень займають електрони з вищою енергією, третій — зі ще вищою і т. д
Енергетичні рівні складаються з підрівнів, причому номер рівня вказує на кількість підрівнів. Так, перший рівень має один підрівень, другий — два, третій — три, четвертий — чотири і т. д. (схема 2).
Замість терміна «енергетичний рівень» нерідко використовують інший — «електронна оболонка».
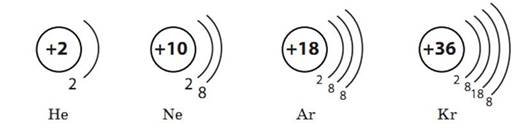
Шарувату будову електронної оболонки атомів можна зобразити так: окружністю позначене ядро, що має певний заряд, а дугами — енергетичні рівні:

Номер періоду, в якому розміщений хімічний елемент, вказує на кількість енергетичних рівнів (шарів), по яких рухаються електрони. Наприклад:
Розподіл електронів за енергетичними рівнями. Кожний енергетичний рівень містить обмежену кількість електронів. Їхню максимальну кількість визначають за формулою:
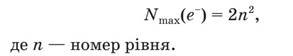
Енегретичні підрівні.
Отже, перший енергетичний рівень складається з однієї орбіталі, другий — із чотирьох, третій — із дев’яти тощо. У багатоповерховому будинку кожний поверх розділяють на різні квартири. Але наш будинок незвичайний. Кількість квартир на кожному поверсі дорівнює номеру поверху, тобто на першому поверсі одна квартира, на другому — дві тощо. Так само і в електронній оболонці кожний енергетичний рівень складається з енергетичних підрівнів.
Кількість енергетичних підрівнів на енергетичному рівні дорівнює номеру цього рівня!

Зазвичай квартири в будинках розділяють на кімнати. У нашому випадку кімнати — це орбіталі. Кожний енергетичний підрівень може містити лише певну кількість орбіталей, що відповідає його типу:

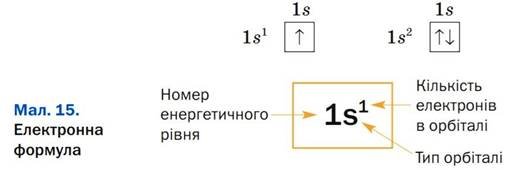
На першому енергетичному рівні може перебувати не більше 2•12 = 2 електронів. Вони розміщуються в одній орбіталі (сферичній), є sелектронами, мають однакову енергію, але різняться своїми спінами. Заповнення електронами першого енергетичного рівня проілюструємо так званими електронними формулами (мал. 15) та їхніми графічними варіантами:
Другий енергетичний рівень може вмістити максимум 2•22 = 8 електронів. Два з них займають одну sорбіталь, але більшого об’єму, ніж та, що належить першому рівню. Вони також мають протилежні спіни. Решта (шість) електронів другого рівня є р електронами. Оскільки в кожній орбіталі може перебувати не більше двох електронів, то р орбіталей повинно бути 6 : 2 = 3.
Електронна формула заповненого другого енергетичного рівня — 2s2 2p6. Сферична орбіталь для електрона вигідніша за гантелеподібну. Тому s електрони другого енергетичного рівня мають трохи нижчу енергію, ніж р електрони. Це можна показати у графічному варіанті електронної формули, розмістивши p орбіталі вище за s орбіталь:
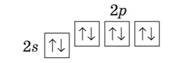
Отже, другий енергетичний рівень складається з двох підрівнів. Їх позначають так само, як і відповідні електрони: 2s підрівень, 2p підрівень.
Третій енергетичний рівень вміщує не більше 2•32 = 18 електронів. На ньому є три підрівні — 3s, 3p і 3d.
Якщо на s підрівні може бути не більше двох електронів, на р підрівні — не більше шести, то максимальна кількість електронів на d підрівні становить десять (18-2-6 = 10). Це — d електрони; вони займають п’ять орбіталей.
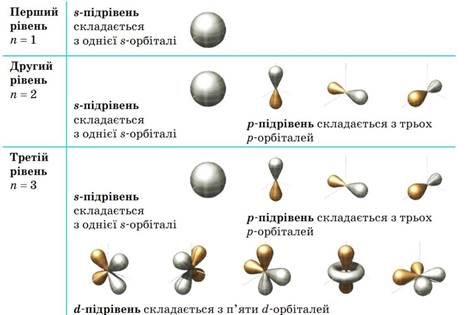
Тож можна перелічити орбіталі, з яких складають енергетичні рівні та підрівні, у такий спосіб (для перших трьох рівнів):
Графічно орбіталь прийнято позначати квадратом. Отже, орбіталі перших чотирьох енергетичних рівнів будуть виглядати так:
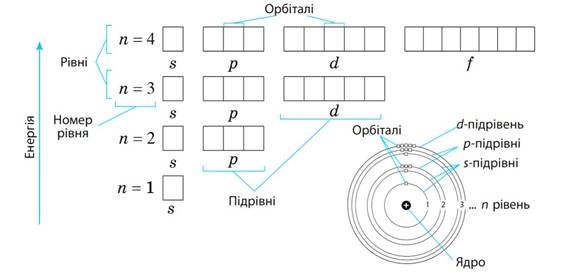
Як ми бачимо, перший енергетичний рівень складається з одного s-підрівня, утвореного однією s-орбіталлю. Другий рівень складається з двох підрівнів (s та p), утворених однією s-орбіталлю і трьома p-орбіталями (усього чотири). Третій рівень складається з трьох підрівнів (s, p та d), утворених однією sорбіталлю, трьома p-орбіталями і п’ятьма d-орбіталями (усього дев’ять).
На четвертому рівні додається ще сім f-орбіталей, і загалом четвертий рівень складається з 16 орбіталей. Отже, загальна кількість орбіталей на рівні n дорівнює n2
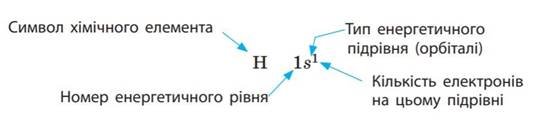
Електронна формула.
Електрони займають орбіталі послідовно, починаючи з першого енергетичного рівня, за порядком збільшення енергії рівня. Спочатку «заселяється» перший енергетичний рівень, потім — другий, третій тощо. Цей принцип називають принципом найменшої енергії.
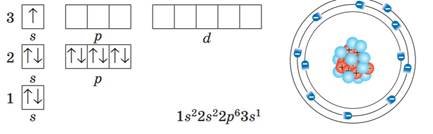
Так, в атомах хімічних елементів першого періоду заповнюється лише перший енергетичний рівень, в атомах елементів другого періоду — перші два енергетичні рівні, третього — три тощо.
Наприклад, Гідроген розміщений у першому періоді під номером 1. Це означає, що в електронній оболонці його атомів міститься лише один електрон, який перебуває на першому енергетичному рівні на єдиній sорбіталі. Графічно будову електронної оболонки атомів Гідрогену записують у такий спосіб:
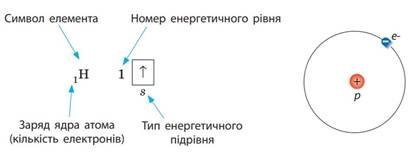
Електронна формула Гідрогену має вигляд:
Гелій також розміщений у першому періоді, тож в електронній оболонці його атомів так само заповнюється перший енергетичний рівень, що складається з однієї s-орбіталі. Але на цій орбіталі вже міститься два електрони, оскільки порядковий номер Гелію — 2.

В елементів другого періоду починає заповнюватися електронами другий енергетичний рівень. На другому рівні вже два підрівні: s-підрівень (одна орбіталь) і p-підрівень (три орбіталі). Наприклад, розглянемо будову електронної оболонки Літію, що містить три електрони (порядковий номер — 3). Оскільки перший рівень максимально вміщує два електрони, то на другому має міститися лише один електрон.
Серед усіх орбіталей s-орбіталі мають найменшу енергію, тому єдиний електрон другого енергетичного шару займатиме s-орбіталь, а р-орбіталі в цьому випадку залишаться вільними:

Розглянемо будову електронної оболонки Берилію. Його четвертий електрон також має обрати ту саму орбіталь, що й третій електрон Літію:

Лише якщо s-орбіталь заповнена, електрони починають займати р-орбіталі. Так, в атомі Бору (порядковий номер — 5) на р-орбіталі вже з’являється один електрон:

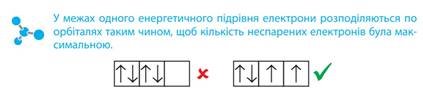
Якщо на р-підрівні має розташуватися більше ніж три електрони, то «зайвий» електрон утворить електронну пару з іншим електроном, що вже розміщений на цьому підрівні:
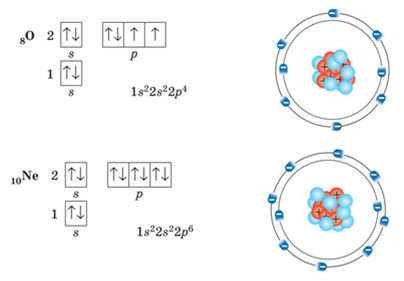
Електронні оболонки атомів елементів інших періодів заповнюються за такими самими правилами. Так, в атомів першого елемента третього періоду — Натрію — починає заповнюватися третій енергетичний рівень:
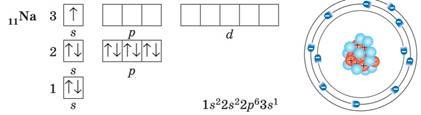
Зверніть увагу, що в атомі Натрію на третьому енергетичному рівні з’являється третій підрівень, що складається з d-орбіталей. Але, як і р-орбіталі, у Натрію орбіталі d-підрівня ще не заповнюються електронами й залишаються вакантними.
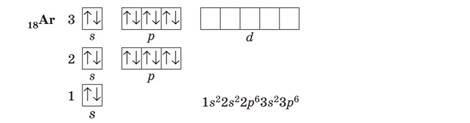
В атомах останнього елемента третього періоду — Аргону — повністю зайняті всі s- і р-орбіталі:
Узагальнення і систематизація (10 хвилин).
1. Скільки електронів може максимально перебувати на одній електронній орбіталі?
2. Скільки електронів максимально може перебувати на s-підрівні? pпідрівні? d-підрівні?
3. Який енергетичний рівень заповнюється раніше: перший чи другий? Відповідь поясніть.
4. Чому в атомі Літію електрон, що міститься на другому електронному рівні, перебуває на s-орбіталі, а не на р-орбіталі?
5. Як розподіляються електрони по орбіталях на р-підрівні?
Домашнє завдання (2-3 хвилини).
Опрацювати 5-6 параграф підручника Попель П. Хімія : підруч. для 8 кл. закл. заг. серед. освіти / Павло Попель, Людмила Крикля. — 2ге вид., переробл. — Київ : ВЦ «Академія», 2021. — 232 с. : іл, дати письмові відповіді в кінці 5 параграфу (29-31) та 6 параграфу (37-39), підготуватися до короткого опитування.


про публікацію авторської розробки
Додати розробку
