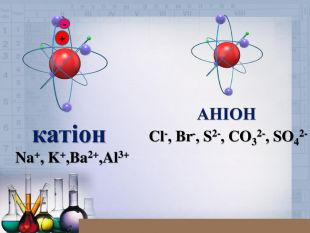
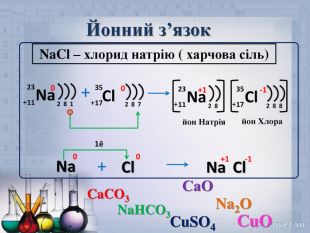
Презентація для 8 класу "Йони. Йонний зв’язок, його утворення"
Про матеріал
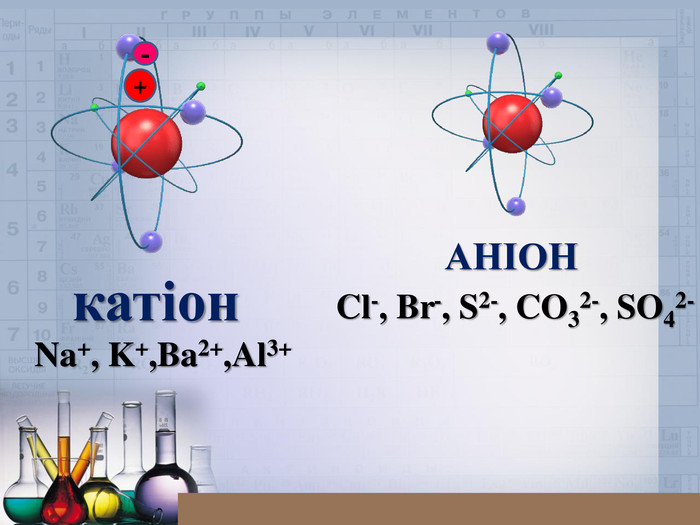
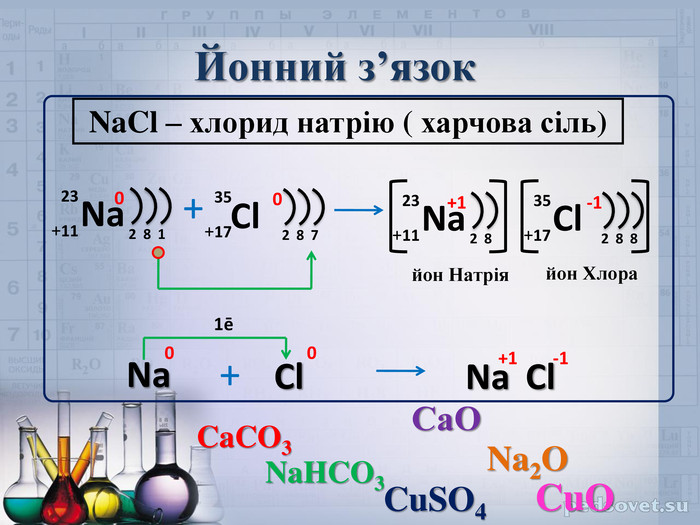
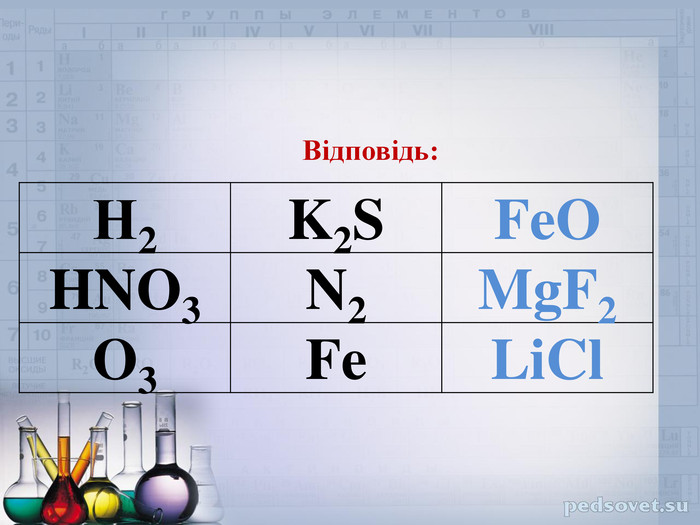
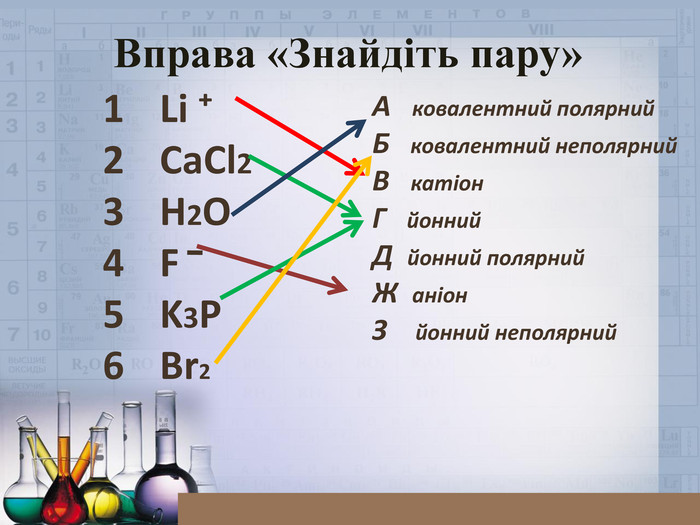
Ознайомити учнів зі змістом йонного зв’язку, механізмом його утворення;формувати навички складання електронних формул, уміння аналізувати, порівнювати, робити висновки;виховувати інтерес до предмета, формувати всебічно розвинену особистість, культуру спілкування
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку