Поширення солей в природі та їхнє практичне значення. Фізичні властивості середніх солей. Хімічні властивості середніх солей.
Тема. Поширення солей в природі та їхнє практичне значення.
Фізичні властивості середніх солей. Хімічні властивості середніх солей.
Мета: закріпити знання учнів про склад середніх солей, вміння складати формули середніх солей;
розглянути поширення солей у природі, їхні фізичні властивості;
розглянути використання солей;
звернути увагу учнів на солі, які найчастіше застосовуються у побуті;
розвивати логічне мислення, спостережливість, допитливість, розширювати кругозір.
Тип уроку: вивчення нового матеріалу
Методи навчання: розповідь, нестандартні та творчі завдання, робота з таблицею, наочний(демонстрація),інтерактивні методи «Мікрофон»
Обладнання та реактиви: штатив для пробірок, пробірки, кальцій карбонат, хлоридна кислота, таблиця розчинності, картки-додатки, зразки солей.
ХІД УРОКУ:
- Актуалізація знань, мотивація.
Ця речовина дала назву цілому класу сполук.
Історію цієї речовини можна порівняти з історією нафти та золота.
До першої половини ХIХ століття вона вважалась рідкісним продуктом,нерівномірно розподіленим між народами земної кулі. В Африці за неї купували рабів, золото, слонову кістку. Ще в середні віки ціна міцного робітника в Африці дорівнювала шматку цієї речовини розміром з його ступню. В Індії цю речовину можна було обміняти на сапфіри.
Більшість народів світу вклонялися цій речовині як символу самого життя, вічності та сталості, благополуччя й миру
В деяких країнах цю речовину використовували як гроші.
У давнину люди приписували цій речовині священні властивості, пов’язували її з добрими духами. У багатьох країнах збереглася традиція ставити перед гостями цю речовину як символ дружби та гостинності. Існує давня традиція: зустрічати дорогих гостей хлібом та …
Отже, я думаю, ви вже знаєте, про яку речовину йдеться. Звичайно, це натрій хлорид або, як ми говоримо в побуті, кухонна сіль.
-
Вивчення нового матеріалу.
- Застосування солей.
Сьогодні ми здійснимо туристичну подорож до країни Соляндії.
Ми побуваємо у деяких містах цієї країни, познайомимось з традиціями, населенням. Отже, починаємо. Спочатку ми побуваємо у місті Сульфатному. Населяють це місто сульфати, тобто солі сульфатної кислоти. Вони надзвичайно працьовиті й талановиті. Наприклад, натрій сульфат і калій сульфат працюють у склоробній промисловості. Окрім того, натрій сульфат приймає участь у виробництві соди, а калій сульфат сприяє кращому росту рослин як калійне добриво.
Не менш енергійним є алюміній сульфат. Ця сіль застосовується для очищення води, у паперові, текстильній, шкіряній галузях промисловості
Відомими у місті сульфатами є барій сульфат та кальцій сульфат. Вони обидва виконують важливі функції у медицині. Барій сульфат – рентгеноструктурний матеріал, а кальцій сульфат незамінний при лікуванні переломів. І це ще не все. Кальцій сульфат – будівельний матеріал, барій сульфат – наповнювач у виробництві паперу і каучуку.
Одним із почесних сульфатів є мідний купорос. Він і засіб захисту рослин, і джерело добування міді високої чистоти.
Деякі сульфати закодовані. Якщо вам зустрінуться написи Е-515 та Е-520
знайте, що це вже відомі нам калій сульфат та алюміній сульфат при виконанні функцій харчової добавки.
А тепер завдання:
1) учні, які народилися взимку, складають формули солей, про які йшлося у повідомленні, і три способи добування алюміній сульфату;
2) учні, які народилися влітку, складають формули солей, про які йшлося у повідомленні, і три способи добування купрум (II) сульфату;
3) учні, день народження яких восени, готують подібне повідомлення про хлориди та нітрати, використовуючи підручник;
4) учні, які народилися навесні, готують повідомлення про застосування карбонатів та ортофосфатів, також користуючись підручником.
2. Відповіді учнів кожної групи та обговорення.
3. Солі в природі.
Наша подорож триває. Зараз ми побуваємо з вами на лоні природи. Адже, зрозуміло, що солей тут ми знайдемо багато.
Всім відомо, що вода морів і океанів на смак солоно-гірка. Це тому, що в ній міститься багато різних солей. Навіть є спеціальна міра – солоність, яка визначається вмістом солей в одиниці об’єму морської води. 100 г морської води у середньому містять 3,5 г солей, серед яких є лідери – натрій та магній хлориди.
Якби висохли всі моря, то залишилося стільки б солей, що можна було б побудувати по всьому екватору стіну висотою 282 м та шириною 1,5 км.
Прісна вода також містить солі, але тут вже переважають солі кальцію та магнію (в основному карбонати та сульфати).
Найбільш солоною є вода Червоного моря.
Морська вода непридатна для пиття через високий вміст мінералів, для виведення яких з організму потрібно води більше, ніж її випита кількість. Однак після дистиляції, що знижує солоність, таку воду можна пити.
Багато солей є і в земній корі. Більшість із них силікати.
Кожен чув про сталактити і сталагміти. Це такі кам’яні бурульки, які можна побачити у печерах. Краплі сталактитів і гігантські сталагміти всередині печер – найвідоміші вапнякові чудеса. Ці печери утворюються внаслідок того, що кисла дощова вода розчиняє і забирає з осадової породи вапняку кальцій карбонат. І ось що утворюється.

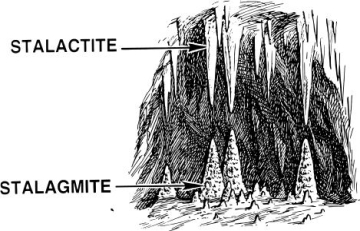
Солі також можуть бути і дорогоцінним камінням. Саму численну групу утворюють силікати, що включають топаз, циркон, гранат, турмалін і багато інших мінералів.
Серед ювелірних каменів є представники фосфатів – бірюза, карбонатів – кальцит і арагоніт. Перли і корали складені також в основному карбонатами.

БІРЮЗА

ГРАНАТ

ТУРМАЛІН

ТОПАЗ
Найбільша морська перлина («Перлина Аллаха») важить 6,370 кг.
Властивості перлів були відомі ще цариці Клеопатрі. Ось як пише про це Г.Р.Хагард у своєму романі «Клеопатра»:
«…Вона вийняла з вуха одну з тих величезних перлин … і … опустила перлину в оцет. Запанувала тиша, вражені гості, завмерши, спостерігали, як незрівнянна перлина повільно розчиняється в міцному оцті. Від неї не залишилося і сліду…»
Чому перлина розчиняється в оцті, зараз ми зясуємо. Адже ми переходимо до розгляду хімічних властивостей солей..
- Хімічні властивості солей.
Оцет – це розчин оцтової кислоти. Отже, солі реагують з кислотами.
У вас на столах є реактиви, і ви зараз виконаєте дослід, подібний до того, який зробила Клеопатра. Тільки замість перлів у вас кальцій карбонат, а замість оцту – хлоридна кислота.
Що спостерігаєте? Який газ виділяється? Чому він утворюється?
Складіть рівняння реакції.Назвіть продукти реакції.
Сіль + кислота = нова сіль + нова кислота.
Користуючись додатком № 1, зробіть висновок, у якому випадку солі реагують з кислотами.
ДОДАТОК № 1
Кислота + сіль = нова сіль + нова кислота
Реагуюча сіль утворена слабшою або більш леткою кислотою.
Ряд кислот за їхньою силою
HCIO4>HNO3>HCI>HBr>HI>H2SO4>H2SO3>H3PO4>HF>HNO2>
>CH3COOH>H2CO3>H2S>H2SiO3
Леткі кислоти: HF↑, HCI↑, HBr↑, HI↑, H2S↑, HNO3↑.
Нестійкі кислоти:
H2CO3 → CO2↑ + H2O;
H2SO3→ SO2↑ + H2O;
2HNO2→ NO↑ + NO2↑ + H2O.
-
Фізичні властивості кислот.
- демонстрація зразків солей;
- користуючись додатком № 2, охарактеризуйте фізичні властивості солей.
ДОДАТОК № 2
Вставте пропущені слова.
- Солі – йонні сполуки, тому за звичайних умов є …
(кристалічними)
- У більшості солей … температури плавлення.
(високі)
- Солі мають …колір.
(різний)
- За розчинністю у воді солі поділяють на розчинні, … та нерозчинні.
(малорозчинні)
5.Солі натрію і … добре розчиняються у воді.
(калію)
6.Нерозчинним у воді сульфатом є …
(барій сульфат)
7. Солі … кислоти всі розчиняються у воді.
(нітратної)
8.Нерозчинним у воді хлоридом є …
(арґентум хлорид)
9.Кальцій карбонат є … у воді.
(нерозчинним)
10.Барій сульфіт є … у воді.
(малорозчинним)
- Закріплення знань.
1. Метод «Мікрофон».
Кожен учень складає речення зі словом «солі» і передає умовний мікрофон наступному учню.
2.Вікторина.
Учитель запитує, учні відповідають.
ДОДАТОК № 3
ВІКТОРИНА
1.Назвіть сіль, що складається з алюмінію та кислотного залишку сульфатної кислоти.
2.У воді родиться і води боїться.
3.Солі якої кислоти всі розчиняються уводі?
4.Тривіальна назва натрій хлориду.
5. Солі карбонатної кислоти – це …
6. Що за чиж на чорнім полі креслить носом білий слід ?
7. Водний розчин цієї солі має красиве рожеве-фіолетове забарвлення та допомагає у багатьох випадках – при ангінах і стоматитах, у разі харчових отруєнь, для обробки виразок та опіків. Назвіть цю сіль.
8. Хліб із … не свариться.
9. Чоловік без друга, що їжа без …
3.Робота з додатком № 4.
Учні працюють в парах, взаємоперевірка.
ДОДАТОК № 4
Які з солей, що виражені формулами, реагують з хлоридною кислотою?
В-I: а) MgCI2, б) K2CO3; в) Na2S;
B-II: a)CaCO3;б) ВаS; в) Na2SO4.
Cкладіть відповідні рівняння реакцій.
4. Гра «Хто швидше?»
Робота з додатками № 5 та № 6.
ДОДАТОК № 5
- Na2SiO3 – натрій … (силікат).
- Ba(OH)2 – ця речовина належить до класу … (основ).
- Спосіб розділення однорідних сумішей - … (дистиляція).
- Назва хімічного елемента з порядковим номером № 47 (Аргентум).
З перших літер відгаданих слів утвориться тривіальна назва солі Na2CO3 –сода.
ДОДАТОК № 6
Заповніть таблицю
|
Хімічна формула |
Хімічна назва |
Тривіальна назва |
|
Na2CO3 |
|
|
|
KMnO4 |
Калій перманганат |
|
|
|
|
Кухонна сіль |
|
|
|
Мармур, вапняк |
|
NaNO3 |
|
Натрієва селітра |
|
|
|
Кальцієва селітра |
|
|
|
Калієва селітра |
- Осмислення, узагальнення та систематизація знань учнів.
Наша сьогоднішня подорож до країни Соляндії завершується, але на наступному уроці ми її продовжимо.
Що вам найбільше сподобалося сьогодні на уроці?
Про що ви хотіли б дізнатися на наступному уроці?
- Домашнє завдання.


про публікацію авторської розробки
Додати розробку
