Урок "Ферум як представник металічних елементів побічних підгруп. Фізичні та хімічні властивості сполук Феруму (ІІ) і Феруму (ІІІ)"
В конспекті розглянуто будова Феруму, фізичні та хімічні властивості заліза та його сполук, розглянуто біологічну роль та функції Феруму в організмі, подана інформація про використання в побуті та промисловості.
1.
Ферум як представник металічних елементів побічних підгруп. Фізичні та хімічні властивості сполук Феруму (ІІ) і Феруму (ІІІ)
Мета:
- освітня:розглянути фізичні й хімічні властивості заліза, сполук Феруму (ІІ) та Феруму (ІІІ), порівняти властивості сполук Феруму(ІІ) і Феруму (ІІІ), закріпити знання про залежність властивостей сполук Феруму від ступеня окиснення атомів, сформувати вміння студентів записувати рівняння реакцій, які характеризують основні хімічні властивості заліза й сполук Феруму, розглянути біологічну роль заліза, його функції в організмі.
- виховна: сформувати науковий світогляд студентів при вивченні фізичних та хімічних властивостей Феруму та його сполук, їх застосування; сприяти екологічному вихованню.
- розвиваюча:
1) розвивати спостережливість ;
2) розвивати пізнавальний інтерес до предмету;
3) розвивати навички складання рівнянь хімічних реакцій на прикладі хімічних властивостей Феруму та його сполук;
4) розвивати такі мисленнєві операції : вміння порівнювати, узагальнювати, робити висновки; самостійність при виконанні завдань
Тип заняття : засвоєння нових знань та вмінь.
Обладнання: періодична система хімічних елементів, таблиця розчинності, ряд активності металів. Солі Феруму (ІІ), (ІІІ), червона кров’яна сіль, жовта кров’яна сіль , роданід амонію , штатив з пробірками ,
колекція сполук заліза, металева проволока,
Навчальні картки : характеристика положення елемента в ПСЕ, характеристика фізичних властивостей металів, картки- завдання з теми «Ферум та його сполуки», правила техніки безпеки при роботі з хімічними реактивами.
2
Хід заняття
І. Організаційний етап . 2хв.
ІІ . Мотивація пізнавальної діяльності повідомлення завдань і мети
заняття 2хв.
ІІІ.Актуалізація раніше вивченого 5хв.
ІV. Вивчення нового матеріалу: 60хв.
1. Історія заліза.
2. Характеристика елемента. Положення в ПСЕ.
3. Походження назви. Поширення в природі
4. Біологічна роль Феруму
5. Фізичні властивості .
6. Хімічні властивості. Лабораторний дослід.
- Застосуванння заліза.
8. Цікаві факти про залізо .
V. Узагальнення вивченого. 10хв
VІ. Домашнє завдання. 1хв.
І . Організаційний етап.
Добрий день ! Я дуже рада знову зустрітися з вами . І привід для зустрічі у нас приємний .
По- перше , знову заняття з хімії ,
По – друге , мені здається , що ми зможемо порадувати один одного своїми знаннями , і ви дізнаєтесь багато нового і цікавого.
Перед початком уроку визначте свій настрій .
ІІ . Мотивація пізнавальної діяльності повідомлення завдань і мети
заняття .
Давні єгиптяни називали його „вааепера", що означає „той, що народився у небі”. Давні копти називали його «каменем неба». Вироби з нього цінувалися дорожче за золото. Один східний деспот навіть видав указ, яким під страхом смертної кари заборонялося всім, крім нього, носити зроблені з цього металу прикраси. В „Одіссеї” Гомера розповідається, що переможцям спортивних змагань вручали шматок цього металу та шматок золота - найбільші на той час коштовності. Алхіміки вважали його настільки неблагородним металом, що навіть займатися ним не хотіли.
Що ж це за метал? Які властивості він має? Про це ми дізнаємося на сьогоднішньому занятті.
Метали відомі здавна. Ще зі стародавності люди знали сім хімічних елементів, серед них і метал, який ми починаємо вивчати.
Яку просту речовину ми швидше за все розуміємо під словом метал?
Залізо.
« Залізо не лише основа всього світу, найголовніший метал оточуючої нас природи , але і основа культури та промисловості . воно знаряддя праці й війни. І важко в усій таблиці Менделєєва знайти інший такий
3
елемент . який був би так тісно пов’язаний з минулими , сучасними та майбутніми долями людства » А.Е.Ферсман.
Так, дійсно, саме цю речовину ми використовували і використовуємо найширше. Тому саме Ферум та просту речовину залізо, яку він утворює, ми з вами будемо вивчати сьогодні ( слайд 1) .
3.Актуалізація раніше вивченого .
-Як у періодичній системі розрізнити метали та неметали? (Якщо від Берилію до Астату провести діагональ, то у кутку зверху розташовані неметали, всі інші - метали).
- За якими фізичними властивостями метали відрізняються від неметалів ?
- Що називають періодом?
- Які види періодів ви знаєте?
- Чим відрізняється великий період від малого?
- З яких підгруп складається група?
- Як розрізнити елементи головної підгрупи від елементів побічної підгрупи?
- На що вказує порядковий номер елемента?
- Як визначити кількість протонів та електронів атома елемента?
- Як визначити кількість нейтронів атома елемента?
ІV. Вивчення нового матеріалу: .
Історія заліза.
У таблиці Менделєєва важко знайти другий такий метал, з яким так тісно була б пов’язана історія цивілізації.
В історії немає точної дати і місця відкриття заліза. Але воно відоме людству з ІІІ тис. до н.е. В Єгипті у ХІV до н.е. залізо вважалось самим цінним з металів, з нього виготовляли різне хатнє начиння.
В Греції в ХІХст. залізо вважалось дорожчим від золота . В Єгипті в період Давнього і Нового царства залізо спочатку використовували для виготовлення ювелірних виробів- амулетів і прикрас. Воно як і золото , срібло входило до складу дані , яку сплачували підкорені народи.
Відомо , що жінки багатьох африканських племен носили на руках і на ногах залізні прикраси. Дружини багатих людей несли на собі іноді майже пуд таких прикрас. Наречену одного з негретянських племен Західної Африки так прикрасили, що вона не могла рухатись без сторонньої допомоги.
Туземці майже до середини ХІХ ст. вважали залізо дорожчим за всі метали.
Англійський мореплавець ХVІІІ ст. Джеймс Кук розповідав, що на всіх островах Полінезії, найкращим подарунком для туземців було залізо. Супутники Кука говорили, що за один великий гвіздок туземці віддавали декілька метрів місцевої тканини , а за десяток таких гвіздків моряки одержали 10 свиней.
4
У наших предків була поговірка : «В бою залізо дорожче від золота», «Залізом і золото добуду»
А ось одна коротенька легенда . Її передає у своїх віршах німецький поет Баумбах:
« Когда победоносные полчища германцев, свергнувших могущество римлян, расположились после боя в долине рудного ручья , на вершине соседней горы показался горный дух и спросил победителей :
-Что хотите ? Золото на сотню лет или железо насегда ?
И под звон мечей воскликнула толпа :
- Железо, железо дай нам навсегда ! »
Але це все легенди. Є більш вагомі докази того , що був час коли залізо цінували дорожче від золота.
« Тебя славим , добрый друг Железо, - могучего великана в полнейшей силе» - писав у вірші « Гимн Железу» македонський поет Кочо Рацін . Про нього писали поети , вчені , політики . Відомі гімни на честь заліза древньоримського природодослідника Плінія Старшого.
Російський просвітник Левшин писав: » если бы цена вещей определялась их полезностью , то железо должно бы считаться драгоценным металлом, нет ремесла и художества, в котором оно не было бы необходимо»
Але саме головне в тому , що залізо є найважливішою складовою частиною в будові нашої планети . За сучасними уявленнями , в 16- ти кілометровій товщі земної кори міститься 4,5% заліза. В наступному шарі заліза в три рази більше, центр земної кулі складається з заліза з домішками Нікелю та Кобальту.
За якою ознакою хімічні елементи поділяють на:
а) s-елементи; б) р-елементи; в) d-елементи?
Характеристика елемента ( слайд 2, 3).
Користуючись планом характеристики хімічного елемента охарактеризуйте положення в ПСЕ елемента Феруму та будову його атома. ( робота за алгоритмом )
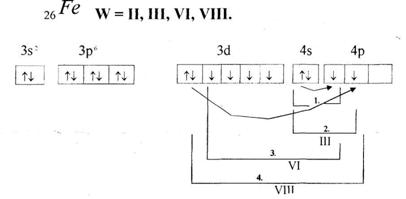
Ферум знаходиться в ІV- періоді, 4-му парному ряді, VПІ-В групі , побічній підгрупі періодичної системи. Порядковий номер Z = 26. Заряд атомного ядра +26, нейтронів 56- 26 = 30. На 4-х енергетичних рівнях розміщені 26 електронів : в атомах Феруму після заповнення 4 s -підрівня черговий електрон розміщується не на зовнішньому 4р-підрівні — четвертий енергетичний рівень електронної оболонки, а на третьому — передзовнішньому, на вільну d-орбіталь. Отже, Ферум — d–елемент. Електронна конфігурація його атома: Іs22s22р63s23р63d64s2, або 26Fе [Аг]3d64s2.
Число неспарених електронів в атома Феруму в нормальному стані дорівнює чотирьом, а в збудженому — шести, через те що один із двох 4s-електронів переходить на 4р-підрівень:
Схема переходу електронів
5
Унаслідок цього під час хімічних реакцій атоми Феруму як металічного елемента можуть відщеплювати два, три, чотири або шість електронів і виявляти в сполуках ступені окиснення +2 (FеО), +3 (Fе203), +4 (К2Fе03) і +6 (К2Fе04),
1) Ферум.
2) Fe
3) Ar (Fe) = 56
4) (26, період 4, VІІІ, побічна).
5) (+26, nр=26, n=30, е=26).
6) ІІ, ІІІ
7) Ме
8) Fe - залізо.
Бачити молекулу неозброєним оком – реально, побувати в ній – запросто. Столиця Бельгії надає таку можливість , серед класичних європейських будівель виділяється атомна модель під назвою Атоміум, яка була спроектована до міжнародної виставки , що проходила в Брюсселі

Атоміум —це стальна конструкція у вигляді атома заліза, правда, атома, збільшеного у 165 млрд.раз, так що його висота становить майже 102 метри, а вага- — 2400 тон. Автором проекту виступив архітектор Андре Ватеркейн, а безпосередньо будівництво велось під керівництвом Андре та Жана Полаків. Атоміум складається з дев’яти сфер діаметром 18 метрів, які сполучені між собою спеціальними трубами. Одна із сфер знаходиться в центрі, і до ней ідуть відразу вісім діагональних труб, в двох з яких розміщений 20- місний ліфт, яких лише за 25 секунд доставить на оглядову площадку , з якої відкривається прекрасна панорама Брюселя. Прозора криша ліфту робить підйом за півхвилини захоплюючим польотом.
Посля проведення виставки пам’ятник навіть хотіли знести, так як він не вписувався в архітектурний ансамбль європейської столиці .
Нестандартна за своїм зовнішнім виглядом будова доповнилась новими технологічними рішеннями після реконструкції 2006 г., а інтер’єр відповідним чином оформили відомі дизайнери. Модель дев’яти атомів, об’єднаних в молекулу заліза, відблискує своім сталевим покриттям і вдень
6
і вночі. Поверхню шарів в 240 м. кв. покривають 48 пластин з нержавіючої сталі. Сфера кожного «атома» служить в якості концертних і виставочних залів. Сфери сполучаються 23-х метровими коридорами , які оснащені східцями та ескалаторами і дозволяють переміщатися між ними.
Походження назви, поширення в природі ( слайди 4 , 5, 6, 7 , 8 , 9, 10 ).
У чистому природному стані залізо зустрічається лише в небагатьох місцях на Землі , наприклад на заході Гренландії. Чисте залізо іноді знаходять в метеоритах (залізо космічного походження). Протягом останніх 50 років випало 453 метеоритних дощі , які принесли на Землю 672 т метеоритного заліза. Це залізо порівняно легко піддається обробці , й саме з нього людина почала виготовляти найпростіші знаряддя . Але , на жаль, метеорити за замовленням на Землю не падали , а потреба в залізі була постійною.
Набагато частіше залізо зустрічається у вигляді хімічних сполук.
За поширенням у природі Ферум серед металічних елементів посідає друге місце після Алюмінію. Ферум входить до складу майже усіх гірських порід , піску, глини , головним чином оксигеновмісних сполук , які називають залізними рудами. Це :
бурі залізняки ( основний мінерал – лімоніт 2Fe2O3 *3H2O),
червоні залізняки ( основний мінерал -гематит Fe2O3),
магнітні залізняки ( основний мінерал - Fe3O4),
сидеритові руди ( основний мінерал - FeCO3 ) ,
залізний колчедан , або пірит FeS2
Не випадково назва мінералу «гематит» походить від грецьких слів «хайма» (означає кров) і « літос» - камінь. Стара російська назва цього мінералу
« кровавик » . Характерно , що і слово «руда» , яке колись , очевидно, відносилось тільки до родовищ заліза , споріднене до російського « рдеть» - бути яскраво- червоним - та українського « рудий » .
Багаті родовища магнітного залізняку зосереджені на Уралі поблизу
м. Магнітогорська та в Курській області (так звана Курська магнітна аномалія). Родовища червоного залізняку є в Україні поблизу м. Кривий Ріг. Родовища бурого залізняку зосереджені на Керченському півострові. Крім того, потужні родовища залізних руд виявлено і в інших місцях — на Кольському півострові, в Сибіру і на Далекому Сході .
( розгляд зразків залізних руд )
Біологічна роль Феруму ( слайд 11) . Повідомлення .
Ферум є біологічно важливим елементом. Він міститься в організмах усіх тварин і в рослин . Ферум входить до складу цитоплазми рослин , бере участь у процесі фотосинтезу. В організмі дорослої людини міститься близько
4 г Феруму. Він накопичується здебільшого в печінці , кістковому мозку, селезінці . Але основна частина Феруму входить до складу гемоглобіну – червоного пігменту крові, який виконує функцію переносу кисню від легень до тканин, а в зворотному напрямку — вуглекислого газу. Тому обов’язково треба
7
вживати харчові продукти, багаті на Ферум: петрушку, печінку, телятину, гречку, курагу тощо. ( слайд 12)
Дві крайності - недостача й передозування ( слайд 13 ) Повідомлення.
Найпоширенішими симптомами дефіциту заліза є:
1. Почуття втоми через анемію (стан, викликаний дефіцитом заліза). Часто виникає при збільшенні фізіологічних потреб у сполученні з недостатнім споживанням заліза. Наприклад, при вагітності, а також у дітей у віці від 6 до 18 місяців
2. Бліда шкіра
3.Запор
4. Ламкі нігті й слабкі зуби
Недолік заліза – це серйозна проблема, з іншої сторони його передозування може привести до отруєння. Такі явища надзвичайно рідкі, але можуть виникнути у зв'язку зі споживанням харчових добавок, при гемохроматозе – порушенні обміну заліза в організмі. Надлишок заліза приводить до ушкоджень печінки, бруньок і головного мозку.
Слід зазначити, що дози вище 100 мг. у день можуть викликати утому, втрату ваги й порушення в діяльності серцево-судинної системи. Що у свою чергу означає, що харчові добавки зі змістом заліза повинні бути виняткові за узгодженням з лікарем!
Нестача заліза в організмі припускає зниження гемоглобіну. Виникає захворювання , яке називають анемією. Для здоров'я це дуже небезпечно. Імунітет стає ослабленим, людина відчуває брак сил. Якщо в організмі не вистачає заліза, з'являється велика ймовірність простудних захворювань в будь-який час року ( слайд 14 ).
Нестача заліза чітко проявляється у зовнішньому і внутрішньому стані людини. Тим не менш, займатися самолікуванням, не визначивши головну проблему недуги, не можна. Є хвороби, які надолуження заліза переносять дуже погано. Це, перш за все, інфекційні захворювання кишечника, геморой, виразка стравоходу, рак кишечника або грижа.
Організм втрачає залізо внаслідок кровотечі, менструації, неправильного харчування. Часто людям радять вживати в їжу виключно ті продукти, в яких міститься максимальна кількість заліза і магнію . До таких продуктів відносяться морепродукти, овочі і фрукти. Найменше заліза містять молочні продукти. Люди, які сідають на молочну дієту, не отримують заліза взагалі, враховуючи той факт, що залізо засвоюється погано. При вживанні продуктів, разом з якими в організм проникають 10-15 мг заліза, засвоюється лише 10-15% цієї кількості, що неймовірно мало.Передозування залізовмісними продуктами
8
теж небезпечне , тому що організм може перенести гіперавітаміноз, простіше кажучи, шок.
Перш ніж лікувати себе вітамінами , здайте аналізи і проконсультуйтеся з лікарем. Якщо ж ви стали часто втомлюватися, скаржачись на кістки та м'язи, на поганий настрій і на постійний голод , втамовуючи який , ви все одно не наїдаєтеся - постарайтеся переглянути свій раціон . Існує ще кілька симптомів нестачі заліза , які варто враховувати.
Зверніть увагу на свої нігті і волосся . Нігті починають розшаровуватися, волосся - ламатися і випадати .Зовні вони виглядають тьмяно і мляво. Смакові відчуття теж змінюються . Особливо це стосується риби . Якщо м'ясо завдяки спеціям здається абсолютно звичним , то риба , яка зберігає свої смакові якості і без особливих спецій , здається позбавленою смаку і прісною.
У жінок кардинально змінюється менструальний цикл у календарі . Порушення пов'язані з тим , що знижується імунітет. При таких менструаціях жінка може втрачати набагато більше крові , ніж зазвичай.
Нервова система теж дуже страждає від браку заліза . Ви починаєте нервувати без причини . Тривоги бувають настільки сильними , що у вас навіть починається лихоманка . Сон стає неспокійним . Людину починають мучити кошмари , тому тривоги беруть гору над свідомістю.
Нестача заліза пов'язана з надмірним вживанням алкоголю і тютюну . Алкоголь вимиває всі запаси не тільки заліза , але й інших важливих мікро- і макроелементів . Але врахуйте , що при здачі аналізів потрібно обов'язково сказати лікареві про те , що ви випиваєте чи палите . З курінням справи йдуть складно . У курців гемоглобін завжди в нормі . Він сам по собі підвищується завдяки нікотину, який автоматично заповнює кисневе голодування .
Варто вчасно зайнятися поповненням заліза в організмі . Для цього не обов'язково вживати відразу всі препарати , в яких міститься залізо . Досить буде переглянути свій раціон і більш дбайливо ставитися до здоров'я .
Після здачі аналізів лікар може прописати вам деякі залізовмісні препарати , наприклад : Ферретаб, Матерна , Хеферол , Ферронал , Феррофольгамма, Сорбіфер Дуролес . Важливо враховувати режим прийому цих препаратів, особливо останнього . Практично у всіх цей препарат викликає нудоту. Але це не повинно лякати . Організм просто засвоює свою частку заліза , нагадуючи вам , що його у вас брак . Сорбіфер Дуролес краще пити за півгодини до їжі , інакше поглинання їжі буде дуже неприємним . Потрібно перетерпіти симптоми нудоти . Вони проходять за пару секунд .
Постарайтеся не вживати каву і чай . Справа в тому, що ліки з залізом потрібно пити днів 10-14. За цей термін можна утриматися від шкідливих звичок і від важких бадьорячих напоїв. Заодно очиститься організм . Вживайте більше фруктів і овочів, щоб залізо контактувало з природними його носіями .
Якщо ви приймаєте інші мікро- і макроелементи (магній, калій , кальцій), не варто пити відразу ж всі ліки . Цим ви не зробите краще , вважаючи , що зараз ваш організм отримає подвійну дозу і виліковуватиметься набагато швидше. Вживайте залізо ввечері , а інші вітаміни протягом дня . Залізо повинно засвоїтися , тому і часу йому буде потрібно більше.
9
Після прийому препаратів із залізом не варто вживати молочні продукти, тому що вони заважають залізу засвоїтися. Якщо вам дуже хочеться молочних продуктів - їжте їх через дві години після прийому заліза.
Якщо залізо в капсулах - приймайте такий препарат. Він ефективніший.
Пам'ятайте, що в тваринній їжі дуже багато заліза. Навіть більше: залізо там міститься двовалентне , тому постарайтеся їсти побільше м'яса, якщо відчуваєте, що брак заліза заводить у безвихідь ваш організм .
Основні джерела заліза ( слайд 15) Повідомлення.
Серед харчових продуктів «лідерами» по вмісту заліза є: печінка , свинина, бруньки , червоне м'ясо, збагачені вітамінами зернові й хлібобулочні вироби , м’ясо птиці , яйця , сік , чорнослив , бобові , горіхи , гречку, шпинат, петрушку , устриці , сухофрукти , курагу, коричневі морські водорості, овочі з темно-зеленим листям.
Перелік харчових продуктів, багатих залізом
|
Тип харчування |
доза |
залізо |
калорії |
|
квасоля |
1 чашка |
15 мг |
612 |
|
горох |
1 чашка |
12,5 мг |
728 |
|
соєві боби |
1 чашка |
9 мг |
376 |
|
капуста |
1 качан |
5 мг |
227 |
|
шпинат |
500 м |
9 мг |
75 |
|
брокколи |
500 м |
5 мг |
170 |
Найбільш важливі функції заліза в організмі
Про те, яку роль , відіграє залізо в організмі людини , можна розповісти декількома пунктами:
- Залізо є складовою частиною багатьох ферментів і білків;
- Бере участь у формуванні червоних кров'яних клітин і постачанні киснем тканин й органів;
- Відіграє ключову роль у процесах росту в організмі;
- Підвищує опірність організму й успішно бореться з ознаками стресу і депресії;
- Запобігає утомі і сприяє поліпшенню стану шкіри .
Фактори, які представляють потенційний ризик
Перший, безсумнівно, неправильне харчування, що є розповсюдженою проблемою як у дітей, так й у дорослих. Але діти особливо уразливі у віці статевого дозрівання , коли модні дієти на слуху, а їм так хочеться відповідати стандартам і прагнути до ідеальної фігури. Недолік мікроелементів у подібних дієтах спричиняє порушення росту й менструального циклу. Люди , які практикують вегетаріанство, можуть
10
також стикнутися із труднощами в одержанні поставок заліза. При доцільному підході в щоденному меню присутньо багато зернових продуктів, горіхів і бобових. Вагітність є ще одним фактором ризику, тому жінці , що виношує дитину , необхідно забезпечити для себе вживання продуктів, багатих залізом , щоб захистити плід від залізодефіцитної анемії. До суб'єктивних факторів, що тягнуть недостачу заліза , відносять також більшу втрату крові під час менструації, при донорській здачі крові, при грудному вигодовуванні і т.д.
Дефіцит заліза частіше спостерігається в жінок репродуктивного віку, ніж у чоловіків, у яких порівняно рідко спостерігається дефіцит заліза . Недостача заліза , як правило, асоціюється зі зниженим імунітету і м'язовою слабістю, зниженням концентрації й психічного функціонування імунної системи .
Більша його частина знаходиться в еритроцитах у складі гемоглобіну, у дихальних ферментах цитохромах , які беруть участь в окисно-відновних реакціях, а також в імуно-біологічних реакціях , потрібних для процесів росту і розвитку. Йони Fе2+ і Fе3+ входять до складу багатьох ферментів: каталази, цитохромоксидази, пероксидази тощо.
Чотири йони Fе2+, що входять до складу гемоглобіну, зв'язують чотири молекули кисню і переносять його до тканин . На цій властивості йонів Fе2+ і заснована роль гемоглобіну як переносника кисню . Сполуку гемоглобіну з молекулярним киснем називають оксигемоглобіном.
Біологічна роль Феруму в процесі дихання полягає в тому, що в тканинах його органічні сполуки каталізують процеси дихання безпосередньо в клітинах. Йони Феруму Fе2+ і Fе3+ беруть участь у біологічному окисненні і відновленні , тому що поперемінно то віддають, то приймають один електрон:
Fе3+ + е- ↔ Fе2+ ; Fе2+ — е- ↔ Fе3+
Ферум бере участь у процесах кровотворення , і тому його нестача в організмі призводить до розвитку анемії (недокрів'я).
Відсутність необхідної кількості сполук Феруму(П) в ґрунті уповільнює синтез хлорофілу та деяких вітамінів. Тому сполуки Феруму(П) у вигляді солі FеS04 • 7Н20 використовують у сільському господарстві як мікродобриво.
Низький гемоглобін: як заповнити дефіцит заліза в організмі (слайд 15).
Щоб підвищити низький гемоглобін і «тримати» його в нормі, потрібно одержувати з їжі 1,5 мг заліза на день. Але, виявляється, засвоює організм не більше 10%. Тому й заліза потрібно з'їдати в десять разів більше. Так з звідки ж брати цей цінний мікроелемент?
Дієтологи, для запобігання негативних наслідків, викликаних низьким гемоглобіном, склали свій рейтинг харчових продуктів з високим вмістом
11
заліза. Перелік продуктів, рекомендованих при низькому гемоглобіні, варто прочитати уважно і запам'ятати.
Головне місце в ньому в ньому займають м'ясні субпродукти: печінка, нирки, язик.
Потім іде крупа гречана, квасоля, горох, шоколад, гриби білі, чорниці. У цих продуктах найбільша кількість заліза - більше 4 мг на 100 г продукту. Щоб підвищити гемоглобін, частіше включайте ці корисні продукти в свій раціон харчування.
Від 2 до 4 мг заліза містять яловичина, баранина, конина, м'ясо кролика, яйця, вівсяна крупа, пшоно, яблука, груші, хурма, айва, інжир, кизил, шпинат, горіхи.
Рекомендується при низькому гемоглобіні і вживання продуктів, що містять помірну кількість (1-1,9 мг) заліза. Це свинина, м'ясо курей, ковбаси варені, сосиски, сир, сардини, скумбрія, ставрида, оселедець, ікра риб, хліб з борошна вищого гатунку, крупа перлова, ячна, манна, рис, картопля, цибуля зелена, редис, буряк, щавель, кавун, диня, слива, гранат, черешня, полуниця, малина, смородина чорна. Але ці продукти так само корисно включати в раціон харчування при низькому гемоглобіні.
Мало заліза (0,4-0,9 мг) в рибі, меді, баклажанах, зеленому горошку, гарбузі, сливі, персиках, лимонах, винограді, абрикосах, вишні, агрус, журавлині. І ще менше - 0,1-0,3 мг заліза, можна отримати з молока й кефіру, сметани, сиру, апельсинів і мандаринів. Підвищити гемоглобін за допомогою цих продуктів вам не вдасться.
Але при низькому гемоглобіні мало включати в раціон харчування продукти, багаті залізом. Важливо знати, що продукти, багаті кальцієм, різко знижують засвоєння заліза. Тому, щоб підвищити гемоглобін в організмі хоча б на час краще відмовитися від молока і молочних продуктів. Якщо це неможливо, їжте залізо - і кальцієвмісні продукти в різний час.
Засвоєння заліза також знижують чай і кава, при низькому гемоглобіні їх не варто пити під час і після їжі. А ось вітамін С - ваш союзник, для того, щоб підвищити гемоглобін у крові пийте апельсиновий або томатний сік, додавайте в їжу свіжий сік лимона, капустяний розсіл, солодкий перець, цибулю і зелень.
Пшениця та інші злаки зв'язують залізо в кишечнику і перешкоджають його засвоєнню, тобто, при низькому гемоглобіні, м'ясо краще їсти без хліба, макаронів і каші, а як гарнір вибирати картоплю, зелений горошок, капусту, квасолю та інші овочі.
12
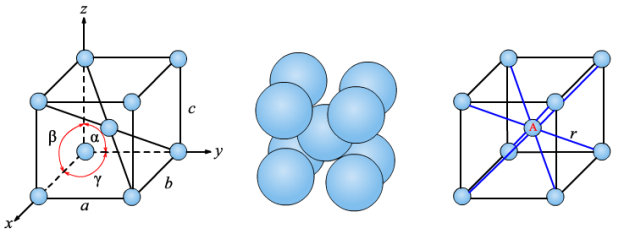
Фізичні властивості ( слайд 16) .
- Що називають властивостями речовини? (Ознаки, за якими одна речовина подібна до іншої, чи відрізняється від неї).
- Які види властивостей вам відомі? (Розрізняють властивості фізичні та хімічні). –
- Які властивості називають фізичними? (Властивості, які можна побачити неозброєним оком чи виміряти за допомогою приладів).
Розгляньте зразок металу заліза і вкажіть його фізичні властивості
користуючись алгоритмом :
Агрегатний стан ( тверда речовина );
Колір ( сріблясто – білого кольору або сірий метал
внаслідок швидкого окиснення на вологому
повітрі)
Запах ( без запаху)
Смак ( без смаку)
Металічний блиск ( добре виражений)
Відношення до води ( нерозчинний у воді)
Твердість ( м’який , досить ковкий)
Густина ( більша за воду 7,874г/см3)
Електропровідність ( добра )
Теплопровідність ( добра )
Температура плавлення 15390С , тугоплавкий з феромагнітними властивостями (легко намагнічується і розмагнічується .
..
13
Хімічні властивості.
Лабораторний дослід : Якісні реакції на йони Fе2+ , Fе3+
Залізо – метал середньої хімічної активності.
У найстійкіших сполуках Ферум виявляє ступені окиснення +2,+3,+6.
1. Повільно окиснюється на вологому повітрі (процес іржавіння). У разі нагрівання взаємодіє з багатьма неметалами (галогенами , киснем, сіркою, фосфором , вуглецем , силіцієм), водою: (слайд 17 , 18, 19, 20 )
2Fе + ЗС12=2FеС13
ЗFе + 2О2=Fе3О 4
Fе + S =FеS
При дуже високій температурі реагує з :
ЗFе + С = Fе3С
4 Fе + 3Si = Fe4Si3
3Fe + 2P = Fe3P4
2.Взаємодіє з водою після зняття оксидної плівки:
У розжареному стані (понад 7000С) взаємодіє з водою (водяною парою)
ЗFе + 4Н20 = Fе304+4Н2
Fе304 (залізна окалина) — змішаний оксид (FеО • Fе203), найстійкіша оксигеновмісна сполука Феруму.
3.Залізо витискує менш активні метали з розчинів їх солей: ( слайд 21)
Fе + СиS04 = FеS04 + Си ↓
4. Залізо розчинається в розбавлених кислотах: ( слайд 22)
Fе + 2НС1→ FеС12 + Н2 ↑(без доступу повітря).
Fe + H2SO4 (p) = FeSO4 + H2↑
При доступі повітря йде подальше окиснення:
4FеС12 + 4НС1 + 02 → 4FеС13 + 2Н20
5.Концентровані сульфатна і нітратна кислоти за кімнатної температури пасивують залізо. У разі взаємодії з розбавленою нітратною кислотою під час нагрівання утворюються сполуки Феруму(Ш), а в результаті дії дуже розбавленої — сполуки Феруму(П) ( слайд 23 ) :
Fе + 4НNO3 (роз6, гар) = Fе(N03)з + N0 ↑+ 2Н20
5Fе + 12НNO3 (дуже розб, t =10 0-С) = 5Fе(NO3)2 + N2 ↑+ 6Н20
Сполуки Феруму(ІІ) і Феруму(ІІІ): оксиди та гідроксиди,солі
Ферум утворює такі оксиди та гідроксиди:
FеО Fе304 Fе203
Fе(0Н)2 Fе(0Н)3
Посилюються окисні властивостi--------------------------→
14
Послаблюються основні властивостi --------------------→
Посилення кислотних властивостей сполук Феруму(ІІІ) порівняно із сполуками Феруму(І І) пояснюється збільшенням ковалентності зв’язку Fe –O та із підвищенням ступеня окиснення Феруму.
Добування. Ферум(І І) оксид одержують термічним розкладанням ферум(П) оксалату та ферум ( І І ) гідроксиду без доступу повітря:
FеС2О4 = Fе О + СО + СО2
Fе(ОН)2 = FеО + Н2О
Ферум(Ш) оксид утворюється внаслідок розкладання Fе(ОН)3 на повітрі:
2Fе(ОН)3 = Fе2О3 + ЗН2О
Fе3О4 можна одержати у разі нагрівання (800 °С) заліза з водяною парою, а також із Fе2О3:
ЗFе + 4Н2О(пара) = Fе3О4 + 4Н2
13000C
6Fе2О3 ------→ 4Fе3О4 + О2
Із наведених прикладів видно, що для добування оксидів Феруму використовують непрямі способи . Вони ж лежать і в основі одержання гідроксидів Феруму:
FеSО4 + 2КОН = Fе(ОН)2 ↓ + К2SО4 (в атмосфері N2)
Fе2(SО4)3 + 6КОН = 2Fе(ОН)3 ↓ + ЗК2SО4
Усі оксиди і гідроксиди Феруму нерозчинні у воді.
Хімічні властивості сполук Феруму .
Оксиди і гідроксиди Феруму обох ступенів окиснення мають амфотерні властивості. У сполук Феруму(ІІ) вони дуже слабко виражені , тому ферум(ІІ) оксид і ферум(ІІ) гідроксид виявляють переважно основні властивості:
FеО виявляє головним чином основні властивості , тому взаємодіє тільки з розчинами кислот:
FеО + Н2SО4 = FеSО4 + H2O
![]() Ферум(П) гідроксид виявляє , якщо він свіжодобутий і під час кип’ятіння , амфотерні властивості, але переважно основні:
Ферум(П) гідроксид виявляє , якщо він свіжодобутий і під час кип’ятіння , амфотерні властивості, але переважно основні:
Fе(ОН)2 + 2НС1(роз6) = FеС12 + 2Н20
Реагує з концентрованим розчином лугу утворюючи Натрій тетрагідроксиферат(ІІ):
Fе(ОН)2 +2NаОН(kon ω=50%) → Nа2[Fе(ОН)4]
Fе2О3 і Fе(ОН)3 — амфотерні сполуки, тому взаємодіють як з кислотами, так і лугами:
Fе2О3 + ЗН2SО4(роз6) = Fе2(SО4)3 + ЗН2О
Fе2О3 + 2NаОН —cnікания → 2NаFеО2 + Н2О
натрій метаферит(Ш)
Fе(ОН)3 + ЗНС1 = FеС13 + ЗН20
15
Fе(ОН)2 — сильний відновник , бо спроможний окиснюватися навіть на повітрі:
4Fе(ОН)2 + О2 + 2Н2О = 4Fе(ОН)3
Fе(ОН)3 виявляє окисно-відновні властивості лише за наявності сильних відновників або окисників:
2Fе(ОН)3 + ЗН2 = 2Fе + 6Н2О — окисні властивості
2Fе(ОН)3 + ЗВг2 + 10КОН = 2К2FеО4 + 6КВг + 8Н20
калій ферат(УІ)
Гідроксиди Феруму(ІІ) і (ІІІ) під час нагрівання розкладаються:
2Fe(OH)3 = Fe2O3 + 3H2O
Fe(OH)2 = FeO + H2O
Подвійний (змішаний) оксид під час взаємодії з кислотами утворює суміш двох солей – Феруму(ІІ) і Феруму(ІІІ):
Fe3O4 + 8HCl = 2FeCl3 + FeCl2 + 4H2O
Fe3O4 + 4H2SO4 = Fe2(SO4)3 + FeSO4 + 4H2O
Якісні реакції на йони Fе2+ , Fе3+ (слайд 25, 26)
Реакції йонів Fe2+
1. Амоній гідроксид з йонами Fе2+ без доступу повітря утворює
білий осад ферум(П) гідроксиду, який розчиняється в кислотах
і не розчиняється в лугах (за кімнатної температури):
FeSО4 + 2NН4ОН → Fе(ОН)2 ↓ + (NH4)2SО4
осад білого кольору.
2. Йони Fе2+ з червоною кров'яною сіллю К3[Fе(СN)6] утворюють
погано розчинну у воді сіль темно-синього кольору, яка має
назву «турнбулева синь»:
ЗFеSО4 + 2К3[Fе(СN)6] = Fе3[Fе(СN)6]2 ↓ + ЗК2SО4
червона турнбулева синь
кров'яна сіль
Розчини солей Феруму(П) забарвлені в блідо-зелений колір.
Реакції йонів Fe3+
1. Амоній гідроксид з йонами Fе3+ утворює червоно-бурий осад
ферум(Ш) гідроксиду, який розчиняється в кислотах:
FеС13 + 3NH4ОН → Fе(ОН)3 ↓ + ЗNН4С1
буро-червоний осад).
2.Йони Fе3+ із жовтою кров'яною сіллю утворюють осад
берлінської лазурі:
4FеС13 + ЗК4[Fе(СN)6] = Fе4[Fе(СN6]3 ↓ + 12КС1
жовта кров'яна сіль берлінська лазурь
3. Амоній роданід (тіоціанат) з йонами Fе3+ утворює розчин
криваво-червоного кольору:
FеС13 + ЗКSСМ = Fе(SСN)з + ЗКС1
16
Лабораторний дослід
Якісні реакції на виявлення йонів Fe2+ , Fe3+
Мета : провести якісні реакції на виявлення йонів Fe2+ , Fe3+ в розчині.
Обладнання : штатив з пробірками .
Реактиви : розчини ферум (ІІ) і ферум (ІІІ) сульфатів або хлоридів, розчини червоної та жовтої кров’яної солі, роданіду амонію.
Завдання : виконайте роботу і оформіть звіт , заповніть таблицю.
Правила техніки безпеки
- Робоче місце має бути звільнене від сторонніх речей.
- Перед початком досліду уважно читай етикетку , щоб правильно вибрати реактив.
3. Відкривши посудину з реактивом , потрібно класти пробку догори дном.
4.Надлишок взятого реактиву не можна зливати ( висипати ) назад у посуд; розчини кислот, лугів брати краплями ; тверді речовини чи розчини солей – щоб ледь покрили дно пробірки.
5.Реактив наливати за правилом , щоб розчин не потрапив на етикетку .
6.Посудину , з якої взяли реактив, слід відразу ж закрити пробкою і поставити на місце.
7.Жодні реактиви не можна пробувати на смак.
8.Після роботи відпрацьовані реактиви можна зливати у раковину тільки після їх повної нейтралізації .
9.Після роботи вимийте посуд, приберіть робоче місце , ретельно вимийте руки.
10.У разі потрапляння їдких речовин на руки чи одяг негайно змийте їх великою кількістю води , нейтралізуйте та знову змийте водою.
11.Категорично забороняється проводити досліди , не зазначені в роботі , та самостійно зливати і змішувати реактиви.
17
|
Хід роботи
|
Спостереження, рівняння реакції |
|
1. Реакція Fe2+ з червоною кров’яною сіллю . Налийте в пробірку 0,5мл розчину солі ферум сульфату, долийте кілька крапель розчину червоної кров’яної солі.
|
Спостереження : __________________________ __________________________________________ Рівняння хімічної реакції в молекулярній , повній та скороченій йонній формах : _________________________________________ ___________________________________________ ___________________________________________ |
|
2. Реакція Fe3+ з жовтою кров’яною сіллю . Налийте в пробірку 0,5мл розчину солі ферум (ІІІ) хлориду, долийте кілька крапель розчину жовтої кров’яної солі.
|
Спостереження : __________________________ __________________________________________ Рівняння хімічної реакції в молекулярній , повній та скороченій йонній формах : _________________________________________ ___________________________________________ ___________________________________________ |
|
3. Реакція Fe3+ з амоній роданідом . Налийте в пробірку 0,5мл розчину солі ферум (ІІІ) хлориду, долийте кілька крапель розчину амоній роданіду
|
Спостереження : __________________________ __________________________________________ Рівняння хімічної реакції в молекулярній , повній та скороченій йонній формах : _________________________________________ ___________________________________________ ___________________________________________ |
Зробіть висновок :
Йони Fe2+ , Fe3+ в розчині виявляють шляхом проведення відповідної якісної реакції .
Якісною реакцією на йони Fe2+ є ____________________________________________________________________________________________________________________________________
Якісною реакцією на йони Fe3+ є ______________________________________________________________________________________________________________________________________________________________________________________________________
Прізвище студента :
18
Властивості солей.
Солі Феруму(ІІ) і сильних кислот добре розчиняються у воді та кристалізуються з розчину у вигляді кристалогідратів FеС12 • 6Н2О,
FеSО4 • 7Н20. До нерозчинних у воді належать солі слабких кислот: FеСО3, FеS2.
Солі Феруму(II) досить легко окиснюються до сполук Феруму(Ш) киснем повітря та різними окисниками як у розчині, так і в кристалічному стані:
4FеSО4 + О2 + 2Н2О = 4Fе(ОН)SО4
2FеSО4 + 2HNО3(КОНЦ) + Н2SО4(КОНЦ) = Fе2(SО4)3 + 2NO2 ↑ + 2Н2О
Усі солі Феруму(Ш) у водному розчині гідролізуються з утворенням основних солей або ферум(Ш) гідроксиду, тому їх розчини набувають бурого забарвлення:
Fе2(SО4)3 + 2Н2О = 2Fе(ОН)SО4 + Н2SО4
Са(FеО2)2 + 4Н2О = Са(ОН)2 + 2Fе(ОН)3↓
кальцій метаферит(Ш)
Солі Феруму(Ш) за наявності відновників виявляють властивості окисників і відновлюються до солей Феруму(П):
2FеС13 + Н2S → 2FеС12 + S + 2НС1
Застосування заліза та його сплавів у техніці ( слайд 27 )
Чому залізо називають великим трудівником та творцем прекрасного ?
Повідмлення
Чисте залізо використовують як матеріал для виготовлення осердь електромагнітів та якорів електромашин, пластин акумуляторів. Залізні порошки застосовують для виготовлення металокерамічних виробів — підшипників сковзання, як каталізатор. Препарати заліза застосовують як лікарський засіб проти анемії. Але найчастіше в техніці і повсякденному житті мають справу не з чистим залізом, а з його сплавами: чавуном і сталлю. Чавун з великою масовою часткою кремнію є кислототривким, а зі значною масовою часткою мангану — дуже твердим. Звичайний сірий чавун виявляється досить крихким під час деформації розтягуванням, через те що містить графіт у вигляді пластинок. У результаті введення до нього мангану графіт у чавуні набуває сферичної форми і внаслідок цього високої міцності. З такого чавуну відливають труби, ґрати для мостів, деталі машин і хімічної апаратури.
Чудова властивість заліза—утворювати сплави з різними елементами і при цьому проявляти нові якості — широко використовується в сучасній техніці .. Відомо більш 8 тисяч сплавів, обробка яких дає десятки тисяч марок сталей. Створені самі дивовижні марки сталі:
- «Дерев’яна» сталь — називається вона так , тому що вона по теплопровідності нагадує дерево.
- «Алмазная» сталь має твердість, близьку до алмазу.
- «Тиха» сталь — з неї виготовляють станки, локомотивьи, прилади. Деталі з неї створюють менше шума.
- Деталі з «м’ягкої» сталі легко обробляються.
- «Прозора » крім прозорості поглинає шуми.
19
- Із заліза виготовляють листи для письма. 2000 таких листочків мають товщину всього 2,54 см.Звичайно , на них не пишуть листи, а використовують в машино- і приладобудуванні , радіотехніці.
- «Булат» — знаменита сталь. Індія є батьківщиною булату. Секрет її виготовлення був втрачений. . Что ж таке булат: залізо і вуглець, а також особливий метод охолодження. Це поєднання двух несумісних властивостей —високоїкой міцності і пластичності..
Широке застосування в машинобудуванні, транспорті й будівництві знайшли спеціальні, або так звані леговані сталі. До їх складу, крім заліза, можуть входити хром, нікель, вольфрам, молібден, ванадій, кобальт, титан та інші метали. Введення певного металу до заліза надає сталі необхідних властивостей. Так, хром підвищує твердість сталі та її корозійну стійкість, нікель збільшує в'язкість, вольфрам сильно підвищує твердість, ванадій (0,2-0,5%) — в'язкість і твердість, молібден підвищує пружність і покращує зварюваність. Леговані сталі застосовують для виготовлення різальних і вимірювальних інструментів, штампів, деталей машин і конструкцій .
.Вироби тульських ковалів виготовленні з сталі —цінувались нарівні з ювелірньими прикрасами : зеленою і фіолетовою, чорной і рожевою , матовою і блискучою як алмаз, стає сталь у вправних руках.
Діамант — царя каменів, можно одержати не тілько з алмазу, але і з сталі. Використання ограненого металу в прикрасах —давно відомий прийом.. При нагріванні сталі до 200°—300° на поверхні утворюється кольорова плівка , яка надає металу декоративного вигляду . Опираючись на тенденції сучасного мистецтва , вважали що в найближчий час стануть самими модними прикраси з нержавіючої сталі. Вона дуже гарна у відполірованому вигляді . Її холодний блиск нагадує античну поліровку . Тому я теж вважаю , що залізо не тільки великий трудівник , але і творець прекрасного .
(Слайд 28)
Я хочу розповісти про незвичайну музику – музику , що застигла в металі- про чудові художні вироби з чавуна, сталі і заліза.
Пригадуєте Пушкінськи строки?
«Твоих оград узор чугунный,
Полнощных стран краса и диво».
Санкт-Петербург славиться решітками мостів та набережних.
Санкт-Петербург славится решетками мостов и набережних, литих чавунних і залізних . Саме їх оспівував поет. « Чавунне кружево» має довжину 10830м, а залізне – 53579м.
Огорожа літнього саду по праву вважається самою кращою серед декоративних огорож. Дивна гармонійність цього , ніби повислого в повітрі чавунного кружева з списів, подовжених прямокутників та ліпних розеток.
Я вважаю , що залізо в поєднанні з іншими елементами сприяє естетичному розвитку людства.
20
( слайд 29)
Памятник —це признання заслуг, захоплення. Так можна сказати можно про символ Парижу — Ейфелеву башню — граціозну споруду інженера Ейфеля, у вигляді металевої сталевої башти висотою 300 м, а зараз з надбудовою 326 м. На її спорудження витратили 18038 деталей, 1 млн заклепок. Маса її 7500 тон. Щоб потрапити на оглядову площадку на висоті 190 м, потрібно подолати 1792 східців. . Це радіо і телецентр, бари, концертні зали. Якщо поставити в один ряд всіх, кто відвідав «старую даму», як назвали її парижани, то вони створили б чергу довжиною 25000 км.
Знаменита будова інженера Густава Ейфеля і зараз одна з видатних споруд які прославляють залізо ,як будівельний матеріал.
У 1967 г. висотну першість зайняла заняла незвичайної конструкції Останкінська голка , висота якої 533м, а маса більше 32000тон.
Ці споруди створили як знак вдячності людини металу-трудівнику.
(слайд 30 )
« Человека губит горе, железо портит влага » це турецька поговорка.
Дійсно властивість заліза кородувати - великий недолік, залізо кородує внаслідок дії навколишнього середовища . Але справа не тільки в цьому. Більш важливий той факт ,що абсолютно чисте залізо не кородує , а починається корозія під впливом домішок. . Доказом цього є велика залізна колонна в Делі, що ставить в тупик сучасних вчених, які не можуть відповісти , чому на неї не впливає навколишнє середовище. Колонна була споружена в 415 році, , її вага 6,5 тон, висота більше 7 м, виготовлена майже з чистого заліза 99,72% Fе.
Як ви розумієте приказку « Де кров – там і залізо ?»
В історії людства є немало сторінок , написаних і политих кров’ю із-за заліза.Адже залізо — це війна, смерть, розруха .Спис і щит — характерне знаряддя бога війни— Марса, стародавні мудреці зробили символом, позначаючим Залізо.
Воно дійсно вірно и безвідмовно було на службі у Марса .
Характеристикою такой служби може бути витрата заліза в роки минулих великих війн . Так під час 1-й світової війни тільки одна Німеччина в боєприпасах, бомбах і інших виробах викидала до 10 млн тонн металу в рік.. Сотні тисяч тон заліза, добутого з мільйонів тон руд і перетворених в різні боєприпаси, були розсіяні смертоносними осколками на полях війни . Великої вітчизняної війні в 1941—1945 г.
Щоб судити про масштаби втрат заліза в боях ВВв достатньо привести деякі втрати немецько-фашистської армії в 1943 г. в період з 5 липня по
5 листопада : кулеметів — 74.460, танків — 17.700 и т.д. Сотни тисяч, мільйони тон заліза слугували руйнуванню та смерті.
21
Які українські прізвища , на вашу думку , мають відношення до заліза ?
В давнину коваль, він же , он же металург, добував залізо і перетворював його в різні вироби..
Людей вражало те , що, коваль робив цінні речі з куска якогось – бурого каменя. Тому вважали коваля «віщою людиною », майже чарівником. .
Цікаво відмітити , що , єдиним робітником серед богів різних релігій був бог-коваль . Заглянемо в « особову справу » найбільш відомого з цих богів — Гефеста, сина Зевса и Гери . З допомогою могучих помічників циклопів, Гефест кував блискавиці для громовержця Зевса, побудував на Олімпе палац для богів, колісниці для сонячного бога — Геліоса. І ось одного разу титан Прометей викрав у у Гефеста вогняне ремесло коваля і передав його людині .
Життя людей набагато стало легшим , але Прометей був наказаний.
Про престиж цієї професії , пов’язаної з залізом , говорить той факт , що поширені прізвища, в Росії — Кузнєцов, а на Україні — Коваль, Ковалев, Ковальчук.
V. Узагальнення вивченого.
Це метал , іменем якого названа ціла епоха в історії людства. Епоха , яка продовжується багато тисячоліть .Залізо – фундамент цивілізації , основа економічної могутності держави. Про перспективи застосування заліза і сплавів на його основі краще всього сказав академік Ферсман : « Майбутнє за іншими металами, а залізу буде відведено почесне місце старого , заслуженого металу. Але до цього майбутнього ще далеко.
Залізо покищо - основа металургії , машинобудування, шляхів сполучення, суднобудування, мостів, транспорту. Епоха заліза продовжується і буде продовжуватись дуже довго. В сучасному світі заліза добувають у 20 разів більше , ніж всіх інших металів, разом взятих »
Ні залізо , ні будь- який інший метал не можуть принести зла людству , без злої волі самої людини, залізо , насамперед , метал і він великий трудівник. Його без перебільшень називають головним металом цивілізації
22
Картки-завдання з теми «Ферум та його сполуки»
Приготуйте усні відповіді на такі запитання:
- Якою є будова атома заліза?
- Якою є поширеність заліза в природі?
- Як одержують залізо з його руд? Вкажіть види залізних руд.
- Опишіть фізичні властивості заліза
- Допишіть хімічні реакції, розставте в них коефіцієнти:
1. Fe + Cl2 =… 2. Fe + Br2 =…
6). Розставте коефіцієнти в рівняннях реакцій:
1. Fe + О2 =Fe3 О4
2. Fe + НСl =FeСl 3 + Н2
3. Fe2 О3 + Аl =Аl2 О3 + Fe
7). Обчисліть масову частку Феруму в його оксидах: FeО, Fe2О3, Fe3О4 .
8). Закінчити речення очікувань:
1. Я знаю, що Ферум у періодичній системі розташований у ______ періоді, ________групі ________________ підгрупи.
2. Я знаю, що валентність Феруму _________, може бути _________ та ________.
3. Я знаю, що Ферум утворює _____ просту речовину - _______________ .
4. Я знаю, що відносна атомна маса Феруму та відносна молекулярна маса заліза чисельно співпадають і дорівнюють _________________ .
5. Я знаю, що за агрегатним станом залізо __________ речовина, яка не має __________, __________ та __________ .
6. Я знаю, що залізо _________ у воді, добре проводить _________ та ______
22
7. Я знаю, що залізо притягується _________ .
8. Я знаю, що залізо – хімічно ___ речовина, реагує з простими речовинами, такими як: __________ та __________.
9)Напишіть рівняння реакцій, за допомогою яких
можна здійснити такі перетворення:
Fе → FеС12 → Fе(ОН)2 →Fе(ОН)3 →Fe2O3→ Fe → FeS
Які з цих реакцій та чому є окисно-відновними?
10). За схемами складіть рівняння практично здійснимих реакцій:
а) СиС12(розч.)+Fе→
б) Fе + Н2О →
в) МgSО4 (розч.)+ Fе →
г) Fе+Н2SО4(конц.) →
д) FеС12(розч.)+ КОН(розч.)→
е) Fе(ОН)2+НС1 →.
23
11) Розгляньте мал. 1 та дайте відповіді на запитання.
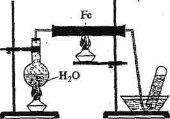
- Яку хімічну реакцію проводять у приладі, зображеному на малюнку ? Напишіть рівняння цієї реакції.
- Які зміни відбудуться із залізом всередині залізної трубки?
- Яким газом заповнюється пробірка?
- Укажіть ще один-два метали, які аналогічно залізу можуть взаємодіяти з водою за подібних умов. Напишіть рівняння реакцій.
12) Складіть формули оксидів, гідроксидів і хлоридів Феруму, в яких він виявляє ступінь окиснення +2, +3. Чи можна перетворити ферум(ІІ) оксид на ферум(Ш) хлорид та навпаки? Чому?
13) Розв'яжіть задачу.
Суміш заліза та залізної окалини (Fе3О4) масою 32 г обробили надлишком хлоридної кислоти. При цьому виділилося 5,6 л водню. Обчисліть масову частку заліза та залізної окалини у вихідній суміші.
.
Додаткові завдання
- Як із заліза можна одержати ферум(ІІ) гідроксид та ферум(Ш) гідроксид? Напишіть рівняння відповідних реакцій.
- Напишіть рівняння реакцій, що дозволяють здійснити такі перетворення:
FеО → Fе → FеSО4 → FеС12
3. Маємо суміш ферум(ІІ) хлориду та алюміній(Ш) хлориду. її розчинили у воді й до одержаного розчину додали надлишок розчину натрій гідроксиду, а осад, що з'явився, відфільтрували. Що міститься в осаді, а що — в розчині? Напишіть рівняння реакцій.
4. Ферум(Н) сульфат слід очистити від домішок купрум(ІІ) сульфату. Складіть план роботи та запишіть рівняння реакцій.
5.Яку масу заліза можна відновити за допомогою. алюмінотермічного способу з 1 кг ферум(Ш) оксиду, що містить 8 % домішок?
6.Гра «хрестики-нолики».
Визначте виграшні шляхи на схемах, якщо:
а) це хімічні сполуки, що входять до складу залізних руд;
б) це складні речовини, що належать до одного класу.
24
|
Fе(ОН)2 |
FеS04 |
FеС03 |
|
FеS |
FеС12 |
Fе203 |
|
FеО |
Fе(ОН)3 |
Fе304 |
|
FеО |
Fе(ОН)3 |
FеВг2 |
|
FеS04 |
Fе304 |
Fе3С |
|
Fе(ОН)2 |
FеS |
Fе203 |
. Розв'яжіть кросворд «Метали».
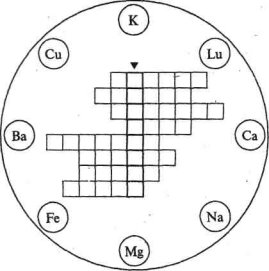
У восьми колах зображені знаки хімічних елементів-металів. Розташуйте їх назви по горизонталі у клітинках таким чином, щоб у вертикальному стовпчику, виділеному жирними лініями, можна було прочитати назву найпоширенішого металу на Землі.
Схему кросворда перекресліть у зошити.
VІ. Домашнє завдання
1. Опрацювати матеріал підручника § 22 ст. 163-167, конспект уроку.
2. Виконати завдання.
3.Дати відповідь на питання :
1.) Чому в світовій енциклопедичній літературі залізо названо великим трудівником?
2) Чим небезпечний „Залізний голод? ”
25
ІІ. Чи знаєте ви, що…
… людство протягом року використовує близько 500 тонн заліза.
... в організмі дорослої людини міститься 4 г заліза. Залізо входить до складу гемоглобіну крові (75%). Багато заліза міститься в печінці, селезінці, кістковому мозку. Чимало його і в протоплазмі, де за його участі здійснюється процес внутрішнього дихання. Жіночий організм потребує удвічі більше заліза, ніж чоловічий , якому на добу потрібно лише 5 г заліза (жіночому, відповідно, - 10 г);
…. у земній корі Місяця , в місячних породах поширене залізо двовалентне тому що на Місяці відсутні вода й кисень. У земній корі поширене трьохвалентне залізо;
... у Франції на честь 100-річчя французької революції в 1889 р. за проектом Густава Ейфеля було побудовано відому вежу . Її будували протягом двох років, двох місяців і двох днів. її висота - 326 м, маса металевої частини - 7 тис. тонн. На неї було витрачено 1 050 846 залізних заклепок ;
…означає вираз: “Метал, який принесли в жертву Рудому дияволу”?
(Залізо, а також сталі, що перетворюються на іржу при корозії)
… що морську воду називають “рідкою залізною рудою”?
(Якщо вилучити все залізо, розчинене в морській воді, то його буде стільки, що на кожного жителя планети припадатиме по 35 тонн, у той час як протягом всього існування людства його було вироблено стільки, що на кожну сучасну людину припадає лише по 6 тонн)
… російський металург Аносов розкрив таємницю булату .
… надмірна доза заліза (200 мг і вище) може виявляти токсичну дію. Передозування заліза пригнічує антиоксидантну систему організму, тому вживати препарати заліза здоровим людям не рекомендується.
…неорганічні сполуки заліза зустрічається в деяких бактеріях, іноді використовується ними для зв'язування азоту повітря.
…вміст заліза у воді більше 1-2 мг / л значно погіршує її органолептичні властивості, надаючи їй неприємний в'язкий смак, і робить воду малопридатною для використання, викликає у людини алергічні реакції, може стати причиною хвороби крові і печінки (гемохроматоз). ГДК заліза у воді 0,3 мг / л.
26
Використана література
1 Хімічна енциклопедія: у 5 т. / Редкол.: Кнунянц І. Л. (гл. ред.) - М .: Радянська енциклопедія, 1990. - Т. 2. - С. 140. - 671 с. - 100000 прим .
2. Карапетьянц М. Х. Х., Дракіно С. І. Загальна та неорганічна хімія: Підручник для вузів. - 4-е изд., Стер. - М.: Хімія, 2000, ISBN 5-7245-1130-4, с. 529
3. М. Фасмер Етимологічний словник російської мови, т.2. - "Прогрес". - 1986. - С. 42-43.
4.Ю. М. Широков, Н. П. Юдін. Ядерна фізика. М.: Наука, 1972. Глава Ядерна космофізика.
5.Р. Ріпан, І. Четяну Неорганічна хімія / / Хімія неметалів = Chimia metalelor - Москва: "Світ", 1972. - Т. 2. - С. 482-483. - 871 с.
6. Металознавство і термічна обробка сталі. Справ. вид. У 3-х т. / Под ред. М. Л. Берштейна, А. Г. Рахштадта - 4-е изд., Перераб. і доп. Т. 2. Основи термічної обробки. У 2-х кн. Кн. 1. М.: Металургія, 1995. 336 с.
7. Н.А.Мезенцев Занимательно о железе. Москва «Металлургия» , 1985, 175ст.
8.А.М.Бутенко «Хімія» 10кл. Харків, « Гімназія» , 2011.320ст.
1).Які фізичні властивості характерні для заліза?
2) При розкладі 18 г гідроксиду металу (ІІ) утворилося 14,4 г оксиду металу (ІІ). Визначте, про який метал ідеться.
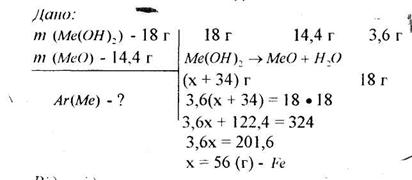
Відповідь: залізо.
2) Складіть електронну конфігурацію хімічного елемента № 26. Які властивості він має? Спрогнозуйте можливі валентності цього елемента.
3.) відновлення оксидів воднем, визначте окисник та відновник:
FeO +H2 →
Fe3O4 + H2 →
Fe2O3 + H2→
4.) відновлення Феруму з його оксидів метало термічним способом:
FeO +AI →
Fe3O4 + AI →
Fe2O3 + AI
5.) відновлення Феруму за допомогою карбон (ІІ) оксиду:
Fe2O3 → Fe3O4 → FeO → Fe
6). Виконайте запропоновані перетворення :
Fe → Fe3+ → Fe → Fe2+ → Fe(OH)2 → FeO
Fe → FeCI3 →Fe(OH)3 →Fe2(SO4)3 → FeCI3 → Fe(OH)3
Fe(NO3)3 →Fe(OH)3 → Fe2O3 → Fe → FeCI3
Fe → FeO → FeCI2 → Fe(OH)2
Fe → FeSO4 →Fe(OH)2 → Fe(OH)2
Fe → FeCI2 → Fe(OH)2 → FeO
Fe → Fе(NO3)3 → Fe(OH)3 → Fe2O3
7). Яка роль заліза в організмі людини?
8). Чому концентровану H2 SO4 перевозять у сталевих цистернах? Складіть рівняння реагування заліза з концентрованою H2 SO4 при нагріванні.
9). У трьох пробірках міститься солі:
FeCI3 , FeCI2 , AICI3
Визначте їх. Напишіть рівняння хімічних реакцій у повній та скороченій йонній формах.
10).Яким чином, маючи лише кристалічний ферум (ІІІ) сульфат, воду, натрій металічний, спиртівку, одержати залізо?
11). Залізо масою 14 г спалили із сіркою масою 4,8 г. До одержаної суміші речовин додали надлишок хлоридної кислоти. Які гази при цьому утворилися? Визначте об’єм цих газів, виміряних за н. у.
12). Зразок оксиду феруму масою 32 г відновили до металу карбон (ІІ) оксидом. Визначте формулу оксиду, якщо об’єм карбон (ІІ) оксиду, що прореагував, становить 13,44 л.
14).У двох пробірках містяться розчини солей Феруму (ІІ) і (ІІІ). Як їх
визначити? Напишіть відповідні рівняння реакцій в молекулярній та йонній формах.
15.. Напишіть рівняння реакцій між концентрованою та розбавленою нітратною кислотою та залізом.
16). Зобразіть схематично будову атома Феруму та йонів Fe2+ та Fe3+.
17).Який газ і в якому об’ємі (н. у) утвориться при спалюванні піриту масою 40 г, що містить 12% домішок?
18). Які властивості проявляють ферум (ІІ) та ферум (ІІІ) гідроксиді. Напишіть відповідні рівняння реакцій.
Запам’ятайте!
1) При взаємодії з киснем утворюється змішаний оксид:
ЗFе + 202=Fе304
2) При взаємодії з галогенами Fe проявляє ступінь окислення +3:
2Fе + ЗС12=2FеС13
3) При взаємодії з водою:
ЗFе + 4Н20 = Fе304+4Н2
4) При взаємодії з кислотами:
За н. у. Fe пасивує взаємодію з концентрованою кислотою H2SO4 та HNO3, оскільки утворюється міцна оксидна плівка.
5). Сполука Fe (OH) 3 має амфотерний характер
FeCI3 + 3КОН = Fe(OH)3 ↓ + 3Н2О
Fe(OH)3 ↓ + 3НСІ = FeCI3 + 3Н2О
Fe(OH)3 ↓ + NаОН = Na [ Fe(OH)4]
19).(3 бали). Розв’яжіть розрахункові задачі на знаходження формул хімічних сполук.
Варіант І. Масові частки Феруму й Оксигену в природному мінералі становить відповідно 72,36% і 27,64%. Знайдіть формулу мінералу і назвіть його.
Варіант ІІ. Масові частки Феруму та Оксигену в природному мінералі становить відповідно 69,9% і 30,1%. Знайдіть хімічну формулу мінералу і назвіть його.
Варіант ІІІ. Масова частка кристалізаційної води у кристалогідраті Ферум (ІІІ) хлориду становить 39,92%. Знайдіть формулу кристалогідрату.
Варіант IV. Масова частка Феруму в природному мінералі піриті становить 46,67%. Крім Феруму, до складу піриту входить Сульфур. Визначте формулу піриту.
Варіант V. Хромовий залізняк містить хром (ІІІ) оксид і ферум (ІІ) оксид. Масова частка останнього в мінералі становить 32,14%. Визначте формулу мінералу.
Варіант VI. Масова частка Хлору в хлориді тривалентного металу становить 65,5%. Який це метал? Напишіть формулу хлориду.
20). (4 бали). Розв’яжіть експериментально-розрахункові задачі.
Варіант І. Маючи ферум (ІІ) хлорид, одержіть ферум (ІІ) гідроксид. Обчисліть масу ферум (ІІ) гідроксиду, якщо в реакцію вступив ферум (ІІ) хлорид масою 1,27 г.
Варіант ІІ. Маючи ферум (ІІІ) сульфат, одержіть ферум (ІІІ) хлорид. Яка маса осаду, якщо в реакцію вступив ферум (ІІІ) сульфат масою 2 г?
Варіант ІІІ. Маючи ферум (ІІІ) оксид, одержіть ферум (ІІІ) хлорид. Яка маса солі утвориться, якщо в реакцію вступив ферум (ІІІ) оксид масою 1,6 г?
Варіант IV. Маючи ферум (ІІІ) оксид, одержіть ферум (ІІІ) нітрат. Яка маса солі утвориться, якщо в реакцію вступив ферум (ІІІ) оксид масою 0,8 г?
Варіант V. Маючи ферум (ІІ) гідроксид, одержіть ферум (ІІ) сульфат. Яка маса сульфатної кислоти витратиться, якщо в реакцію вступив ферум (ІІ) гідроксид масою 0,9 г?
Варіант VI. Маючи ферум (ІІ) сульфат, одержіть ферум (ІІІ) гідроксид. Яка маса натрій гідроксиду витратиться, якщо прореагував ферум (ІІ) сульфат масою 1,52 г?
Завдання 5. Розв’яжіть експериментальні задачі.
Варіант І. Маючи необхідні реактиви та обладнання, одержіть ферум (ІІ) хлорид.
Доведіть експериментально, що до оксиду одержаної солі входять катіони Феруму (ІІ) та хлорид-аніони. Опишіть спостереження. Напишіть рівняння реакцій.
Варіант ІІ. Маючи необхідні реактиви й обладнання, одержіть ферум (ІІ) сульфат.
Доведіть експериментально, що до цієї солі входять катіони Феруму (ІІ) та сульфат-аніони. Опишіть свої спостереження. Напишіть рівняння реакцій.
Варіант ІІІ. Маючи необхідні реактиви й обладнання, одержіть ферум (ІІІ) хлорид.
Доведіть експериментально, що до складу одержаної солі входять катіони Феруму (ІІІ) та хлорид-аніони. Опишіть спостереження. Напишіть рівняння реакцій.
Варіант IV. Маючи необхідні реактиви й обладнання, одержіть ферум (ІІІ) сульфат.
Доведіть експериментально, що до складу цієї солі входять катіони Феруму (ІІІ) та сульфат-аніони. Опишіть спостереження. Напишіть рівняння реакцій.
Варіант V. Одержіть реакцію обміну ферум (ІІ) гідроксид.
Одержаний осад розлийте у дві пробірки. Одну залишіть на деякий час на повітрі. До другої долийте розчин кислоти. Опишіть спостереження. Напишіть рівняння реакцій.
Варіант VI. Одержіть реакцію обміну ферум (ІІІ) гідроксид.
Одержаний осад розлийте у дві пробірки. До однієї долийте розчин кислоти. Вміст другої пробірки перелийте до розчину лугу. Опишіть спостереження. Напишіть рівняння реакцій.
- Охарактеризуйте фізичні властивості заліза.
- З якими з перелічених речовин реагує залізо: хлор, сірка, вода, сульфатна кислота, натрій гідроксид, калій хлорид, купрум(ІІ) сульфат? Напишіть рівняння можливих реакцій, схематично позначте перехід електронів.
- Напишіть рівняння реакцій взаємодії заліза з хлором, з хлоридною кислотою, з киснем, із сіркою. Схематично позначте перехід електронів. Порівняйте, у яких випадках залізо окислюється глибше. Чому?
- Обчисліть масу ферум(ІІІ) оксиду, який потрібен для одержання заліза масою 1 кг.
- Обчисліть масу залізної окалини Ре304, що утворюється під час згоряння порції порошку заліза масою 28 г.
6/Порцію суміші порошків заліза, цинку та алюмінію масою 24 г розчинили в розбавленому розчині сульфатної кислоти. У результаті утворився газ об'ємом 13,44 дм3 (н. у.). Якщо розчинити таку саму порцію суміші в розчині калій гідроксиду, виділяється 11,2 дм3 (н. у.) газу. Обчисліть масові частки металів у суміші.
- Охарактеризуйте фізичні та хімічні властивості заліза.
- Напишіть рівняння реакцій, за допомогою яких можна здійснити ланцюжок перетворень речовин:
а) залізо -> ферум(ІІ) хлорид -» ферум(ІІ) гідроксид -> ферум(ІІІ)
гідроксид -> ферум(ІІІ) оксид -> залізо;
б) залізо -» ферум(ІІІ) хлорид -> ферум(ІІІ) гідроксид ->
ферум(ІІІ) оксид -» залізо -> триферум карбід.
- У результаті обробки сталевих ошурок масою 9,375 г зібрали карбон(ІУ) оксид об'ємом 280 см3 (н. у.). Визначте масову частку вуглецю в сталі.
- Порцію суміші порошків заліза й міді масою 12 г розчинили в хлоридній кислоті. У результаті угворився газ об'ємом 2,24 дм3 (н. у.). Обчисліть масові частки металів у суміші.
- Порцію суміші порошків заліза, міді та алюмінію масою 30,5 г розчинили в хлоридній кислоті. У результаті утворився газ об'ємом 19,04 дм3 (н. у.). Якщо розчинити таку саму порцію суміші в розчині натрій гідроксиду, то виділиться 16,8 дм3 (н. у.) газу. Обчисліть масові частки металів у суміші.
- Порцію суміші порошків заліза, цинку і алюмінію масою 24 г розчинили в розбавленому розчині сульфатної кислоти. У результаті утворився газ об'ємом 13,44дм3(н.у.). Якщо розчинити таку саму порцію суміші в розчині калій гідроксиду, то виділиться 11,2 дм3 (н. у.) газу. Обчисліть масові частки металів у суміші.
- Для боротьби зі шкідниками садовихдерев застосовують розчин мідного купоросу СиS04 • 5Н20. Чи можна готувати розчин мідного купоросу в залізному відеркові? Відповідь підтвердіть рівнянням реакції.
ІІ. Чи знаєте ви, що…
… людство протягом року використовує близько 500 тонн заліза.
... в організмі дорослої людини міститься 4 г заліза. Залізо входить до складу гемоглобіну крові (75%). Багато заліза міститься в печінці, селезінці, кістковому мозку. Чимало його і в протоплазмі, де за його участі здійснюється процес внутрішнього дихання. Жіночий організм потребує удвічі більше заліза, ніж чоловічий , якому на добу потрібно лише 5 г заліза (жіночому, відповідно, - 10 г);
…. у земній корі Місяця , в місячних породах поширене залізо двовалентне тому що на Місяці відсутні вода й кисень. У земній корі поширене трьохвалентне залізо;
... у Франції на честь 100-річчя французької революції в 1889 р. за проектом Густава Ейфеля було побудовано відому вежу . Її будували протягом двох років, двох місяців і двох днів. її висота - 326 м, маса металевої частини - 7 тис. тонн. На неї було витрачено 1 050 846 залізних заклепок ;
…означає вираз: “Метал, який принесли в жертву Рудому дияволу”?
(Залізо, а також сталі, що перетворюються на іржу при корозії)
… що морську воду називають “рідкою залізною рудою”?
(Якщо вилучити все залізо, розчинене в морській воді, то його буде стільки, що на кожного жителя планети припадатиме по 35 тонн, у той час як протягом всього існування людства його було вироблено стільки, що на кожну сучасну людину припадає лише по 6 тонн)
… російський металург Аносов розкрив таємницю булату .
… надмірна доза заліза (200 мг і вище) може виявляти токсичну дію. Передозування заліза пригнічує антиоксидантну систему організму, тому вживати препарати заліза здоровим людям не рекомендується.
…неорганічні сполуки заліза зустрічається в деяких бактеріях, іноді використовується ними для зв'язування азоту повітря.
…вміст заліза у воді більше 1-2 мг / л значно погіршує її органолептичні властивості, надаючи їй неприємний в'язкий смак, і робить воду малопридатною для використання, викликає у людини алергічні реакції, може стати причиною хвороби крові і печінки (гемохроматоз). ГДК заліза у воді 0,3 мг / л.
Використана література
1 Хімічна енциклопедія: у 5 т. / Редкол.: Кнунянц І. Л. (гл. ред.) - М .: Радянська енциклопедія, 1990. - Т. 2. - С. 140. - 671 с. - 100000 прим .
2. Карапетьянц М. Х. Х., Дракіно С. І. Загальна та неорганічна хімія: Підручник для вузів. - 4-е изд., Стер. - М.: Хімія, 2000, ISBN 5-7245-1130-4, с. 529
3. М. Фасмер Етимологічний словник російської мови, т.2. - "Прогрес". - 1986. - С. 42-43.
4.Ю. М. Широков, Н. П. Юдін. Ядерна фізика. М.: Наука, 1972. Глава Ядерна космофізика.
5.Р. Ріпан, І. Четяну Неорганічна хімія / / Хімія неметалів = Chimia metalelor - Москва: "Світ", 1972. - Т. 2. - С. 482-483. - 871 с.
6. Металознавство і термічна обробка сталі. Справ. вид. У 3-х т. / Под ред. М. Л. Берштейна, А. Г. Рахштадта - 4-е изд., Перераб. і доп. Т. 2. Основи термічної обробки. У 2-х кн. Кн. 1. М.: Металургія, 1995. 336 с.
7. Н.А.Мезенцев Занимательно о железе. Москва «Металлургия» , 1985, 175ст.
8.А.М.Бутенко «Хімія» 10кл. Харків, « Гімназія» , 2011.320ст.
Среди металлов самый главный,
Важнейший, древний элемент,
В тяжелой индустрии главный,
Знаком с ним школьник и студент
Родился в огненной стихии,
Расплав его течет рекой.
Важнее нет в металургии,
Он нужен всей стране родной
(Залізо)
IV. Повідомлення
Вальтер Скотт у своєму романі "Талісман" розповідає про змагання у спритності між султаном Саладіном та Ричардом Левове Серце. Під час змагання Ричард мечем розрубав на дві частини спис одного з лицарів. Усі бачили величезну міцність сталі та величезну силу вдарів короля. У відповідь Саладін підкинув у повітря тонке покривало та розсік його шаблею - чудовий доказ гостроти клинка та спритності воїна. Клинок султана був булатний. Це одна з багатьох легенд, що розповідає про чудесні властивості булату.
Булат - знаменита сталь. Перші відомості про булат дійшли до нас від учасників походу Олександра Македонського до Індії - за 2300 років до нашої ери.
Індія була батьківщиною булату. Східні майстри ретельно оберігали таємницю виробництва булату, передаючи її з роду в рід. Таємницю булатної сталі розкрив російський металург Павло Петрович Анасов. Після тривалих дослідів він виготовив у Злотоусі перший булатний клинок. “Лезо булату згиналося без найменших ушкоджень, видаючи чистий і високий дзвін. Відполірований кінець кришив найкращі англійські зубила", - писав Аносов у “Гірничому журналі”.
Так що ж таке булат, над таємницею якого так довго й завзято билося багато людей? “Залізо й карбон - і нічого більше, - відповідав Аносов, - уся справа в чистоті вихідних матеріалів, у методі охолодження та кристалізації". А якщо ви хочете дізнатися про десятки тисяч цікавих властивостей заліза та його сплавів, прочитайте книгу Н.А. Мезеніна “Цікаво про залізо".
Змістовно-пошуковий модуль з використанням особистісно-рольового підходу (модуль 1-й, 2 х 30
Біологічне значення заліза
В живих організмах залізо є важливим мікроелементом, що каталізує процеси обміну киснем (дихання). В організмі дорослої людини міститься близько 3,5 грама заліза (близько 0,02%), з яких 78% [джерело не вказано 158 днів] є головним діючим елементом гемоглобіну крові, інше входить до складу ферментів інших клітин, каталізує процеси дихання в клітинах. Недолік заліза проявляється як хвороба організму (хлороз у рослин і анемія у тварин).
Зазвичай залізо входить в ферменти у вигляді комплексу, званого гемом. Зокрема, цей комплекс є у гемоглобіні - найважливішому білку, що забезпечує транспорт кисню з кров'ю до всіх органів людини і тварин. І саме він забарвлює кров у характерний червоний колір.
Комплекси заліза, відмінні від гема, зустрічаються, наприклад, в ферменті метан-моноксігеназе, окислюється метан в метанол, у важливому ферменті рибонуклеотид-редуктази, який бере участь в синтезі ДНК.
В організм тварин і людини залізо надходить з їжею (найбільш багаті ним печінка, м'ясо, яйця, бобові, хліб, крупи, буряк). Цікаво, що колись шпинат помилково був внесений в цей список (через друкарські помилки в результатах аналізу - був втрачений "зайвий" нуль після коми).
Добова потреба людини в залізі наступна [15] : діти - від 4 до 18 мг, дорослі чоловіки - 10 мг, дорослі жінки - 18 мг, вагітні жінки в другій половині вагітності - 33 мг. У жінок потреба дещо вищий, ніж у чоловіків. Як правило, заліза, що надходить з їжею, цілком достатньо, але в деяких спеціальних випадках ( анемія, а також при донорство крові) необхідно застосовувати залізовмісні препарати та харчові добавки ( гематоген, ферроплекс). Добова потреба в залозі мала і її легко задовольнити. Однак у дитини, яку годують груддю, нерідко виникає дефіцит заліза. В організмі легко відновлюється рівновага між надходженням і виведенням заліза, і тимчасовий дефіцит його легко компенсується за рахунок наявних запасів. Потреба в залозі значно зростає при анемії, викликаної, наприклад, такими паразитарними інвазіями, як малярія і анкілостомоз, які дуже широко поширені в тропічних країнах.
Занимательно о железе11. Джерела (до розділу Історія)
http://nt.ru/ri/ps/pb026.htm - nt.ru/ri/ps/pb026.htm
http://www.krotov.info/acts/03/1/kliment_aleksandr_09.htm - www.krotov.info/acts/03/1/kliment_aleksandr_09.htm
http://annals.xlegio.ru/hetts/small/anitta.htm - annals.xlegio.ru / hetts / small / anitta.htm
Г. Г. Гіоргадзе. "Текст Анітти" і деякі питання ранньої історії хетів (на annals.xlegio.ru)
Р. М. Абрамішвілі. До питання про освоєння заліза на території Східної Грузії, ВГМГ, XXII-В, 1961.
Хахутайшвілі Д. А. До історії древнеколхской металургії заліза. Питання стародавньої історії (Кавказько-близькосхідний збірник, вип. 4). Тбілісі, 1973.
Геродот. "Історія", 1:28.
Гомер. "Іліада", "Одіссея".
Вергілій. "Енеїда", 3:105.
Аристотель. "Про неймовірні чутки", II, 48. ВДИ, 1947, № 2, стор 327.
Климент Олександрійський. "Стромати", глава 21.
Ломоносов М. В. Перші підстави металургії.
Цей текст може містити помилки.
Схожі роботи | скачати
Розгляньте зразок металу заліза і вкажіть його фізичні властивості.
Агрегатний стан
Колір
Запах
Смак
Металічний блиск
Відношення до води
Твердість
Густина
Електропровідність
Теплопровідність
Температура плавлення 15390С , тугоплавкий з феромагнітними властивостями (легко намагнічується і розмагнічується ).
додавайте в їжу свіжий сік лимона, капустяний розсіл, солодкий перець, цибулю і зелень.
Пшениця та інші злаки зв'язують залізо в кишечнику і перешкоджають його засвоєнню, тобто, при низькому гемоглобіні, м'ясо краще їсти без хліба, макаронів і каші, а як гарнір вибирати картоплю, зелений горошок, капусту, квасолю та інші овочі.
Міністерство охорони здоров’я України
Комунальний заклад « Бериславський медичний коледж »
Херсонської обласної ради
Ферум як представник металічних елементів побічних підгруп
Фізичні та хімічні властивості сполук
Феруму (ІІ) і Феруму (ІІІ) .
Викладач : Л.І.Драган
Затверджено на засіданні циклової комісії
викладачів загальноосвітніх дисциплін
Протокол від « «_______________2013року № ___
Голова циклової комісії загальноосвітніх дисциплін
____________________Л.І.Драган
м. Берислав
Ферум як представник металічних елементів побічних підгруп. Фізичні та хімічні властивості сполук Феруму (ІІ) і Феруму (ІІІ)
Мета:
- освітня:розглянути фізичні й хімічні властивості заліза, сполук Феруму (ІІ) та Феруму (ІІІ), порівняти властивості сполук Феруму(ІІ) і Феруму (ІІІ), закріпити знання про залежність властивостей сполук Феруму від ступеня окиснення атомів, сформувати вміння студентів записувати рівняння реакцій, які характеризують основні хімічні властивості заліза й сполук Феруму, розглянути біологічну роль заліза, його функції в організмі.
- виховна: сформувати науковий світогляд студентів при вивченні фізичних та хімічних властивостей Феруму та його сполук, їх застосування; сприяти екологічному вихованню.
- розвиваюча:
1) розвивати спостережливість ;
2) розвивати пізнавальний інтерес до предмету;
3) розвивати навички складання рівнянь хімічних реакцій на прикладі хімічних властивостей Феруму та його сполук;
4) розвивати такі мисленнєві операції : вміння порівнювати, узагальнювати, робити висновки; самостійність при виконанні завдань
Тип заняття : засвоєння нових знань та вмінь.
Обладнання: періодична система хімічних елементів, таблиця розчинності, ряд активності металів. Солі Феруму (ІІ), (ІІІ), червона кров’яна сіль, жовта кров’яна сіль , роданід амонію , штатив з пробірками ,
колекція сполук заліза, металева проволока,
Навчальні картки : характеристика положення елемента в ПСЕ, характеристика фізичних властивостей металів,
Хід заняття
І. Організаційний етап . 2хв.
ІІ . Мотивація пізнавальної діяльності повідомлення завдань і мети
заняття 2хв.
ІІІ.Актуалізація раніше вивченого 5хв.
ІV. Вивчення нового матеріалу: 60хв.
1. Історія заліза.
2. Характеристика елемента. Положення в ПСЕ.
3. Походження назви. Поширення в природі
4. Біологічна роль Феруму
5. Фізичні властивості .
6. Хімічні властивості. Лабораторний дослід.
- Застосуванння . Чавун. Сталь.
8. Цікаві факти про залізо .
V. Узагальнення вивченого. 10хв
VІ. Домашнє завдання. 1хв.
І . Організаційний етап.
Добрий день ! Я дуже рада знову зустрітися з вами . І привід для зустрічі у нас приємний .
По- перше , знову заняття з хімії ,
По – друге , мені здається , що ми зможемо порадувати один одного своїми знаннями , і ви дізнаєтесь багато нового і цікавого.
ІІ . Мотивація пізнавальної діяльності повідомлення завдань і мети
заняття .
Давні єгиптяни називали його „вааепера", що означає „той, що народився у небі”. Давні копти називали його «каменем неба». Вироби з нього цінувалися дорожче за золото. Один східний деспот навіть видав указ, яким під страхом смертної кари заборонялося всім, крім нього, носити зроблені з цього металу прикраси. В „Одіссеї” Гомера розповідається, що переможцям спортивних змагань вручали шматок цього металу та шматок золота - найбільші на той час коштовності. Алхіміки вважали його настільки неблагородним металом, що навіть займатися ним не хотіли.
Що ж це за метал? Які властивості він має? Про це ми дізнаємося на сьогоднішньому уроці.
Метали відомі здавна. Ще зі стародавності люди знали сім хімічних елементів, серед них і метал, який ми починаємо вивчати.
Яку просту речовину ми швидше за все розуміємо під словом метал?
Залізо.
«Залізо не лише основа всього світу, найголовніший метал оточуючої нас природи , але і основа культури та промисловості, воно знаряддя праці й війни. І важко в усій таблиці Менделєєва знайти інший такий елемент, який був би так тісно пов,язаний з минулими, сучасними та майбутніми долями людства » Академік А.Е.Ферсман.
Так, дійсно, саме цю речовину ми використовували і використовуємо найширше. Тому саме Ферум та просту речовину залізо, яку він утворює, ми з вами починаємо вивчати сьогодні .
3.Актуалізація раніше вивченого .
-Як у періодичній системі розрізнити метали та неметали? (Якщо від Берилію до Астату провести діагональ, то у кутку зверху розташовані неметали, всі інші - метали).
- За якими фізичними властивостями метали відрізняються від неметалів ?
- Що називають періодом?
- Які види періодів ви знаєте?
- Чим відрізняється великий період від малого?
- З яких підгруп складається група?
- Як розрізнити елементи головної підгрупи від елементів побічної підгрупи?
- На що вказує порядковий номер елемента?
- Як визначити кількість протонів та електронів атома елемента?
- Як визначити кількість нейтронів атома елемента?
ІV. Вивчення нового матеріалу: .
Історія заліза.
У таблиці Менделєєва важко знайти другий такий метал, з яким так тісно була б пов’язана історія цивілізації.
В історії немає точної дати і місця відкриття заліза. Але воно відоме людству з ІІІ тис. до н.е. В Єгипті у ХІV до н.е. залізо вважалось самим цінним з металів, з нього виготовляли різне хатнє начиння.
В Греції в ХІХст. залізо вважалось дорожчим від золота .У наших предків було поговірка : «В бою залізо дорожче від золота», « Железом и золото добуду»
В Єгипті в період Давнього і Нового царства залізо спочатку використовували для виготовлення ювелірних виробів- амулетів і прикрас. Ще в ХІV ст. до н.е. залізо вважали дорогоцінним металом . Воно як і золото , срібло входило до складу дані , яку сплачували підкорені народи.
.
А ось одна коротенька легенда . Її передає у своїх віршах німецький поет Баумбах:
« Когда победоносные полчища германцев, свергнувших могущество римлян, расположились после боя в долине рудного ручья , на вершине соседней горы показался горный дух и спросил победителей :
-Что хотите ? Золото на сотню лет или железо насегда ?
И под звон мечей воскликнула толпа :
- Железо, железо дай нам навсегда ! »
Але це все легенди. Є більш вагомі докази того , що був час коли залізо цінували дорожче від золота.
« Тебя славим , добрый друг Железо, - могучего великана в полнейшей силе», - писав у вірші « Гимн Железу» македонський поет Кочо Рацін.
Про нього писали поети ,вчені , політики. Відомі гімни на честь заліза древньоримського природодослідника Плінія Старшого.
Російський просвітник Левшин писав: »если бы цена вещей определялась их полезностью , то железо должно бы считаться драгоценным металлом, нет ремесла и художества, в котором оно не было бы необходимо»
Але саме головне в тому , що залізо є найважливішою складовою частиною в будові нашої планети. За сучасними уявленнями , в 16- ти кілометровій товщі земної кори міститься 4,5% заліза. В наступному шарі заліза в три рази більше , центр земної кулі складається з заліза з домішками Нікелю та Кобальту.
За якою ознакою хімічні елементи поділяють на: а) s-елементи; б) р-елементи; в) d-елементи?
Характеристика елемента.
Користуючись планом характеристики хімічного елемента охарактеризуйте положення в ПСЕ елемента Феруму та будову його атома. ( робота за алгоритмом )
Ферум знаходиться в ІV- періоді, 4-му парному ряді, VПІ-В групі , побічній підгрупі періодичної системи. Порядковий номер Z = 26. Заряд атомного ядра +26, нейтронів 56- 26 = 30. На 4-х енергетичних рівнях розміщені 26 електронів : в атомах Феруму після заповнення 4 s -підрівня черговий електрон розміщується не на зовнішньому 4р-підрівні — четвертий енергетичний рівень електронної оболонки, а на третьому — передзовнішньому, на вільну d-орбіталь. Отже, Ферум — d–елемент. Електронна конфігурація його атома: Іs22s22р63s23р63d64s2, або
26Fе [Аг]3d64s2.
Число неспарених електронів в атома Феруму в нормальному стані дорівнює чотирьом, а в збудженому — шести, через те що один із двох
4s-електронів переходить на 4р-підрівень:
Схема переходу електронів
Унаслідок цього під час хімічних реакцій атоми Феруму як металічного елемента можуть відщеплювати два, три, чотири або шість електронів і виявляти в сполуках ступені окиснення +2 (FеО), +3 (Fе203), +4 (К2Fе03) і +6 (К2Fе04),
1) Ферум.
2) Fe
3) Ar (Fe) = 56
4) (26, період 4, VІІІ, побічна).
5) (+26, nр=26, n=30, е=26).
6) ІІ, ІІІ
7) Ме
8) Fe - залізо.
Бачити молекулу неозброєним оком – реально, побувати в ній – запросто. Столиця Бельгії надає таку можливість , серед класичних європейських будівель виділяється атомна модель під назвою Атоміум, яка була спроектована до міжнародної виставки , що проходила в Брюсселі

Атоміум —це стальна конструкція у вигляді атома заліза, правда, атома, збільшеного у 165 млрд.раз, так що його висота становить майже 102 метри, а вага- — 2400 тон. Автором проекту виступив архітектор Андре Ватеркейн, а безпосередньо будівництво велось під керівництвом Андре та Жана Полаків. Атоміум складається з дев’яти сфер діаметром 18 метрів, які сполучені між собою спеціальними трубами. Одна із сфер знаходиться в центрі, і до ней ідуть відразу вісім діагональних труб, в двох з яких розміщений 20- місний ліфт, яких лише за 25 секунд доставить на оглядову площадку , з якої відкривається прекрасна панорама Брюселя. Прозора криша ліфту робить підйом за півхвилини захоплюючим польотом.
Посля проведення виставки пам’ятник навіть хотіли знести, так як він не вписувався в архітектурний ансамбль європейської столиці .
Нестандартна за своїм зовнішнім виглядом будова доповнилась новими технологічними рішеннями після реконструкції 2006 г., а інтер’єр відповідним чином оформили відомі дизайнери. Модель дев’яти атомів, об’єднаних в молекулу заліза, відблискує своім сталевим покриттям і вдень і вночі.. Поверхню шарів в 240 м. кв. покривають 48 пластин з нержавіючої сталі. Сфера кожного «атома» служить в якості концертних і виставочних залів, Сфери сполучаються 23-х метровими коридорами , які оснащені східцями та ескалаторами і дозволяють переміщатися між ними.
Походження назви, поширення в природі.
У чистому природному стані залізо зустрічається лише в небагатьох місцях на Землі наприклад на заході Гренландії. Чисте залізо іноді знаходять в метеоритах (залізо космічного походження). Протягом останніх 50 років випало 453 метеоритних дощі, які принесли на Землю 672 т метеоритного заліза. Це залізо порівняно легко піддається обробці, й саме з нього людина почала виготовляти найпростіші знаряддя. Але, на жаль, метеорити за замовленням на Землю на падали, а потреба в залізі була постійною.
Набагато частіше залізо зустрічається у вигляді хімічних сполук.
За поширенням у природі Ферум серед металічних елементів посідає друге місце після Алюмінію. Ферум входить до складу майже усіх гірських порід , піску, глини , головним чином оксигеновмісних сполук , які називають залізними рудами. Це :
бурі залізняки ( основний мінерал – лімоніт 2Fe2O3 *3H2O),
червоні залізняки ( основний мінерал -гематит Fe2O3),
магнітні залізняки ( основний мінерал - Fe3O4),
сидеритові руди ( основний мінерал - FeCO3 ) ,
залізний колчедан , або пірит FeS2
Не випадково назва мінералу «гематит» походить від грецьких слів «хайма»
( означає кров) і « літос» - камінь. Стара російська назва цього мінералу
« кровавик» .Характерно , що і слово «руда» , яке колись , очевидно, відносилось тільки до родовищ заліза, споріднене до російського « рдеть» - бути яскраво- червоним - та українського « рудий» .
Багаті родовища магнітного залізняку зосереджені на Уралі поблизу
м. Магнітогорська та в Курській області (так звана Курська магнітна аномалія). Родовища червоного залізняку є в Україні поблизу м. Кривий Ріг. Родовища бурого залізняку зосереджені на Керченському півострові. Крім того, потужні родовища залізних руд виявлено і в інших місцях — на Кольському півострові, в Сибіру і на Далекому Сході.
( розгляд зразків залізних руд )
Біологічна роль Феруму.
Ферум є біологічно важливим елементом. Він міститься в організмах усіх тварин і в рослинах. Ферум входить до складу цитоплазми рослин, бере участь у процесі фотосинтезу. В організмі дорослої людини міститься близько
4 г Феруму. Він накопичується здебільшого в печінці, кістковому мозку, селезінці. Але основна частина Феруму входить до складу гемоглобіну – червоного пігменту крові, який виконує функцію переносу кисню від легень до тканин, а в зворотному напрямку — вуглекислого газу. Тому обов’язково треба вживати харчові продукти, багаті на Ферум: петрушку, печінку, телятину, гречку, курагу тощо.
Основні джерела заліза
Серед харчових продуктів «лідерами» по змісту заліза є: печінка, свинина, бруньки, червоне м'ясо, збагачені вітамінами зернові й хлібобулочні вироби, м’ясо птиці, яйця, сік, чорнослив, бобові, горіхи, гречку, шпинат,петрушку , устриці, сухофрукти, курагу, коричневі морські водорості, овочі з темно-зеленим листям.
Перелік харчових продуктів, богатых залізом
|
Тип харчування |
доза |
залізо |
калорії |
|
квасоля |
1 чашка |
15 мг |
612 |
|
горох |
1 чашка |
12,5 мг |
728 |
|
соєві боби |
1 чашка |
9 мг |
376 |
|
капуста |
1 качан |
5 мг |
227 |
|
шпинат |
500 г |
9 мг |
75 |
|
брокколи |
500 г |
5 мг |
170 |
Найбільш важливі функції заліза в організмі
Про те, яка роль, що грає залізом в організмі людини, можна розповісти декількома пунктами:
- Залізо є складовою частиною багатьох ферментів і білків;
- Бере участь у формуванні червоних кров'яних клітин і постачанні киснем тканин й органів;
- Відіграє ключову роль у процесах росту в організмі;
- Підвищує опірність організму й успішно бореться з ознаками стресу і депресії;
- Запобігає утома і сприяє поліпшенню стану шкіри й навіть цвіту особи
Дві крайності - недостача й передозування
Найпоширенішими симптомами дефіциту заліза є:
1. Почуття втоми через анемію (стан, викликаний дефіцитом заліза). Часто виникає при збільшенні фізіологічних потреб у сполученні з недостатнім споживанням заліза. Наприклад, при вагітності, а також у дітей у віці від 6 до 18 місяців
2. Бліда шкіра
3.Запор
4. Ламкі нігті й слабкі зуби
Недолік заліза – це серйозна проблема, з іншої сторони його передозування може привести до отруєння. Такі явища надзвичайно рідкі, але можуть виникнути у зв'язку зі споживанням харчових добавок, при гемохроматозе – порушенні обміну заліза в організмі. Надлишок заліза приводить до ушкоджень печінки, бруньок і головного мозку.
Слід зазначити, що дози вище 100 мг. у день можуть викликати утому, втрату ваги й порушення в діяльності серцево-судинної системи. Що у свою чергу означає, що харчові добавки зі змістом заліза повинні бути виняткові за узгодженням з лікарем!
Фактори, які представляють потенційний ризик
Перший, безсумнівно, неправильне харчування, що є розповсюдженою проблемою як у дітей, так й у дорослих. Але діти особливо уразливі у віці полового дозрівання, коли модні дієти на слуху, а їм так хочеться відповідати стандартам і прагнути до ідеальної фігури. Недолік мікроелементів у подібних дієтах спричиняє порушення росту й менструального циклу. Люди, які практикують вегетаріанство, можуть також стикнутися із труднощами в одержанні поставок заліза. При доцільному підході в щоденному меню присутнє багато зернових продуктів, горіхів і бобових. Вагітність є ще одним фактором ризику, тому жінці, що виношує дитини, необхідно забезпечити для себе вживання продуктів, богатых залізом, щоб захистити плід від залізодефіцитної анемії. До суб'єктивних факторів, що тягнуть недолік заліза, відносять також більшу втрату крові під час менструації, при донорській здачі крові, при грудному вигодовуванні і т.д.
Дефіцит заліза частіше спостерігається в жінок репродуктивного віку, чим у чоловіків, у яких порівняно рідко спостерігається дефіцит заліза. Недостача заліза, як правило, асоціюється зі зниженим імунітетом і м'язовою слабістю, зниженням концентрації й психічного функціонування імунної системи
Різноманітні дієти з достатнім змістом продуктів харчування тваринного походження, овочів і фруктів можуть забезпечити необхідний набір заліза. Під час вагітності жінка має потребу в споживанні мікроелементів і харчових добавок у подвійному обсязі. Правильне харчування вагітних і жінок, що годують, є обов'язковою умовою для належної годівлі дітей грудного й молодшого віку, також є гарною профілактичною мірою проти розвитку залізодефіцитної анемії
Більша його частина знаходиться в еритроцитах у складі гемоглобіну, у дихальних ферментах цитохромах, які беруть участь в окисно-відновних реакціях, а також в імуно-біологічних реакціях, потрібних для процесів росту і розвитку. Йони Fе2+ і Fе3+ входять до складу багатьох ферментів: каталази, цитохромоксидази, пероксидази тощо.
Чотири йони Fе2+, що входять до складу гемоглобіну, зв'язують чотири молекули кисню і переносять його до тканин. На цій властивості йонів Fе2+ і заснована роль гемоглобіну як переносника кисню. Сполуку гемоглобіну з молекулярним киснем називають оксигемоглобіном.
Біологічна роль Феруму в процесі дихання полягає в тому, що в тканинах його органічні сполуки каталізують процеси дихання безпосередньо в клітинах. Йони Феруму Fе2+ і Fе3+ беруть участь у біологічному окисненні і відновленні, тому що поперемінно то віддають, то приймають один електрон:
Fе3+ + е- ↔ Fе2+; Fе2+ — е- ↔ Fе3+
Ферум бере участь у процессах кровотворення, і тому його нестача в організмі призводить до розвитку анемії (недокрів'я).
Відсутність необхідної кількості сполук Феруму(П) в ґрунті уповільнює синтез хлорофілу та деяких вітамінів. Тому сполуки Феруму(П) у вигляді солі FеS04 • 7Н20 використовують у сільському господарстві як мікродобриво.
Виступи студентів
Нестача заліза в організмі припускає зниження гемоглобіну. Для здоров'я це дуже небезпечно. Імунітет стає ослабленим, людина відчуває брак сил. Якщо в організмі не вистачає заліза, з'являється велика ймовірність простудних захворювань в будь-який час року.
Нестача заліза чітко проявляється у зовнішньому і внутрішньому стані людини. Тим не менш, займатися самолікуванням, не визначивши головну проблему недуги, не можна. Є хвороби, які надолуження заліза переносять дуже погано. Це, перш за все, інфекційні захворювання кишечника, геморой, виразка стравоходу, рак кишечника або грижа.
Організм втрачає залізо внаслідок кровотечі, менструації, неправильного харчування. Часто людям радять вживати в їжу виключно ті продукти, в яких міститься максимальна кількість заліза і магнію . До таких продуктів відносяться морепродукти, овочі і фрукти. Найменше заліза містять молочні продукти. Люди, які сідають на молочну дієту, не отримують заліза взагалі, враховуючи той факт, що залізо засвоюється погано. При вживанні продуктів, разом з якими в організм проникають 10-15 мг заліза, засвоюється лише 10-15% цієї кількості, що неймовірно мало.Передозування залізовмісними продуктами теж небезпечна, тому що організм може перенести гіперавітаміноз, простіше кажучи, шок.
Перш ніж лікувати себе вітамінами , здайте аналізи і проконсультуйтеся з лікарем. Якщо ж ви стали часто втомлюватися, скаржачись на кістки та м'язи, на поганий настрій і на постійний голод, втамовуючи який, ви все одно не наїдаєтеся - постарайтеся переглянути свій раціон. Існує ще кілька симптомів нестачі заліза, які варто враховувати.
Зверніть увагу на свої нігті і волосся . Нігті починають розшаровуватися, волосся - ламатися і випадати.Зовні вони виглядають тьмяно і мляво. Смакові відчуття теж змінюються. Особливо це стосується риби. Якщо м'ясо завдяки спеціям здається абсолютно звичним, то риба, яка зберігає свої смакові якості і без особливих спецій, здається позбавленою смаку і прісною.
У жінок кардинально змінюється менструальний цикл у календарі . Порушення пов'язані з тим, що знижується імунітет. При таких менструаціях жінка може втрачати набагато більше крові, ніж зазвичай.
Нервова система теж дуже страждає від браку заліза. Ви починаєте нервувати без причини. Тривоги бувають настільки сильними, що у вас навіть починається лихоманка. Сон стає неспокійним. Людину починають мучити кошмари, тому тривоги беруть гору над свідомістю.
Нестача заліза пов'язана з надмірним вживанням алкоголю і тютюну . Алкоголь вимиває всі запаси не тільки заліза, але й інших важливих мікро- і макроелементів. Але врахуйте, що при здачі аналізів потрібно обов'язково сказати лікареві про те, що ви випиваєте чи палите. З курінням справи йдуть складно. У курців гемоглобін завжди в нормі. Він сам по собі підвищується завдяки нікотину, який автоматично заповнює кисневе голодування.
Варто вчасно зайнятися поповненням заліза в організмі. Для цього не обов'язково вживати відразу всі препарати, в яких міститься залізо. Досить буде переглянути свій раціон і більш дбайливо ставитися до здоров'я.
Після здачі аналізів лікар може прописати вам деякі залізовмісні препарати , наприклад: Ферретаб, Матерна, Хеферол, Ферронал, Феррофольгамма, Сорбіфер Дуролес. Важливо враховувати режим прийому цих препаратів, особливо останнього. Практично у всіх цей препарат викликає нудоту. Але це не повинно лякати. Організм просто засвоює свою частку заліза, нагадуючи вам, що його у вас брак. Сорбіфер Дуролес краще пити за півгодини до їжі, інакше поглинання їжі буде дуже неприємним.. Потрібно перетерпіти симптоми нудоти. Вони проходять за пару секунд.
Постарайтеся не вживати каву і чай . Справа в тому, що ліки з залізом потрібно пити днів 10-14. За цей термін можна утриматися від шкідливих звичок і від важких бадьорячих напоїв. Заодно очиститься організм. Вживайте більше фруктів і овочів, щоб залізо контактувало з природними його носіями.
Якщо ви приймаєте інші мікро-і макроелементи (магній, калій , кальцій), не варто пити відразу ж всі ліки.Цим ви не зробите краще, вважаючи, що зараз ваш організм отримає подвійну дозу і виліковуватиметься набагато швидше. Вживайте залізо ввечері, а інші вітаміни протягом дня. Залізо повинно засвоїтися, тому і часу йому буде потрібно більше.
Після прийому препаратів із залізом не варто вживати молочні продукти, тому що вони заважають залізу засвоїтися. Якщо вам дуже хочеться молочних продуктів - їжте їх через дві години після прийому заліза.
Якщо залізо в капсулах - приймайте такий препарат. Він ефективніший.
Пам'ятайте, що в тваринній їжі дуже багато заліза. Навіть більше: залізо там міститься двовалентне, тому постарайтеся їсти побільше м'яса, якщо відчуваєте, що брак заліза заводить у безвихідь ваш організм.
Низький гемоглобін: як заповнити дефіцит заліза в організмі
.
Щоб підвищити низький гемоглобін і «тримати» його в нормі, потрібно одержувати з їжі 1,5 мг заліза на день. Але, виявляється, засвоює організм не більше 10%. Тому й заліза потрібно з'їдати в десять разів більше. Так з звідки ж брати цей цінний мікроелемент?
Дієтологи, для запобігання негативних наслідків, викликаних низьким гемоглобіном, склали свій рейтинг харчових продуктів з високим вмістом заліза. Перелік продуктів, рекомендованих при низькому гемоглобіні, варто прочитати уважно і запам'ятати.
Головне місце в ньому в ньому займають м'ясні субпродукти: печінка, нирки, язик.
Потім іде крупа гречана, квасоля, горох, шоколад, гриби білі, чорниці. У цих продуктах найбільша кількість заліза - більше 4 мг на 100 г продукту. Щоб підвищити гемоглобін, частіше включайте ці корисні продукти в свій раціон харчування.
Від 2 до 4 мг заліза містять яловичина, баранина, конина, м'ясо кролика, яйця, вівсяна крупа, пшоно, яблука, груші, хурма, айва, інжир, кизил, шпинат, горіхи.
Рекомендується при низькому гемоглобіні і вживання продуктів, що містять помірну кількість (1-1,9 мг) заліза. Це свинина, м'ясо курей, ковбаси варені, сосиски, сир, сардини, скумбрія, ставрида, оселедець, ікра риб, хліб з борошна вищого гатунку, крупа перлова, ячна, манна, рис, картопля, цибуля зелена, редис, буряк, щавель, кавун, диня, слива, гранат, черешня, полуниця, малина, смородина чорна. Але ці продукти так само корисно включати в раціон харчування при низькому гемоглобіні.
Мало заліза (0,4-0,9 мг) в рибі, меді, баклажанах, зеленому горошку, гарбузі, сливі, персиках, лимонах, винограді, абрикосах, вишні, агрус, журавлині. І ще менше - 0,1-0,3 мг заліза, можна отримати з молока й кефіру, сметани, сиру, апельсинів і мандаринів. Підвищити гемоглобін за допомогою цих продуктів вам не вдасться.
Але при низькому гемоглобіні мало включати в раціон харчування продукти, багаті залізом. Важливо знати, що продукти, багаті кальцієм, різко знижують засвоєння заліза. Тому, щоб підвищити гемоглобін в організмі хоча б на час краще відмовитися від молока і молочних продуктів. Якщо це неможливо, їжте залізо - і кальцієвмісні продукти в різний час.
Засвоєння заліза також знижують чай і кава, при низькому гемоглобіні їх не варто пити під час і після їжі. А ось вітамін С - ваш союзник, для того, щоб підвищити гемоглобін у крові пийте апельсиновий або томатний сік, додавайте в їжу свіжий сік лимона, капустяний розсіл, солодкий перець, цибулю і зелень.
Пшениця та інші злаки зв'язують залізо в кишечнику і перешкоджають його засвоєнню, тобто, при низькому гемоглобіні, м'ясо краще їсти без хліба, макаронів і каші, а як гарнір вибирати картоплю, зелений горошок, капусту, квасолю та інші овочі.
Фізичні властивості
- Що називають властивостями речовини? (Ознаки, за якими одна речовина подібна до іншої, чи відрізняється від неї).
- Які види властивостей вам відомі? (Розрізняють властивості фізичні та хімічні). –
- Які властивості називають фізичними? (Властивості, які можна побачити неозброєним оком чи виміряти за допомогою приладів).
Розгляньте зразок металу заліза і вкажіть його фізичні властивості.
Агрегатний стан ( тверда речовина );
Колір ( сріблясто – білого кольору або сірий метал
внаслідок швидкого окиснення на вологому
повітрі)
Запах ( без запаху)
Смак ( без смаку)
Металічний блиск ( добре виражений)
Відношення до води ( нерозчинний у воді)
Твердість ( м’який , досить ковкий)
Густина ( більша за воду 7,874г/см3)
Електропровідність ( добра )
Теплопровідність ( добра )
Температура плавлення 15390С , тугоплавкий з феромагнітними властивостями (легко намагнічується і розмагнічується .
.

Хімічні властивості.
Лабораторний дослід : Якісні реакції на йони Fе2+ , Fе3+
Залізо – метал середньої хімічної активності.
У найстійкіших сполуках Ферум виявляє ступені окиснення +2,+3,+6.
1. Повільно окиснюється на вологому повітрі( процес іржавіння). У разі нагрівання взаємодіє з багатьма неметалами (киснем, галогенами, сіркою, фосфором, вуглецем, силіцієм), водою:
ЗFе + 202=Fе304
2Fе + ЗС12=2FеС13
ЗFе + С = Fе3С
2.Взаємодіє з водою після зняття оксидної плівки:
У розжареному стані (понад 7000С) взаємодіє з водою (водяною парою)
ЗFе + 4Н20 = Fе304+4Н2
Fе304 (залізна окалина) — змішаний оксид (FеО • Fе203), найстійкіша оксигеновмісна сполука Феруму.
3. Залізо розчинається в розбавлених кислотах:
Fе + 2НС1→ FеС12 + Н2 (без доступу повітря).
При доступі повітря йде подальше окиснення:
4FеС12 + 4НС1 + 02 → 4FеС13 + 2Н20
4.Концентровані сульфатна і нітратна кислоти за кімнатної температури пасивують залізо. У разі взаємодії з розбавленою нітратною кислотою під час нагрівання утворюються сполуки Феруму(Ш), а в результаті дії дуже розбавленої — сполуки Феруму(П):
Fе + 4НNO3 (роз6, гар) = Fе(N03)з + N0 ↑+ 2Н20
5Fе + 12НNO3 (дуже розб, t =10 0-С) = 5Fе(NO3)2 + N2 ↑+ 6Н20
5.Залізо витискує менш активні метали з розчинів їх солей:
Fе + СиS04 = FеS04 + Си ↓
Сполуки Феруму(ІІ) і Феруму(ІІІ): оксиди та гідроксиди,солі
Ферум утворює такі оксиди та гідроксиди:
FеО Fе304 Fе203
Fе(0Н)2 Fе(0Н)3
Посилюються окисні властивостi--------------------------→
Послаблюються основні властивостi --------------------→
Посилення кислотних властивостей сполук Феруму(ІІІ) порівняно із сполуками Феруму(ІІ) пояснюється збільшенням ковалентності зв’язку
Fe – O із підвищенням ступеня окиснення Феруму.
Добування. Ферум(П) оксид одержують термічним розкладанням ферум(П) оксалату та ферум(И) гідроксиду без доступу повітря:
FеС204=Fе0 + С0 + С02
Fе(0Н)2 = Fе0 + Н20
Ферум(Ш) оксид утворюється внаслідок розкладання Fе(0Н)3 на повітрі:
2Fе(0Н)3 = Fе203 + ЗН20
Fе304 можна одержати у разі нагрівання (800 °С) заліза з водяною парою, а також із Fе203:
ЗFе + 4Н20(пара) = Fе304 + 4Н2
13000C
6Fе203 ------→ 4Fе304 + 02
Із наведених прикладів видно, що для добування оксидів Феруму використовують непрямі способи. Вони ж лежать і в основі одержання гідроксидів Феруму:
FеS04 + 2К0Н = Fе(0Н)2 і + К2S04 (в атмосфері N2)
Fе2(S04)3 + 6К0Н = 2Fе(0Н)3 ↓+ ЗК2S04
Усі оксиди і гідроксиди Феруму нерозчинні у воді.
Хімічні властивості. Оксиди і гідроксиди Феруму обох ступенів окиснення мають амфотерні властивості. У сполук Феруму(ІІ) вони дуже слабко виражені, тому ферум(ІІ) оксид і ферум(ІІ) гідроксид виявляють переважно основні властивості:
FеО виявляє головним чином основні властивості, тому взаємодіє тільки з розчинами кислот:
FеО + Н2S04 = FеS04 + H2O
![]() Ферум(П) гідроксид виявляє , якщо він свіжодобутий і під час кип’ятіння , амфотерні властивості, але переважно основні:
Ферум(П) гідроксид виявляє , якщо він свіжодобутий і під час кип’ятіння , амфотерні властивості, але переважно основні:
Fе(ОН)2 + 2НС1(роз6) = FеС12 + 2Н20
Реагує з концентрованим розчином лугу утворюючи Натрій тетрагідроксиферат(ІІ):
Fе(ОН)2 +2NаОН(kon ω=50%) → Nа2[Fе(ОН)4]
Fе203 і Fе(ОН)3 — амфотерні сполуки, тому взаємодіють як з кислотами, так і лугами:
Fе203 + ЗН2S04(роз6) = Fе2(S04)3 + ЗН20
Fе203 + 2NаОН —cnікания → 2NаFе02 + Н20
натрій метаферит(Ш)
Fе(ОН)3 + ЗНС1 = FеС13 + ЗН20
Fе(ОН)2 — сильний відновник , бо спроможний окиснюватися навіть на повітрі:
4Fе(ОН)2 + 02 + 2Н20 = 4Fе(ОН)3
Fе(ОН)3 виявляє окисно-відновні властивості лише за наявності сильних відновників або окисників:
2Fе(ОН)3 + ЗН2 = 2Fе + 6Н20 — окисні властивості
2Fе(ОН)3 + ЗВг2 + 10КОН = 2К2Fе04+ 6КВг + 8Н20
калій ферат(УІ)
Гідроксиди Феруму(ІІ) і (ІІІ) під час нагрівання розкладаються:
2Fe(OH)3 = Fe2O3 + 3H2O
Fe(OH)2 = FeO + H2O
Подвійний (змішаний) оксид під час взаємодії з кислотами утворює суміш двох солей – Феруму(ІІ) і Феруму(ІІІ):
Fe3O4 + 8HCl = 2FeCl3 + FeCl2 + 4H2O
Fe3O4 + 4H2SO4 = Fe2(SO4)3 + FeSO4 + 4H2O
Якісні реакції на йони Fе2+ , Fе3+
Реакції йонів Fe2+
1. Амоній гідроксид з йонами Fе2+ без доступу повітря утворює
білий осад ферум(П) гідроксиду, який розчиняється в кислотах
і не розчиняється в лугах (за кімнатної температури):
FeS04 + 2NН4ОН → Fе(ОН)2 ↓ + (NH4)2S04
осад білого кольору.
2. Йони Fе2+ з червоною кров'яною сіллю К3[Fе(СN)6] утворюють
погано розчинну у воді сіль темно-синього кольору, яка має
назву «турнбулева синь»:
ЗFеS04 + 2К3[Fе(СN)6] = Fе3[Fе(СN)6]2 ↓ + ЗК2S04
червона турнбулева синь
кров'яна сіль
Розчини солей Феруму(П) забарвлені в блідо-зелений колір.
Реакції йонів Fe3+
1. Амоній гідроксид з йонами Fе3+ утворює червоно-бурий осад
ферум(Ш) гідроксиду, який розчиняється в кислотах:
FеС13 + 3NH4ОН → Fе(ОН)3 ↓ + ЗNН4С1
буро-червоний осад).
2.Йони Fе3+ із жовтою кров'яною сіллю утворюють осад
берлінської лазурі:
4FеС13 + ЗК4[Fе(СN)6] = Fе4[Fе(СN6]3 ↓ + 12КС1
жовта кров'яна сіль берлінська лазур
3. Амоній роданід (тіоціанат) з йонами Fе3+ утворює розчин
криваво-червоного кольору:
FеС13 + ЗКSСМ = Fе(SСN)з + ЗКС1
Роданід феруму
Лабораторний дослід
Якісні реакції на виявлення йонів Fe2+ , Fe3+
Мета : провести якісні реакції на виявлення йонів Fe2+ , Fe3+ в розчині.
Обладнання : штатив з пробірками .
Реактиви : розчини ферум (ІІ) і ферум (ІІІ) сульфатів або хлоридів, розчини червоної та жовтої кров’яної солі, роданіду амонію.
Завдання : виконати роботу і оформити звіт , заповніть таблицю.
Правила техніки безпеки
1.Робоче місце має бути звільнене від сторонніх речей.
2.Перед початком досліду уважно читай етикетку , щоб правильно вибрати реактив.
3.Відкривши посудину з реактивом , потрібно класти пробку догори дном.
4.Надлишок взятого реактиву не можна зливати ( висипати ) назад у посуд; розчини кислот, лугів брати краплями ; тверді речовини чи розчини солей – щоб ледь покрили дно пробірки.
5.Реактив наливати за правилом , щоб розчин не потрапив на етикетку .
6.Посудину , з якої взяли реактив, слід відразу ж закрити пробкою і поставити на місце.
7.Жодні реактиви не можна пробувати на смак.
8.Після роботи відпрацьовані реактиви можна зливати у раковину тільки після їх повної нейтралізації .
9.Після роботи вимийте посуд, приберіть робоче місце, ретельно вимийте руки.
10.У разі потрапляння їдких речовин на руки чи одяг негайно змийте їх великою кількістю води , нейтралізуйте та знову змийте водою.
11.Категорично забороняється проводити досліди , не зазначені в роботі , та самостійно зливати і змішувати реактиви.
|
Хід роботи
|
Спостереження, рівняння реакції |
|
1. Реакція Fe2+ з жовтою кров’яною сіллю . Налийте в пробірку 0,5мл розчину солі ферум сульфату, долийте кілька крапель розчину жовтої кров’яної солі.
|
Спостереження : __________________________ __________________________________________ Рівняння хімічної реакції в молекулярній , повній та скороченій йонній формах : _________________________________________ ___________________________________________ ___________________________________________ |
|
2. Реакція Fe3+ з червоною кров’яною сіллю . Налийте в пробірку 0,5мл розчину солі ферум (ІІІ) хлориду, долийте кілька крапель розчину червоної кров’яної солі.
|
Спостереження : __________________________ __________________________________________ Рівняння хімічної реакції в молекулярній , повній та скороченій йонній формах : _________________________________________ ___________________________________________ ___________________________________________ |
|
3. Реакція Fe3+ з амоній роданідом . Налийте в пробірку 0,5мл розчину солі ферум (ІІІ) хлориду, долийте кілька крапель розчину амоній роданіду
|
Спостереження : __________________________ __________________________________________ Рівняння хімічної реакції в молекулярній , повній та скороченій йонній формах : _________________________________________ ___________________________________________ ___________________________________________ |
Зробіть висновок :
Йони Fe2+ , Fe3+ в розчині виявляють шляхом проведення відповідної якісної реакції .
Якісною реакцією на йони Fe2+ є ____________________________________________________________________________________________________________________________________
Якісною реакцією на йони Fe3+ є ______________________________________________________________________________________________________________________________________________________________________________________________________
Прізвище студента :
Застосування заліза та його сплавів у техніці.
Чисте залізо використовують як матеріал для виготовлення осердь електромагнітів та якорів електромашин, пластин акумуляторів. Залізні порошки застосовують для виготовлення металокерамічних виробів — підшипників сковзання, як каталізатор. Препарати заліза застосовують як лікарський засіб проти анемії. Але найчастіше в техніці і повсякденному житті мають справу не з чистим залізом, а з його сплавами: чавуном і сталлю. Чавун з великою масовою часткою кремнію є кислототривким, а зі значною масовою часткою мангану — дуже твердим. Звичайний сірий чавун виявляється досить крихким під час деформації розтягуванням, через те що містить графіт у вигляді пластинок. У результаті введення до нього мангану графіт у чавуні набуває сферичної форми і внаслідок цього високої міцності. З такого чавуну відливають труби, ґрати для мостів, деталі машин і хімічної апаратури.
Широке застосування в машинобудуванні, транспорті й будівництві знайшли спеціальні, або так звані леговані сталі. До їх До їх складу, крім заліза, можуть входити хром, нікель, вольфрам, молібден, ванадій, кобальт, титан та інші метали. Введення певного металу до заліза надає сталі необхідних властивостей. Так, хром підвищує твердість сталі та її корозійну стійкість, нікель збільшує в'язкість, вольфрам сильно підвищує твердість, ванадій (0,2-0,5%) — в'язкість і твердість, молібден підвищує пружність і покращує зварюваність. Леговані сталі застосовують для виготовлення різальних і вимірювальних інструментів, штампів, деталей машин і конструкції.
Картки-завдання з теми «Ферум та його сполуки»
Приготуйте усні відповіді на такі запитання:
1.Якою є будова атома заліза?
2.Якою є поширеність заліза в природі?
3.Як одержують залізо з його руд? Вкажіть види залізних руд.
4.Опишіть фізичні властивості заліза
5.Допишіть хімічні реакції, розставте в них коефіцієнти:
1. Fe + Cl2 =… 2. Fe + Br2 =…
6). Розставте коефіцієнти в рівняннях реакцій:
1. Fe + О2 =Fe3 О4
2. Fe + НСl =FeСl 3 + Н2
3. Fe2 О3 + Аl =Аl2 О3 + Fe
7). Обчисліть масову частку Феруму в його оксидах: FeО, Fe2 О3, Fe3 О4
8). Закінчити речення очікувань:
1. Я знаю, що Ферум у періодичній системі розташований у ______ періоді, ________групі ________________ підгрупи.
2. Я знаю, що валентність Феруму _________, може бути _________ та ________.
3. Я знаю, що Ферум утворює _____ просту речовину - _______________ .
4. Я знаю, що відносна атомна маса Феруму та відносна молекулярна маса заліза чисельно співпадають і дорівнюють _________________ .
5. Я знаю, що за агрегатним станом залізо __________ речовина, яка не має __________, __________ та __________ .
6. Я знаю, що залізо _________ у воді, добре проводить _________ та _________ .
7. Я знаю, що залізо притягується _________ .
8. Я знаю, що залізо – хімічно ___ речовина, реагує з простими речовинами, такими як: __________ та __________.
9)Напишіть рівняння реакцій, за допомогою яких
можна здійснити такі перетворення:
Fе → FеС12 → Fе(ОН)2 →Fе(ОН)3 →Fe2O3→ Fe → FeS
Які з цих реакцій та чому є окисно-відновними?
10). За схемами складіть рівняння практично здійснимих реакцій:
а) СиС12(розч.)+Fе→
б) Fе + Н20 →
в) МgS04 (розч.)+ Fе →
г) Fе+Н2S04(конц.) →
д) FеС12(розч.)+ КОН(розч.)→
е) Fе(ОН)2+НС1 →.
11) Розгляньте рис. 1 та дайте відповіді на запитання.

1.Яку хімічну реакцію проводять у приладі, зображеному на рисунку? Напишіть рівняння цієї реакції.
2.Які зміни відбудуться із залізом всередині залізної трубки?
3.Яким газом заповнюється пробірка?
4.Укажіть ще один-два метали, які аналогічно залізу можуть взаємодіяти з водою за подібних умов. Напишіть рівняння реакцій.
12) Складіть формули оксидів, гідроксидів і хлоридів Феруму, в яких він виявляє ступінь окиснення +2, +3. Чи можна перетворити ферум(ІІ) оксид на ферум(Ш) хлорид та навпаки? Чому?
13) Розв'яжіть задачу.
Суміш заліза та залізної окалини (Fе304) масою 32 г обробили надлишком хлоридної кислоти. При цьому виділилося 5,6 л водню. Обчисліть масову частку заліза та залізної окалини у вихідній суміші.
.
Додаткові завдання
1.Як із заліза можна одержати ферум(ІІ) гідроксид та ферум(Ш) гідроксид? Напишіть рівняння відповідних реакцій.
2.Напишіть рівняння реакцій, що дозволяють здійснити такі перетворення:
FеО → Fе → FеS04 → FеС12
3. Маємо суміш ферум(ІІ) хлориду та алюміній(Ш) хлориду. її розчинили у воді й до одержаного розчину додали надлишок розчину натрій гідроксиду, а осад, що з'явився, відфільтрували. Що міститься в осаді, а що — в розчині? Напишіть рівняння реакцій.
4. Ферум(Н) сульфат слід очистити від домішок купрум(ІІ) сульфату. Складіть план роботи та запишіть рівняння реакцій.
5.Яку масу заліза можна відновити за допомогою. алюмінотермічного способу з 1 кг ферум(Ш) оксиду, що містить 8 % домішок?
6.Гра «хрестики-нолики».
Визначте виграшні шляхи на схемах, якщо:
а) це хімічні сполуки, що входять до складу залізних руд;
б) це складні речовини, що належать до одного класу.
|
Fе(ОН)2 |
FеS04 |
FеС03 |
|
FеS |
FеС12 |
Fе203 |
|
FеО |
Fе(ОН)3 |
Fе304 |
|
FеО |
Fе(ОН)3 |
FеВг2 |
|
FеS04 |
Fе304 |
Fе3С |
|
Fе(ОН)2 |
FеS |
Fе203 |
Розв'яжіть кросворд «Метали».

У восьми колах зображені знаки хімічних елементів-металів. Розташуйте їх назви по горизонталі у клітинках таким чином, щоб у вертикальному стовпчику, виділеному жирними лініями, можна було прочитати назву найпоширенішого металу на Землі.
Схему кросворда перекресліть у зошити.
V. Узагальнення вивченого.10хв
Це метал , іменем якого названа ціла епоха в історії людства. Епоха , яка продовжується багато тисячоліть .Залізо – фундамент цивілізації , основа економічної могутності держави. Про перспективи застосування заліза і сплавів на його основі краще всього сказав академік Ферсман : « Майбутнє за іншими металами, а залізу буде відведено почесне місце старого , заслуженого металу. Але до цього майбутнього ще далеко.
Залізо покищо - основа металургії , машинобудування, шляхів сполучення, суднобудування, мостів, транспорту. Епоха заліза продовжується і буде продовжуватись дуже довго. В сучасному світі заліза добувають у 20 разів більше , ніж всіх інших металів, разом взятих »
Ні залізо , ні будь- який інший метал не можуть принести зла людству , без злої волі самої людини, залізо , насамперед , метал і він великий трудівник. Його без перебільшень називають головним металом цивілізації.
VІ. Домашнє завдання.2хв.
1. Опрацювати матеріал підручника § 22 ст. 163-167, конспект уроку.
2. Виконати завдання.
3.Дати відповідь на питання :
1.) Чому в світовій енциклопедичній літературі залізо названо великим трудівником?
2) Чим небезпечний „Залізний голод? ”
ЗАПИТАННЯ І ЗАВДАННЯ ■
1.Охарактеризуйте фізичні властивості заліза.
2.З якими з перелічених речовин реагує залізо: хлор, сірка, вода, сульфатна кислота, натрій гідроксид, калій хлорид, купрум(ІІ) сульфат? Напишіть рівняння можливих реакцій, схематично позначте перехід електронів.
3.Напишіть рівняння реакцій взаємодії заліза з хлором, з хлоридною кислотою, з киснем, із сіркою. Схематично позначте перехід електронів. Порівняйте, у яких випадках залізо окислюється глибше. Чому?
4.Обчисліть масу ферум(ІІІ) оксиду, який потрібен для одержання заліза масою 1 кг.
5.Обчисліть масу залізної окалини Ре304, що утворюється під час згоряння порції порошку заліза масою 28 г.
6.Порцію суміші порошків заліза, цинку та алюмінію масою 24 г розчинили в розбавленому розчині сульфатної кислоти. У результаті утворився газ об'ємом 13,44 дм3 (н. у.). Якщо розчинити таку саму порцію суміші в розчині калій гідроксиду, виділяється 11,2 дм3 (н. у.) газу. Обчисліть масові частки металів у суміші.
- Напишіть рівняння реакцій, за допомогою яких можна здійснити ланцюжок перетворень речовин:
а) залізо -> ферум(ІІ) хлорид -» ферум(ІІ) гідроксид -> ферум(ІІІ)
гідроксид -> ферум(ІІІ) оксид -> залізо;
б) залізо -» ферум(ІІІ) хлорид -> ферум(ІІІ) гідроксид ->
ферум(ІІІ) оксид -» залізо -> триферум карбід.
- У результаті обробки сталевих ошурок масою 9,375 г зібрали карбон(ІУ) оксид об'ємом 280 см3 (н. у.). Визначте масову частку вуглецю в сталі.
- Порцію суміші порошків заліза й міді масою 12 г розчинили в хлоридній кислоті. У результаті угворився газ об'ємом 2,24 дм3 (н. у.). Обчисліть масові частки металів у суміші.
- Порцію суміші порошків заліза, міді та алюмінію масою 30,5 г розчинили в хлоридній кислоті. У результаті утворився газ об'ємом 19,04 дм3 (н. у.). Якщо розчинити таку саму порцію суміші в розчині натрій гідроксиду, то виділиться 16,8 дм3 (н. у.) газу. Обчисліть масові частки металів у суміші.
Пірит ( сірчаний колчедан) Лімоніт ( бурий залізняк)
Комунальний заклад
« Бериславський медичний коледж »
Херсонської обласної ради
Заняття № 26-27
по темі
«Ферум як представник металічних елементів
побічних підгруп »
з дисципліни
«Хімія»
Викладач : Драган Л
.Ім. Берислав
Затверджую
Директор КЗ
" Бериславський медичний коледж "
___________ В.П.Кучер
" ______" __________ 2015р.
Інструкція
з пожежної безпеки у службовому приміщенні
І. Забороняється :
- користуватися відкритим вогнем , курити , використовувати легкозаймисті речовини ;
- захаращувати проходи та підступи до засобів пожежогасіння ;
- вмикати електронагрівальні прилади без не горілих підставок ;
2. ПОРЯДОК ДІЙ У РАЗІ ВИНИКНЕННЯ ПОЖЕЖІ
- у разі виникнення пожежі - всі дії студентів та викладача повинні бути спрямовані на створення безпеки людей ;
- негайно викликати пожежну охорону за телефоном 101 та повідомити адміністрацію коледжу ;
- для здійснення евакуації у разі виникнення пожежі , студенти організовано виходять з кабінету за схемою ;
сигналом до евакуації є : серія частих коротких дзвінків на протязі 5 хвилин .
Відповідальний за пожежну безпеку ___________
Зав. кабінетом № 418 ___________ Драган Л . І.
)
)


про публікацію авторської розробки
Додати розробку
