Урок:Ферум як представник металічних елементів побічних підгруп. Фізичні та хімічні властивості заліза. Застосування
Тема: Ферум як представник металічних елементів побічних підгруп. Фізичні та хімічні властивості заліза. Застосування
Мета:
навчальна : розглянути положення Феруму в періодичній системі хімічних елементів; ознайомитись із фізичними та хімічними властивостями простої речовини заліза, якісні реакції на іони феруму, також із його застосуванням;
розвиваюча: стимулювати свідоме ставлення учнів до вивчення нового матеріалу; розвивати логічне мислення, вміння робити висновки, порівнювати та встановлювати причинно-наслідкові зв′язки, складати рівняння реакцій, що характеризують хімічні властивості заліза;
виховна: виховувати екологічну свідомість учнів.
Тип уроку: комбінований.
Тема: Ферум як представник металічних елементів побічних підгруп. Фізичні та хімічні властивості заліза. Застосування
Мета:
навчальна : розглянути положення Феруму в періодичній системі хімічних елементів; ознайомитись із фізичними та хімічними властивостями простої речовини заліза, якісні реакції на іони феруму, також із його застосуванням;
розвиваюча: стимулювати свідоме ставлення учнів до вивчення нового матеріалу; розвивати логічне мислення, вміння робити висновки, порівнювати та встановлювати причинно-наслідкові зв′язки, складати рівняння реакцій, що характеризують хімічні властивості заліза;
виховна: виховувати екологічну свідомість учнів.
Тип уроку: комбінований.
Методи і методичні прийоми:
1.Інформаційно-рецептивний:
а) словесний: розповідь-пояснення,опис, бесіда, повідомлення учнів
б) наочний: демонстрація,ТЗН.
Прийоми навчання: виклад інформації, пояснення, активізація уваги та мислення, демонстраційний дослід, одержання з тексту, демонстраційного досліду нових знань.
2. Репродуктивні.
Прийоми навчання: подання матеріалу в готовому вигляді, конкретизація і закріплення вже набутих знань.
3. Проблемно-пошукові: постановка проблемного питання.
Прийоми навчання: постановка взаємопов’язаних проблемних питань,активізація уваги та мислення.
4. Візуальний: складання рівнянь хімічних реакцій.
5. Інтерактивні: робота в парах, «мозковий штурм», асоціативно-логічна схема "Дерево рішень".
6. Релаксопедичний: психологічне розвантаження.
Форми роботи: фронтально-колективна, індивідуальна, групова.
Міжпредметні зв’язки : біологія, інформаційні технології, література, ОБЖ, кулінарія, історія.
Обладнання: періодична система хімічних елементів; електрохімічний ряд напруг металів; колекція «Гірські породи та мінерали»; мультимедіа; реактиви для проведення лабораторних дослідів p.CuSO4, FeCI3, роданід натрію, пробірки.
Хід уроку
І. Організація групи
1.Привітання
2.Перевірка наявності необхідного для уроку.
ІІ. Актуалізація опорних знань
1.Тест-доповнення
1.У Періодичній системі Алюміній розташований у ____ періоді.
2. В електронній оболонці атомів Алюмінію заповнюється ____ електронних шарів.
3.Скільки електронів міститься атом Алюмінію ?
4.Ступінь окиснення Алюмінію в сполуках дорівнює ____
5.У хімічних взаємодіях атоми Алюмінію тільки ________електрони
6. Формула Алюміній оксиду __________
7. Чи зустрічається Алюміній у природі у вільному вигляді _____
8. Алюміній оксид утворює мінерал _____________
9.Спосіб відновлення металів з їх оксидів за допомогою Алюмінію називають ______________
10. Оксид і гідроксид алюмінію наділені_____________
Властивостями
Відповіді перевіряються шляхом взаємоперевірки (слайд №2)
2. Завдання на встановлення відповідності слайд №1
|
1. |
Al + O2 |
А |
AlСl3 + H2 |
|
2. |
Al + H2O |
Б |
AlСl3 |
|
3. |
Al + Сl2 |
В |
AlСl3 + H2O |
|
4. |
Al + HСl |
Г |
AlСl3 + Hg |
|
5. |
Al + NaOH |
Д |
AlСl3+ HgСl2 |
|
6. |
Al + HgСl2 |
Е |
NaAlO2 + H2 |
|
7. |
Al + Fе3О4 |
Ж |
Al(OH)3 + H2 |
|
|
|
З |
Al(OH)3 + Na |
|
|
|
И |
Al2O3 + Fе |
|
|
|
К |
Al2O3 |
ІІІ. Мотивація навчальної діяльності.
Легенда
Давні єгиптяни називали його «вааспера», що означає «той, що народився в небі». Давні копти називали його каменем неба. Вироби з нього цінувалися дорожче за золота. Один східний деспот видав указ, в якому під страхом смерті заборонялося всім , крім нього носити зроблені з цього металу прикраси. В «Одіссеї» Гомера розповідається що переможцям спортивних змагань вручали шматок цього металу та шматок золота – найбільші на той час коштовності. Алхіміки вважали його настільки неблагородним металом, що навіть займатися ним не хотіли.
?? Що ж це за такий метал?
Повідомлення теми, мети (Слайд № 3)
Отже, об’єктом нашого дослідження буде ферум як представник металічних елементів побічних підгруп. Протягом уроку ми з'ясуємо чи є сенс в твердженні, що залізо цінніше за золото.
IVВивчення нового матеріалу:
1.Поширення в природі.
Чисте залізо мало хто бачив. Самородне залізо є неабиякою рідкістю й за вартістю порівнюється із самородками золота. Залізні утворення завбільшки до 30 см і масою до 5 кг знайдено в базальтових породах поблизу капселя (Німеччина). На о. Диско (Поблизу Гренландії) виявили 25 – ти тонну брилу заліза.
Залізо є компонентом багатьох метеоритів. Вважають, що воно є складовою частиною внутрішнього ядра земної кулі Через атмосферу на нашу планету часто потрапляли метеорити, що складались із чистого заліза. Саме через це залізо називають золотим металом. Протягом останніх 50років випало 453 метеоритних дощі, які принесли на Землю 672т метеоритного заліза. Відкриття заліза мало величезне значення для людства. Завдяки тому, що залізо має добру ковкість, воно і цінувалось, іноді було навіть дорожче за золото. Метеоритного заліза було мало, і давні майстри винайшли способи добування його з руд. (Слайд №4)
В Індії поблизу міста Делі встановлено пам′ятник – Кутубську колону( 1600 років), яку тривалий час вважали виготовлену із суцільного шматка метеориту, висота її 7 м., маса більше 6 т. Насправді виготовлена з дуже чистого заліза.
Залізо - другий за поширеністю метал у земній корі. У природі зустрічається у вигляді оксидів і сульфідів:
( Слайд №5) Вміст елементів у земній корі.
Сполуки Феруму: ( Слайд №6)
Fe3O4 - магнітний залізняк мінерал, що містить 72 % Феруму. Це - найбагатша залізна руда.Магнетит має природну властивість намагнічуватися. Тож назва «магніт» походить від назви мінералу.
Fe2O3 - червоний залізняк (гематит) мінерал, що містить 70 % Феруму. Він відомий людині з давніх давен. У Давньому Єгипті його використовували для виготовлення прикрас, печаток. У Александра Македонського був перстень із вставкою з гематиту, який, як він вважав, робив його невразливим у бою. У Середньовіччі цей мінерал використовували як ліки, що зупиняють кров.
2Fe2O3 * 3H2O - бурий залізняк може мати забарвлення від коричневого до жовтого, часто містить домішки піску чи глини. Лимоніт використовують ддя виготовлення пігменту - жовтої охри.
FeS2 - залізний колчедан Пірит (від грец. πυρίτηζ- «обпалений вогнем») має властивість іскрити при ударі по ньому сталевими предметами Цей красивий мінерал вражає золотистим кольором, яскравим блиском на майже завжди чітких гранях. Завдяки своїм властивостям пірит відомий з глибокої давнини.
Марс називають червоною планетою. Назва пов’язана з червоним кольором її поверхні, який обумовлений великою кількістю сполук тривалентного Феруму, якого багато на планеті. Досить часто ми спостерігаємо бурий колір водопровідної води, яка тече по старим іржавим трубам. Це також є причиною розчинення сполук тривалентного Феруму в ній
( Слайд №7) Поклади залізної руди на Україні
Інтерактивна вправа «Дерево рішень» (Слайд №8)
1. У якому періоді розташований Ферум?
2. У якій групі розташований Ферум?
3. У якій підгрупі розташований Ферум?
4. Скільки електронних шарів у атомі Феруму?
5. З якими речовинами можуть реагувати метали?
6. Які ступені окиснення буде проявляти Ферум?
У міру того як учні відповідають на питання, заповнюється «Дерево рішень». На останнє питання відповідь дається пізніше.
Самостійна робота в парах (Охарактеризувати елемент за місцем в п/с)
2.Застосування заліза. Метод «Мозковий штурм».
Де застосовують залізо?
Висловлювання думок, щодо застосування
- Виготовлення зброї.
- Каталізатор.(для синтезу аміаку)
- Лікарські препарати.(проти недокрів’я)
- Художні вироби.
- Як сердечник для електромагнітів.
- Пластини для акумуляторів.
- В піротехніці (горить бенгальський огонь)
Повідомлення заздалегідь підготовлених учнів « Застосування заліза» (Додаток №1)
Запитання: Будову і властивості речовин вивчають для того, щоб застосувати в техніці, побуті. Чого не вистачає?
Предметом дослідженнянашого уроку будуть: Фізичні та хімічні властивості заліза. Застосування
3.Фізичні властивості заліза. (Слайд № 9)
Прочитати текст, розданий группам(Додаток №2)
Ланцюгом називати властивості, не повторюючи і розмістити на дошці.
1. Колір
2. Блиск
3. Пластичність
4. Магнітні властивості
5. Температура плавлення
6. Твердість
4.Будова атома Феруму. (слайд №10-12)
Ферум – d-елемент VІІІБ групи (або побічної підгрупи VІІІ групи) періодичної системи.
Будова атома:
В атомі Феруму вісім валентних електонів (3d64s2), тому він виявляє змінні ступені окиснення.
Атом легко втрачає 4s2-електрони, утворюючи йони Fe2+:
У збудженому стані один електрон з 3d-підрівня може переходити на 4p-підрівень (така електронна конфігурація також доволі стабільна) і ставати валентним:
Таким чином найхарактерніші валентності Феруму — II і III, ступені окиснення — +2, +3 (інколи +6).
Найхарактерніші ступені окиснення +2 і +3,+6
5. Хімічні властивості.
??? Які загальні хімічні властивості проявляє залізо?
Прийом «Мозковий штурм» ( Слайд №13)
![]()
![]() Неметали вода
Неметали вода

![]()
![]()
Кислоти солі
Ферум утворює два ряди сполук, що відповідають ступеню окислення+ 2, +3. Ступінь окиснення Fe залежить від окислювальної здатності реагує речовини. У сильних окисників ферум приймає ступінь окислення +3, у слабкіших+ 2.
І. Взаємодія заліза з простими речовинами.
1.Демонстрація . Взаємодія заліза із сіркою (Слайд №14)
Змішуємо порошок сірки й відновленого заліза в співвідношенні 4г: 7г, насипаємо в пробірку і трохи нагріваємо. Що спостерігаємо? Утворюється продукт взаємодії заліза із сіркою — ферум(П) сульфід. Запишемо рівняння хімічної реакції.
- Fе + S = FeS – Ферум сульфід.
(Відеофайл. Взаємодія заліза з сіркою)
2. Взаємодія заліза з хлором. (Слайд №14)
Fe + Cl =FeCl3 – Ферум хлорид
(Відеофайл. Спалювання заліза в хлорі)
3.Демонстрація .Спалювання заліза в кисні(Слайд №14)
До спіралі із залізного дроту прикріплюємо сірник, підпалюємо й опускаємо дріт у банку з киснем (на дно банки попередньо насипаємо пісок). Що спостерігаємо? отже
Щоб записати рівняння реакції, необхідно згадати, що Ферум у сполуках виявляє дві валентності — II і III, , може утворюватися два оксиди. Складемо відповідні рівняння реакції:
2.Fe +O2=2FeO – Ферум (ІІ)оксид
3. 4Fe+3O2=Fe2O3 Ферум (ІІІ) оксид
Обидва оксиди можуть утворюватися в результаті горіння заліза. Тому бура маса, що утворилася в результаті горіння, виражається формулою
Fe3O4=Fe2O3.FeO
(Відеофайл. Спалювання заліза)
Тоді
3Fe+2O2=Fe3O4
4.Взаємодія заліза з вуглецем.
Fe+C=Fe3C - цементит
Висновок: Залізо, як і більшість металів, взаємодіє з неметалами.
ІІ. Взаємодія заліза зі складними речовинами.
1) Взаємодія з водою.
Залізо є стійким до дії води завдяки оксидній плівці, що утворюється на його поверхні. Якщо її знищити (а це відбувається за 7000С), залізо витискуватиме водень із води:
3Fe + 4Н2О = Fе3О4 + 4Н2↑
2.Демонстрація. Взаємодія заліза з розчинами хлоридної, сульфатної та нітратної кислот різної концентрації.
Залізо взаємодіє з розбавленими хлоридною й сульфатною кислотами:
Fe + 2НСl = FeCl2 + Н2↑;
Fe + H2SО4 = FeSО4 + Н2↑.
Із концентрованими кислотами залізо не взаємодіє завдяки міцній оксидній плівці, що дає змогу зберігати й перевозити їх у залізних цистернах.
3) Взаємодія із солями менш активних металів.
Демонстрація. Взаємодія заліза з розчином мідного купоросу.
Висновок: Залізо може відновлювати менш активні метали з розчинів їхніх солей:
Fe + CuSО4 = FeSО4 + Си.
6. Роль Феруму в житті організмів. (Повідомлення учня – випереджальне завдання.)
V. Закріплення знань.
1.Прийом «Чомучка»(Слайд №15)
1) Чому в атомі Феруму чотири електронні оболонки?
2) Чому в атомі Феруму на зовнішній оболонці два електрони, хоча він розташований у VIII групі?
3) Чому Ферум має змінні ступені окиснення?
4) Чому у Феруму ступені окиснення +2 та +3?
5) Заповнюємо останню гілку нашого дерева
Завдання 2. Установити відповідність між формулами та назвами мінералів №16
Завдання . Установити відповідність між фізичними властивостями та застосуванням (Слайд №17)
Завдання 3 «Речення очікувань» закінчити
1Я знаю, що Ферум у природі зустрічається переважно у вигляді _________.
2. Я знаю, що найважливішими сполуками Феруму є: _____________________________ .
3. Ферум - це елемент ___________підгрупи.
4. Ферум може проявляти ступені окиснення _______ і __________
5. Я знаю, що застосування заліза базується на його__________ ____________
6. Я знаю, найбільш багаті на Ферум такі продукти харчування, як: _____
VI.Підсумки уроку
Оцінювання діяльності учнів на уроці.
Рефлексія "Мікрофон" - "Сьогодні на уроці я
Дізнався про…
Зрозумів …
Навчився…
Відчув труднощі при …
працював за 12-бальною шкалою на …
Я вдячний…
VII. Домашнє завдання
Опрацювати матеріал параграфа, відповісти на запитання до нього. Підготуватися до практичної роботи. Творче завдання.
Домашнє завдання: §.
Література
1. Бондарь СП. Дидактичні засади гуманізацію процесу навчання // Біологія і хімія в шк. - 1999. - №;. - с.13-17
2. Гольдфарб Я.Л. та ін. Збірник задач і вправ з хімії. Навчальний посібник для учнів 8-11 кл. серед. шк. / Я.Л. Гольдфарб, Ю.В. Ходаков, Ю.Б. Додонов. - 7 вид., перероб - к.: Освіта, 1993. - 221 с
3. Методика викладання шкільного курсу хімії: Посібник для вчителя/ Н.М.
Буринська, Л.П. Величко, Л.А. Липова та ін.; Під ред. Н.М. Буринської. - К.:
4. Ярошенко О.Г. Групова навчальна діяльність школярів: теорія і методика: (На матеріалі вивчення хімії). - К.: Партнёр, 1997. - 208с.
5. Ярошенко О.Г., Коршак Т. Є. Перевір, як ти знаєш неорганічну хімію: Збірник тестів і тестових завдань для 8-10кл. - К.: Курс, 1998. - 64с.
6. Момот Л.Л. Розвивальне навчання: методи і прийоми // Біологія і хімія в шк. - 1999. - №2. - с.9-12
7. Супоницкая И.И., Гогоевская Н.И., Жантиева Н.А. Опорные схемы при систематизации знаний // Химия в. шк. - 1998. - № 6. - с.48-51
Додаток №1
Залізо – метал, використання якого у промисловості та побуті не має меж. Частка заліза у світовому виробництві металів становить 95%.
Застосування заліза базується на його фізичних властивостях пластичності, твердості, здатності проводити електричний струм та теплоту, піддаватися куванню.
Залізо є основним конструкційним матеріалом, тобто матеріалом, із яко¬го виготовляють конструкції, що витримують великі механічні навантаження: рейки, палі, цвяхи, рами для автомобілів, корпуси кораблів і тепловозів, висотні башти та багато іншого.
Залізо притягується магнітом, крім того, може зберігати намагніченість після усунення дії магнітного поля. Завдяки цьому із заліза виготовляють магніти та матеріали для різноманітних носіїв інформації – магнітні стрічки, диски тощо.
Однак чисте залізо в народному господарстві зазвичай не використовується, навіть у наш час абсолютно чисте залізо коштує значно дорожче за золото, крім того, чисте залізо має низьку міцність. В основному залізо застосовується у вигляді двох сплавів: чавуну та сталі.
Залізо досить широко застосовується як художній матеріал. ( Восьмигранний п’єдистал пам’ятника князю Володимиру споруджений із цегли та облицьований чавуном. Велетенська споруда Атоміум у Брюсселі. Спочатку основа була з алюмінію. Після реконструкції покриття кожної кулі замінили на сталеві.
Не можна обійти увагою «Пальму Мерцалова» - витвір мистецтва українських майстрів. Вона була викована Олексієм Мерцаловим у 1886 році.
На жаль, обмежені запаси заліза на планеті й недостатня стійкість до іржавіння ставлять перед людством завдання знайти матеріал, який міг би замінити залізо
Додаток №2
Чисте залізо – сірувато-сріблястий метал, він пластичний і м′який, тому легко кується, штампується, прокатується в листи. Температура плавлення 1539 градусів по Цельсію. Залізо притягується магнітом, легко намагнічується та розмагнічується, тому його використовують як серцевину для електромагнітів у різних приладах та механізмах. Твердість та механічність залізо отримує у процесі загартування: нагрівання до високої температури, червонорозжарювання і різкого охолодження.
Додаток №3
Ферум є елементом природи. Людина теж частина природи. Організм дорослої людини містить приблизно 4 - 5г Феруму ( з яких 57 % входить до складу гемоглобіну). Він входить до складу гемоглобіну крові, що відповідає затранспортування кисню по всьому організму. Кров має червоний колір завдяки наявності в ній іонів (ІІІ) валентного Феруму.
Кров деяких черв′яків має зелений колір. До її складу також входить Ферум , але (ІІ) валентний.
Більша частина заліза міститься в печінці та селезінці та в кістковому мозку.
Добова потреба для дорослої людини становить 15 мг і для дитини – 7 мг Недостатня кількість Феруму у крові викликає тяжке захворювання анемію (недокрів′я), при якому людина відчуває слабкість та запаморочення. Запас Феруму в організмі повинні поповнювати продуктами, що містять його у достатніх кількостях: яблука, вишні, гранати, виноград,шпинат яловичина , печінка, гречана крупа.
Опорний конспект
|
період |
група |
Ar |
№ |
заряд ядра |
ₑ‾ |
р |
n |
ступінь окиснення |
валентність |
|
|
|
|
|
|
|
|
|
|
|
Природні сполуки
магнітний залізняк _________ червоний залізняк____________
бурий залізняк ________________пірит________________
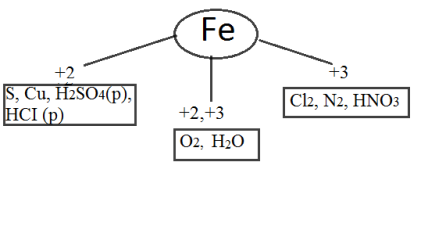
Хімічні властивості
- Fe + S =
- Fe + НСІ =
- Fe + СuSО4 =
- Fe + CІ2 =
- Fe + N2=
- Fe + C =
- Fe + O2 =
- Fe + H2O =
1


про публікацію авторської розробки
Додати розробку
