Валентність хімічних елементів. Складання формул бінарних сполук за валентністю елементів. Визначення валентності елементів за формулами бінарних сполук.
Сформувати поняття про валентність хімічних елементів; розвивати вміння встановлювати причинно-наслідкові зв'язки між місцем знаходження елементів у Періодичній системі хімічних елементів та їх валентностями.
Тема. Валентність хімічних елементів. Складання формул бінарних сполук за валентністю елементів. Визначення валентності елементів за формулами бінарних сполук.
Цілі уроку:
- Формування навчальних компетентностей: сформувати поняття про валентність хімічних елементів; розвивати вміння встановлювати причинно-наслідкові зв’язки між місцем знаходження елементів у Періодичній системі хімічних елементів та їх валентностями.
- Діяльнісна: навчити визначати валентність елементів за формулами бінарних сполук; формувати навички учнів користуватися Періодичною системою як джерелом інформації.
- Виховна: виховувати любов до праці шляхом залучення всіх учнів до навчальної діяльності; формувати міжпредметні, комунікативні і здоров’язбережувальні компетентності.
Форми роботи: словесний (бесіда, розповідь, робота з підручником, періодичною системою хімічних елементів, виконання тренувальних вправ), наочний (демонстрація слайдів).
Обладнання та матеріали: Періодична система хімічних елементів Д.І. Менделєєва, алгоритм визначення валентності в бінарних сполуках, мультимедійний проектор.
Тип уроку: засвоєння нових знань.
Епіграф уроку: «...Хімічні формули говорять хімікові цілу історію речовини».
Д.І. Менделєєв.
Хід уроку
І. Організаційна частина
Добрий день, діти! Я рада вітати всіх вас на нашому уроці. Сподіваюся, що час, який проведемо разом, допоможе вам піднятися на ще один щабель у вивченні дивовижної науки хімії.
ІІ. Актуалізація опорних знань. Перевірка домашнього завдання
- Перевірка домашнього завдання
- Робота в парі. Із наведеного переліку випишіть окремо формули простих і складних речовин: H2, Fe2O3, H2O, Al, BaCO3, Cl2, O2, CO2, Cu, H3PO4, NaCl, O3.
- Бесіда
- Які речовини називають простими?
- Які речовини називають складними?
- Охарактеризуйте якісний і кількісний склад речовин: Н2O, NH3, CH4.
- Наведіть приклади складних речовин та сумішей.
ІІІ. Мотивація навчальної діяльності
Більше трьох сотень років тому вчені встановили, що атоми з'єднуються в молекули за допомогою особливих зв'язків, що мають назву хімічних. Спершу атоми уявляли у вигляді кульок, на поверхні яких є «гачки», за їх допомогою атоми поєднуються один з одним, як ланки одного ланцюга. Тільки на початку XX ст. була встановлена істинна природа хімічного зв'язку.
Одна з основних властивостей атома — це здатність утворювати хімічні зв'язки. Атоми різних елементів можуть утворювати певне число зв'язків, притаманне лише їм. Число хімічних зв'язків, що утворюють атоми даного елемента, називають валентністю.
- Чому атоми сполучаються між собою, утворюючи прості або складні речовини?
- Як вони тримаються один біля одного?
Мабуть, їх тримають якісь певні сили. Сила латинською мовою буде YALENTIA, від нього і походить термін ВАЛЕНТНІСТЬ.
Записуємо тему уроку: Валентність хімічних елементів (учитель разом з учнями формулює мету уроку).
ІV. Вивчення нового матеріалу
Сьогодні на уроці ви повинні з’ясувати: що таке валентність, запам’ятати валентність Оксигену та Гідрогену, усвідомити поняття „бінарні” сполуки, навчитися визначати валентність за формулами бінарних сполук, за положенням елемента в періодичній системі хімічних елементів, за структурними та графічними формулами.
Засновником вчення про валентність вважають німецького хіміка Фрідріха Августа Кекуле, який запропонував теорію валентності у 1857 році (150 років тому).
Отже, валентність – це загальна властивість атомів приєднувати до себе певну кількість атомів іншого хімічного елемента.
Молекулярні формули показують лише якісний та кількісний склад речовин, але хіміки використовують ще один вид формул — структурні формули. Ці формули показують не лише хімічний склад, а й дають наочне уявлення про кількість хімічних зв’язків кожного елемента і про порядок зв'язування атомів один з одним.
У структурних формулах кількість хімічних зв’язків, які утворює атом хімічного елемента позначають рисками, саме кількість рисок і визначає його валентність.
Отже, структурна формула – це формула, яка показує порядок розташування та з’єднання атомів в молекулі.
За одиницю валентності приймають атом Гідрогену, вважають, що Гідроген має сталу валентність, яка дорівнює одиниці.
Засновником вчення про валентність вважають німецького хіміка Фрідріха Августа Кекуле, який запропонував теорію валентності у 1857 році.
Демонстрація кулестрижневих молекул води, сірководню, амоніаку, хлороводню, метану. Учні визначають кількість зв’язків, які утворює атом Гідрогену, визначають яку валентність виявляють атоми.
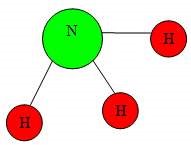
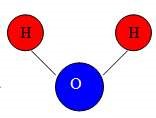
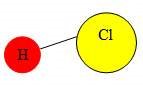
Валентність елементів можна визначати за допомогою Періодичної системи елементів. Номер групи, в якій міститься елемент показує максимальну валентність елемента. Майже всі елементи I, II, III груп ПС проявляють сталу валентність. Оксиген (VI група) виявляє тільки валентність II. Для позначення валентності використовують римські цифри.
Із скількох елементів складається кожна із запропонованих вам складних речовин?
Подвійний – той, що складається із двох частин, латинською мовою буде BINARIUS. Сполуки, які складаються із атомів двох елементів називаються БІНАРНИМИ сполуками.

Алгоритм для визначення валентностей в бінарних сполуках
- Указуємо валентність елемента з відомою валентністю:
II II I
Fe2O3 CO2 CH4
- Множимо число атомів цього елемента на його валентність:
3∙II=6 2∙II=4 4∙I=4
- Ділимо отримане значення на число атомів іншого елемента:
6:2=III 4:1=IV 4:1=IV
- Записуємо значення валентності над символом цього елемента:
III II IV II IV I
Fe2O3 CO2 CH4
Алгоритм складання формул за валентністю (на прикладі Al2O3)
1. Проставити валентності.
2. Знайти найменше спільне кратне (н.с.к.) для валентностей. н.с.к.=6
3. Ділимо н.с.к. на валентність і отримуємо індекс. н. с. к. = 6
Користуємося правилом: у формулах бінарних сполук сумарна валентність усіх атомів одного елемента завжди дорівнює сумарній валентності усіх атомів іншого елемента.
Визначення валентності за формулами бінарних сполук:
(користуємося «Інструкціями визначення валентності за формулою бінарних сполук»)
- Записуємо формулу речовини та значення валентності над символом хімічного елемента, у якого стала валентність, римською цифрою.
- Визначаємо сумарну валентність усіх атомів цього елемента.
- Сумарну валентність ділимо на кількість атомів елемента, валентність якого визначаємо.
Робота у парі.
Визначення валентності хімічних елементів за формулами бінарних сполук.
- Cu2O, CuO, FeO, Fe2O3
- P2O5, PH3, PbO, PbO2
- MnO, MnO2, Mn2O7, H2S
- CrO, Cr2O3, CrO3, SO2
- HCl, Cl2O5, Cl2O7, SO3
- N2O, NO, NO2, NH3
- CO, CO2, Hg2O, HgO
V. Фізкультхвилинка
VІ. Застосування набутих знань
1. Гра «Хрестики-нулики»
Виграшний шлях: одновалентні метали.
|
K2O
|
Fe2O3 |
AI2O3 |
|
SO3
|
Na2O |
CO2 |
|
CO
|
SiO2 |
Cu2O |
Виграшний шлях: тривалентні метали.
|
Сr2O3
|
Fe2O3 |
AI2O3 |
|
SO3
|
Na2O |
CO2 |
|
CO
|
SiO2 |
Cu2O |
2. Тестування
1. Виберіть символи елементів, які виявляють сталу валентність:
а) О; б) Р; в) Mn; г) H; д) К.
2. Вкажіть в якому випадку валентність елементів визначена вірно:
I II ІІ І
а) Na2 O б) Na2 O
3. Визначіть відповідність елемента в сполуках з Оксигеном та його валентності:
1. CrO3 а) І
2. K2O б) ІІ
3. SO2 в) ІІІ
4. MgO г) ІV
д) VI
4. Вкажіть сполуку у якій валентність елемента, сполученого з Оксигеном, найвища:
а) Н2О; б) СаО; в) РbO2; г) CrO3; д) Br2O7
5. В якій із сполук валентність елемента, сполученого з Гідрогеном, найнижча:
а) Н2О; б) NH3; в) НI; г) SiH4
6. Запишіть молекулярні формули наведених речовин. Визначте валентність Сульфуру в його сполуках за графічними формулами. У відповіді наведіть кількість валентностей, які проявляє Сульфур.
Варіанти відповідей: А) одна, Б) дві, В) три, Г) чотири, Д) п’ять.
Заповнити таблицю відповідей
|
Завдання № |
1. |
2. |
3. |
4. |
5. |
6. |
|
Варіант відповіді |
|
|
|
|
|
|
|
№ з/п |
Назва речовини |
Графічні формули |
Молекуляр-ні формули |
Валентність |
|
|
Калій сульфід |
S
K K |
|
|
|
|
Сульфур діоксид |
O = S = O |
|
|
|
|
Сірководень |
S
H H |
|
|
|
|
Сірка |
S S S S S S |
|
|
|
|
Сульфур триоксид |
O
S O O |
|
|
|
|
Сульфатна кислота |
O
H – O – S – O H
O |
H S O |
|
VІІ. Рефлексія
Бесіда. Чи досягли мети уроку?
- Властивість атомів хімічного елемена з’єднуватися з певним числом атомів того самого або інших хімічних елементів називається (ВАЛЕНТНІСТЬ)
- Валентність атома Гідрогену –(1), Оксигену - (2).
- Кількісно валентність виражається кількістю атомів (Гідрогену), які приєднує атом даного елемента.
- Сполуки, які містять в своєму складі атоми двох елементів називаються (БІНАРНИМИ).
- Валентність можна визначати (за формулами бінарних сполук або за положенням елементів у періодичній системі хімічних елементів).
VІІІ. Підсумок уроку
ІX. Домашнє завдання
Опрацювати параграф підручника, виконати завдання у кінці параграфа.


про публікацію авторської розробки
Додати розробку