Урок-гра "Хімічні властивості оцтової кислоти. Застосування оцтової кислоти"
Тема : Хімічні властивості оцтової кислоти. Застосування оцтової кислоти
Мета: закріпити знання про молекулярну та структурну формули оцтової кислоти, функціональну карбоксильну групу карбонових кислот, повторити фізичні властивості карбонових кислот; вивчити хімічні властивості оцтової кислоти, її застосування; розвивати навички складати рівняння реакцій , що характеризують хімічні властивості оцтової кислоти, доводити дослідним шляхом її кислотні властивості ; розуміти суть і типи записаних реакцій.
Очікувані результати: учні повинні вміти записувати формули органічних кислот, характеризувати їх, чітко пояснювати фізичні і хімічні властивості оцтової кислоти, знати способи і методи застосування на практиці.
Тема : Хімічні властивості оцтової кислоти. Застосування оцтової кислоти
Мета: закріпити знання про молекулярну та структурну формули оцтової кислоти, функціональну карбоксильну групу карбонових кислот, повторити фізичні властивості карбонових кислот; вивчити хімічні властивості оцтової кислоти, її застосування; розвивати навички складати рівняння реакцій , що характеризують хімічні властивості оцтової кислоти, доводити дослідним шляхом її кислотні властивості ; розуміти суть і типи записаних реакцій.
Очікувані результати: учні повинні вміти записувати формули органічних кислот, характеризувати їх, чітко пояснювати фізичні і хімічні властивості оцтової кислоти, знати способи і методи застосування на практиці.
Обладнання: мультимедійний проектор, комп’ютер, роздатковий матеріал, реактиви і обладнання для проведення демонстрацій: пробірки, штатив, метиловий оранжевий, фенолфталеїн, магній , натрій гідроксид, натрій карбонат, етанова кислота, етанол.
Тип уроку: Вивчення нового матеріалу.
Форми та методи проведення: урок-гра: лекція, бесіда, Мозковий штурм, Павучок, Світлофор, „відстрочена відгадка”, демонстрація, «Мікрофон».
Епіграф: «Зібратися разом- це початок, триматися разом – це прогрес, працювати разом – це успіх»
Хід уроку:
І. Організація класу.
Перевірка готовності учнів до уроку. Налаштування на робочий лад.
- Епіграфом нашого уроку є слова Генрі Форда. (зачитування епіграфу)
Щоб наш урок вдався плідним, нам потрібно попрацювати організовано, і повинні бути уважні , кмітливі, допитливі.
ІІ. Актуалізація опорних знань.
Асоціативно-логічна схема "Павучок"
Для того, щоб перевірити нашу готовність до засвоєння нового матеріалу, я пропоную вам опрацювати схему "Павучок":
- Який клас речовин ми вивчаємо? (карбонові кислоти)
- Назвіть речовину, яка є представником цього класу? (оцтова кислота)
- Назвіть її формулу (СН3СООН)
- Пригадайте якомога більше фактів, які характеризують будову та фізичні властивості оцтової кислоти.
- Якої інформації нам не вистачає для повної характеристики оцтової кислоти? (знання про хімічні властивості, сфери використання)
(Оскільки учні на уроці повинні працювати на рівних із учителем засадах, то в складанні асоціативно-логічної схеми вони не є пасивними споживачами знань. Для роботи над поняттям "Оцтова кислота" вчитель пропонує учням добрати ключові слова, що характеризують дану речовину. Цей методичний прийом забезпечує розвиток усного зв’язного мовлення, характеристики поняття.
Аналіз складеної асоціативно-логічної схеми демонструє рівень інформованості учнів з теми, відкриває горизонти для подальшого вивчення речовини).
Прийом „ Світлофор”, коли учні говорять, коли „ТАК” і коли „ НІ”.
- Спирти –це органічні сполуки, які містять гідроксогрупи.
- Одноатомні спирти містять одну гідроксогрупу.
- Гліцерин відноситься до одноатомних спиртів.
- Спільна властивість спиртів –взаємодія з активними металами.
- Всі спирти можна виявити за допомогою свіже виготовленого розчину купрум (ІІ) гідроксиду.
- Етанол можна застосовувати для пом’якшення шкіри.
- Гліцерин можна застосовувати для пом’якшення шкіри.
- Етанол і гліцерин застосовують у парфумерії.
- Метанол відносять до багатоатомних спиртів.
- Метанол –отрута.
ІІІ. Мотивація навчальної діяльності.
Чи знаєте Ви про таку кислоту,
Яку повсякчас додаєм до борщу,
ЇЇ ми кладемо завжди в маринад
Для всяких смачнючих солінь і принад?
Ну звичайно, це оцтова кислота, а в побуті – оцет (6, 9, 12%).
ІV. Вивчення нового матеріалу.
Поняття про карбонові кислоти
Карбонові кислоти – органічні оксигеновмісні сполуки, що містять одну або кілька карбоксильних груп –COOH, сполучених з вуглеводневим радикалом.
Загальна формула карбонових кислот: 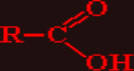
Номенклатура карбонових кислот
Відповідно до номенклатури, назви кислот походять від назв відповідальних радикалів з додатком суфікса –ова і слова «кислота».
Найпростішими представниками гомологічного ряда карбонових кислот давайте спробуємо написати:
|
Формула |
Назва |
|
|
Систематична (від радикалів) |
Тривіальна |
|
|
H-COOH |
метанова кислота |
Мурашина кислота |
|
CH3 - COOH |
етанова кислота |
Оцтова кислота |
|
C2H5 –COOH |
пропанова кислота |
Пропіонова кислота |
|
C3H7 –COOH |
бутанова кислота |
Масляна кислота |
Карбоксильна група є функціональною групою карбонових кислот. Загальна формула R-COOH.
Чи відомі вам інші продукти рослинного або тваринного походження, що містять кислоти?
-Чим пояснити подразнюючу дію листя кропиви та укусів мурашок?
-Яка кислота утворюється внаслідок прокисання вина?
- Чому прогоркає вершкове масло?
Назви кислот походять від назв відповідних радикалів з додатком суфікса – ова і слова «кислота». Найпростішими представниками є метанова, і етанова кислоти.
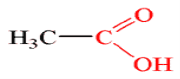
Розглянемо будову молекули оцтової кислоти
- Молекулярна формула: CH3COOH
- Структурна формула:
Фізичні властивості
Оцтова кислота – безбарвна рідина, летка, має різкий специфічний запах, змішується з водою в будь-яких пропорціях, розчин кислий на смак;
за t < 170 С кристалізується (“крижана кислота “);
3-9%- водний розчин – столовий оцет;
86% -водний розчин - оцтова есенція
Демонстрація дослідів
Хімічні властивості карбонових кислот на прикладі оцтової кислоти.
1) електролітична дисоціація: CH3COOH CH3COO- + H+
ацетат - йон
Оцтова кислота – слабкий електроліт. Зміна забарвлення індикаторів в кислому середовищі оцтової кислоти: метилоранжевий – рожевий
лакмус – червоний
2) Взаємодія з металами:
2СН3СООН + Мg Mg(CH3COO)2 + H2 магній ацетат
3) Взаємодія з оксидами металів:
2СН3СООН + СаО Са(СН3СОО)2 + Н2О кальцій ацетат
4) Взаємодія з лугами:
СН3СООН + NaOH NaCH3COO + H2O натрій ацетат
5) Взаємодія з солями, утвореними слабшими кислотами:
2СН3СООН + Na2CO3 2 NaCH3COO + CO2+ H2O
6) Взаємодія зі спиртами:
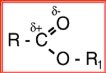
СН3СООН + С2Н5ОН СН3СООС2Н5 + Н2О етиловий естер оцтової кислоти
Загальна формула естера
Учні працюють з таблицею
|
№ |
Що робили? |
Що спостерігали? |
|
1. |
Дія оцтової кислоти на індикатори:
|
|
|
2. |
Взаємодія оцтової кислоти з металами:
|
|
|
3. |
Взаємодія оцтової кислоти з кальцій оксидом |
|
|
4. |
Взаємодія оцтової кислоти з Натрій гідроксидом (попередньо в пробірку із оцетом додаємо індикатор) |
|
|
5. |
Взаємодія оцтової кислоти із спиртами |
|
|
6. |
Взаємодія оцтової кислоти із кристалічною питною содою |
|
Застосування оцтової кислоти
- розчинник
- виробництво барвників
- хімічні засоби захисту рослин
- харчова промисловість
- побутова хімія
- лікарські препарати
V. Узагальнення та закріплення знань
1. Вкажіть функціональну групу карбонових кислот:
а) –ОН; б) –СООН; в)-NH2; г) –СОН
2. Вкажіть формулу оцтової кислоти:
а) НСООН; б)СН3СООН; в)С15Н35СООН; г)С17Н33СООН
3. Вкажіть колір індикатора лакмусу в розчині оцтової кислоти:
а) рожевий; б) синій; в) прозорий; г) червоний
VI. Закріплення вивченого матеріалу.
Знайдіть відповідності між властивостями та сферами використання оцтової кислоти, варіанти можуть повторюватися.
|
1 |
Харчосмакова добавка |
|
А |
Полярний розчинник, в ній розчиняється багато органічних сполук |
|
2 |
Консервант |
Б |
Має бактерицидні властивості |
|
|
3 |
Кулінарія |
|||
|
4 |
Засіб для видалення накипу |
В |
Характерний кислий смак та різкий запах |
|
|
5 |
Складова косметичних засобів |
Г |
Естери застосовують як ароматизатори косметичних засобів |
|
|
6 |
Сировина для добування органічних сполук |
Д |
Реакція взаємодії з питною содою ("гасіння соди") |
|
|
7 |
Розчинник |
Є |
Взаємодія зі спиртами для добування естерів |
|
|
8 |
Засіб для дезінфекції |
|||
|
9 |
Виробництво ацетатного волокна |
Ж |
Взаємодія із нерозчинними або малорозчинними солями |
Відповідь: 1-В, 2-Б, 3-Д, 4-Ж, 5 –Г, 6-Є, 7-А, 8-Б, 9-Є
VIІ. Рефлексія
Вправа "Мікрофон" - "Сьогодні на уроці я…"
- Дізнався про…
- Зрозумів …
- Навчився…
- Відчув труднощі при …
- працював за 12-бальною шкалою на …
- Я вдячний…
VIІ. Домашнє завдання
Творче завдання: підготувати з допомогою батьків рецепти консервування овочів, де використовується оцтова кислота(оцет).


про публікацію авторської розробки
Додати розробку
