Урок гра-подорож«Основні класи неорганічних сполук»
Дана розробка про узагальнення і систематизацію знань учнів про склад, класифікацію, хімічні властивості основних класів неорганічних речовин.Цікаві завдання розвивають інтерес до предмета, ерудицію, вміння швидко й чітко формулювати і висловлювати свої думки, логічно міркувати, працювати колективно.
УРОК-подорож до країни Неорганічні сполуки .(8 КЛАС)
Цілі: узагальнити й систематизувати знання учнів про склад, класифікацію, хімічні властивості різних класів неорганічних речовин; удосконалювати вміння складати формули неорганічних речовин, рівняння хімічних реакцій; стимулювати пізнавальну активність учнів; розвивати інтерес до предмета, ерудицію, вміння швидко й чітко формулювати й висловлювати свої думки, логічно міркувати, працювати колективно.
Обладнання: таблиця «Основні класи неорганічних сполук», таблиця Менделеєва
Тип уроку: узагальнення та систематизації знань.
Форма уроку: урок-подорож.
Методи: бесіда, графічний диктант, самостійна робота, розповідь.
Девіз уроку: «Знай! Умій! Застосовуй!»
ХІД УРОКУ
І. Організаційний етап.
Формування здоров»язберігаючих компетенцій
Щоб не мати сколіозу,
Сидіть прямо за столом,
Тримайте ноги на підлозі
Тільки під прямим кутом.
І про зір не забувайте-
Рівно голову тримайте.
II. МОТИВАЦІЯ НАВЧАЛЬНОЇ ДІЯЛЬНОСТІ
Учитель. Діти! Сьогодні в нас не зовсім звичайний урок. Ми повинні виконати складне завдання -здійснити подорож до країни Неорганічні сполуки.Багато в неї таємниць і загадок. Жителі цієї країни різноманітні і суперечливі за характером.Ви вже дізнались,що в цій країні є чотири особливі міста,в яких проживає понад 100 тисяч мешканців.
Назвіть ці міста(оксиди,кислоти, солі, основи)
І перш ніж вирушити в дорогу, вам необхідно правильно накреслити ключ пропуск. Ключ-пропуск, діти, — це ваші знання. Виконаймо графічний диктант.
III. ПРОВЕДЕННЯ гри.
Завдання№1 «Ключ-пропуск»
Позначити значком на відрізку номер положення, з яким ви не згодні.
- Вода — найпоширеніший на Землі оксид.
- Усі кислоти містять у своєму складі Оксиген.
- Кислоти змінюють забарвлення індикаторів.
- Усі основи розчинні у воді.
- Оксиди — це складні речовини, до складу яких входить Оксиген.
- Солі — це різнобарвні тверді кристалічні речовини,
- Усі метали реагують із кислотами.
- У лужному середовищі фенолфталеїн стає малиновим.
- Розчинні у воді основи — це луги.
- Назви солей складаються з назв кислотного залишку.
- НNО3 — формула сульфатної кислоти.
- Сіль хлоридної кислоти називається хлоридом
^- ^-^^-^^--^
Після написання диктанту діти обмінюються аркушами і перевіряють один одного,порівнюючи з правильною відповіддю на дошці (првильна відповідь 1 бал)
Учитель.Отже ,хто підготувався і упорався із завданням,той і поїде.У кого пропуск на 10-12 балів ,той поїде у експресі зусіма зручностями,у кого 7-9-доведеться задовольнитися пасажирським потягом,а в кого бали нижчі-не ображайтесь,але залишилася тільки дрезина.
От ми і в гостях у місцевих жителів.І вони хочуть перевірити, що ви про них знаєте.
Завдання №2 «Хто швидше?» ( 4 бали)
1. Розподіліть речовини за класами. З букв, що позначають правильні відповіді, можна скласти прізвище великого російського хіміка.
|
Формула |
Клас неорганічних речовин |
|||
|
|
оксиди |
кислоти |
основи |
солі |
|
CaS |
Л |
Г |
Ш |
М |
|
KOH |
А |
Е |
Е |
О |
|
SO3 |
Н |
М |
Р |
С |
|
H2O |
Д |
К |
О |
П |
|
NaNO3 |
К |
В |
З |
Е |
|
H 2CО3 |
Б |
Л |
Д |
К |
|
Al(OH)3 |
Р |
О |
Е |
И |
|
НCl |
У |
Е |
Х |
Н |
|
CаS04 |
ь |
Т |
К |
в |
|
|
||||
|
HCL
|
НNО3,
|
HBr
|
|
|
Cu(OH)2 |
KOH
|
NaOH
|
|
|
SO3
|
P2O5
|
AL2O3
|
Завдання № 4 «Третій зайвий»Яка формула зайва? Чому?зА правильну відповідь — 1бал)
Завдання №5 «Буде –не буде»
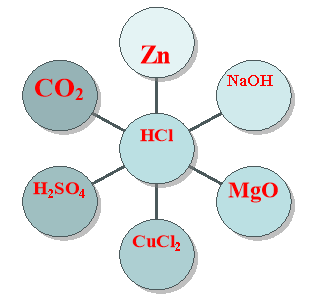
Пропонується з»єднати стрілочками центральну речовину зтими речовинами ,які будуть з нею взаємодіяти. Записати рівняння цих реакцій.Хто справиться з цим завданнямю.іде до дошки і записує ці рівняння і захищає їх.( 3Бали)
Завдання№ 6 «Неуважний хімік»(3 бали)
(За правильну відповідь — 1бал) На дошці записано рівняння реакцій, в яких допущено помилки. Учням пропонується ліквідувати їх. Враховуються час і правильність виконання.
СаО+НС1 = СаС1 + НО
НС1 + АgNО = АgСІ + НNО
![]()
Zn + CuSO4=ZnSО+Н
Завдання№ 7 «Розпізнай мене»
Які мають виявити хімічні речовини. Кожна правильна відповідь оцінюється в 1 бал.
Проводиться стисле опитування ТБ.
Техніка безпеки — це не жарти!
Правила поводження пам'ятати варто
Під час лабораторної роботи І в побуті, щоб не було турботи,—
Як працювати з кислотою,
Штативом, склом та лугом...
І хімія тоді завжди Буде вашим другом!
Видано речовини:Розчин натрій карбонату(1),хлоридна кислота(2),натрій гідроксид(3).
Реактиви: метилоранж,фенолфталеїн, сульфатна кислота,універсальний індикаторний папір
- кислоту
- основу
- сіль
Завдання №8 «Чорний ящик»(2 бали)
„У цьому ящику є речовина, яку вважають милістю господньою,
символом добробуту й миру у східних народів."
„Ні, це не милість господня, а кара божа. Скільки всього живого
згубила ця речовина! Через неї навіть море стало мертвим.”
Без неї не можуть жити люди, не може обійтися металургія, її вико-ристовують під час виготовлення кераміки, без неї не було б
шкіряних чобітків. Вона використовується у сільському господарстві,
медицині, побуті. Від неї залежить склад крові."
Так що ж знаходиться у цьому ящику?
(Відповідає хто перший підняв руку.
Показують(NaCl.)
Завдання 9«Домашнє завдання « Застосування солей»
А це знайома вам сода(NaНС03). Зараз ви почуєте приклад ситуації, у якій
сода може реально знадобитися.
На базар з'їжджались люди,
Звідусіль та відусюди.
Хто везе сюди бичка,
Хто сметанки й молочка.
А Панас мудріший всіх:
Звечора корів здоїв.
По бідонах все розлив.
Та на бричку погрузив.
Ніч темнесенька була,
Як встало сонце з-за бугра,
На базар Панас рушив,
Повну бричку загрузив.
Сонце по небу спішило,
Трохи молочко зігріло.
Щоб в хазяйки не збіжало,
Як поставить на плиту,
Соди в молоко чимало
Додаси він мав мету.
Все зробив, приїхав вчасно,
Файне місце застовпив.
Розклада продукти рясно,
Фартух білий вже надів.
Поспіша хазяйка справно.
Що? Почому? Все пита.
Сира вже купила трохи
Та три літри молока.
З бутля трохи відпила.
Та питає: „звідкіля
В молоці цей дивний смак?
Може соди клав дивак?"
„Ні, - Панас промовив мирно –
Яка сода, мила тітко?"
Тітка поправля берет,
З торби дістає оцет.
Кілько крапель в молоко, -
Зашипіло, потекло...
Панас очі відвернув,
Гроші тітці повернув.
Всі бідони погрузив.
Та й додому потрусив...
Всі йдемо до магазину!
Роздивляємось вітрину!
Порозмислим, порахуєм
І швиденько все купуєм!
Будуть раді малюки,
Будуть раді їх батьки.
Українське пропонуєм
І виробника шануєм!
Завдання№10 Казковий лабіринт
Ми ще раз переконалися в тому, що у світі речовин існують певні закономірності.
Н3РО4 ,Р, Сa3(Р04 )2 ,Р 2О5
(Ці речовини утворюють генетичний ряд Фосфору).
Р -> Р 2О5 -> Н3РО4 – Сa3(Р04 )2
Завдання 11»Розв»яжіть задачуЯкий Рб»єм водню (н.у)можна добути під час взаємодії 13 г цинку із сульфатною кислотою?
Дано: Розв»язування
M(Zn)=13г m=n·M n= m|M V(Zn)=65u\моль
_____________ М=n/ Vm Vm=22,4 л/моль
1.Знаходимо кількість речовини цинку за формулою:
N (Zn)=13/65=0,2моль
2.Складаємо хімічне рівняння.
Zn+H2SO4= ZnSO4 +H2
v((H2 )=0.2·22,4 л/моль=4/48л.
Відповідь:4,48 л
Конкур 11 «Хто швидше» (Сульфатна, Хлоридна, ортофосфатна,карбонатна)
В печері ховаються хижі та агресивні звірі Які кидаються на рухомий об»ект.
Їх лють можна приборкати якщо правильно назвати
Конкур 12 „Хімічний марафон”
За три хвилини скласти як найбільше формул з таких хімічних елементів:
Nа, Н, О, К, S, Р. Сполуки класифікувати за класами.
Оксиди: Na2О, К2О, Н20, SО2, SО3, Р2О3, Р2О5.
Основи:NaОН, КОН.
Кислоти: Н3PO4, Н2SО4, Н2S, Н2SО3.
Солі: Na3РО4, Na2SО4, К3РО4, К2SО4, К2S, Na2S, Na2S03, К2 SО3.
(21 формула, кожна по 0,5 балів).

. Самостійна робота Варіант І Рівень І
1. Знайдіть формулу оксиду.
а) КОН;
б) СО2;
в) ВаF2,.
2. Назвіть кислоту НСЇ.
я) Хлоридна;
б) нітратна;
в)сульфатна.
3. Знайдіть формулу хлориду.
а) КСІ;
б) К2S;
в) NаВг.
Рівень II
4. Виберіть реакцію заміщення.
а)Fe+S=FeS
б) 2HgO+C=2Hg+CO2
в)ZnCi2 +2KOH=Zn(OH)2 +2 KCI
5. Виберіть одноосновну кислоту.
а) НF;
б) Н2S04;
в) Н3Р04.
6. Колір лакмусу в кислоті:
а) червоний;
б) відсутній;
в) синій.
Рівень ПІ
7. Оксид ZпО:
а) кислотний;
б) амфотерний;
в) основний.
8. Рівняння утворення кислоти:
а) 2Сu + О2->2СuО
б) SО3 + Н2О->Н2SО4
в) Zп + 2НС1-=ZпС12+Н2
9. Речовина, з якою реагує вода:
а) мідь;
б) калій;
в) водень.
Рівень IV
10. Реакція, в якій бере участь амфотерний оксид:
а) ВаО + 2НСІ-»ВаС12 + Н2О
б) SО3 + Н2О->Н2SО4
в) Zп + 2НС1-=ZпС12+Н2
II. Кислота, яка не розчиняється у воді:
а) силікатна;
б) хлоридна;
в) фосфатна.
12. Гідроксид синього кольору:
а) Сa(ОН)2 ;б); Fе (ОН)3; в) Си(ОН)2.
Учитель. Отже, ми завершили нашу подорож. Я сподіваюся, що вам вона запам'ятається. І ті знання, які ви сьогодні узагальнили, повторили, надалі стануть вам у пригоді.
Загальній підсумок. III.
. Оцінювання учнів.
IV. Домашнє завдання
Повторити властивості оксидів, кислот, основ і солей.
1


про публікацію авторської розробки
Додати розробку
