Урок хімії "Окисно-відновні реакції" 9 клас
Тема: Окисно-відновні реакції, їхнє значення.
Мета: Розкрити роль окисно-відновних реакцій в природі, техніці та житті людини; продовжити відпрацювання навичок визначати ступені окиснення елементів, окисник і відновник в рівняннях реакції, урівнювати реакції методом електронного балансу, розвивати пізнавальну активність учнів, хімічну мову, мислення, сприяти розширенню їх світогляду, формувати життєві компетенції; виховувати творче ставлення до практичного використання знань з хімії.
Обладнання: Електронний посібник «Хімія, 9 клас» (Інститут передових технологій), презентація «Окисно-відновні реакції», акумулятор, «чорна» скриня.
Тип уроку: закріплення і вдосконалення знань, умінь і навичок.
Базові поняття і терміни: ступінь окиснення, окисно-відновна реакція, окисник, відновник, процес окиснення, процес відновлення, метод електронного балансу.
Хід уроку
І. Організаційний етап
Розминка
Почати урок хочу словами нашого славного земляка, відомого українського філософа, педагога Г. С. Сковороди: «З усіх скарбів знання — найкращий. Його не можна ні вкрасти, ні згубити, ні знищити».
ІІ. Оголошення теми і завдань уроку
Підготуємо зошити до роботи, запишемо дату та тему уроку. Не забувайте, що під час вивчення кожного письмового предмету, в тому числі й хімії, ми вчимося охайно, правильно працювати з діловими паперами, що знадобиться нам у багатьох видах професійної діяльності, тому пишіть правильно, розбірливо, охайно.
(Робота буде здійснюватися в групах, в яких завдання різних рівнів: А, Б, В; попереджуванні завдання для учнів, в кінці уроку індивідуальний підсумок.)
Сьогодні на уроці ви познайомитеся з окисно-відновними реакціями.
Завдання:
- з’ясувати роль окисно-відновних реакцій в природі, техніці, житті людини;
- вирішити проблему “Окисно-відновні реакції – добро чи зло?”
- вдосконалити вміння визначати ступені окиснення, записувати схеми процесів окиснення та відновлення, урівнювати хімічні рівняння методом електронного балансу.
Нас чекає напружена і цікава робота, девізом якої нехай стануть слова видатного педагога Д.І.Писарєва «Знання складаються з дрібних крихт щоденного досвіду».
ІІІ. Актуалізація опорних знань
Робота з карткою біля дошки
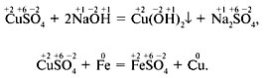
Хімічний диктант (взаємоперевірка)
- Реакції, що відбуваються з виділенням теплоти, називають …
- Реакції, що відбуваються з поглинанням теплоти, називають …
- Реакції, що відбуваються за участю каталізаторів, називають …
- Реакції, що відбуваються зі зміною ступенів окиснення деяких елементів, називають …
- Реакції, що відбуваються одночасно в обох напрямках (прямому і зворотному), називають …
- Реакції, що перебігають практично до кінця в одному напрямку, називають…
- Реакції, в яких з одної складної речовини утворюється декілька інших, називають …
- Реакції, в яких з дві складні речовини обмінюються своїми складовими частинами, називають…
- Реакції, в яких атоми простої речовини утворюється одна, називають…
- Реакції, в яких атоми простої речовини змінюють атоми у складній речовині, називають…
ІV. Осмислення, узагальнення і систематизація знань
- Вчитель. Наше життя постійно супроводжується хімічними реакціями. Як ви гадаєте серед них багато окисно-відновних чи мало? Це ми з вами з’ясуємо на нашому уроці.
До окисно-відновних реакцій належить багато природних процесів.
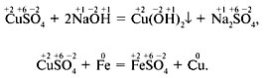
Вчитель. Чи змінилися ступені окиснення елементів у цих реакціях?
Учень. У першім рівнянні ступеня окиснення елементів не змінилися, а в другому змінилися – у міді й заліза.
Вчитель. Друга реакція ставиться до окисно-відновних. Спробуйте дати визначення окисно-відновних реакцій.
Учень. Реакції, у результаті яких змінюються ступені окиснення елементів, що входять до складу реагуючих речовин і продуктів реакції, називають окисно-відновними реакціями.
Учні записують у зошиті під диктування вчителя визначення окисно-відновних реакцій.
Вчитель. Що ж відбулося в результаті окисно-відновної реакції? До реакції в заліза був ступінь окиснення 0, після реакції стала +2. Як бачимо, ступінь окиснення підвищився, отже, залізо віддає 2 електрона.
У міді до реакції ступінь окиснення +2, після реакції – 0. Як бачимо, ступінь окиснення понизився. Отже, мідь ухвалює 2 електрона.
Залізо віддає електрони, воно є відновником, а процес передачі електронів називається окисненням.
Мідь ухвалює електрони, вона – окиснювач, а процес приєднання електронів називається відновленням.
Запишемо схеми цих процесів:
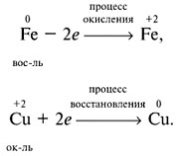
Отже, дайте визначення понять "відновник" і "окисник".
Учень. Атоми, молекули або іони, які віддають електрони, називають відновниками.
Атоми, молекули або іони, які приєднують електрони, називають окисниками.
Вчитель. Яке визначення можна дати процесам відновлення й окиснення?
Учень. Відновленням називають процес приєднання електронів атомом, молекулою або іоном.
Окисненням називають процес передачі електронів атомом, молекулою або іоном.
Учні записують під диктування визначення в зошит і замальовують малюнок.
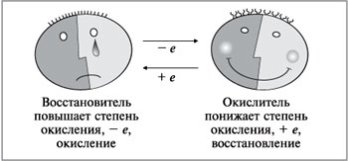
Запам'ятаєте!
Віддати електрони – окиснити.
Придбати електрони – відновитися.
Учитель. Окиснення завжди супроводжується відновленням, і навпаки, відновлення завжди пов'язане з окисненням. Число електронів, що віддаються відновником, дорівнює числу електронів, що приєднуються окиснювачем.
Для добору коефіцієнтів у рівняннях окисно-відновних реакцій використовують два методи – електронного балансу й електронно-іонного балансу (метод напівреакцій).
Ми розглянемо тільки метод електронного балансу. Для цього використовуємо алгоритм розміщення коефіцієнтів методом електронного балансу (оформлений на аркуші ватману).
Дослід (демонстраційний)
Zn + HCl =
Чи є ця реакція окисно-відновна? (запис на дошці і в зошиті)
Речовини, що є окисниками або відновниками в багатьох реакціях, називаються типовими. Вивішується таблиця, виконана на аркуші ватману.
|
Типові окиснювачі: F2, Cl2, Br2, I2, O2, H2SO4, HNO3, MnО2, KMnO4, K2CrO4 Типові відновники: Н2, C, метали, Н2S, CO, SO2, HI, FeSO4. |
Вчитель. Вивчаючи хімічний зв'язок і будову речовини ви зустрічалися з ОВР. Ці реакції здійснюються в живій природі і не живій, і мають велике значення для науки. Яке ж значення цих процесів у природі? Давайте згадаємо біологію.
- Завдяки чому відбувається скорочення м’язів?
- У яких процесах життєдіяльності організмів відбувається ОВР? Назвіть їх.( фотосинтез, дихання)
- Робота в групах
І група. В центрі нашого селища встановлено пам’ятник Невідомому солдату. Ви, певно, звернули увагу, що на ньому почав виступати зеленуватий наліт. Як він утворився?
Довідковий матеріал. На пам'ятниках Тарасу Шевченку, Богдану Хмельницькому в Києві, Петру І в Санкт-Петербурзі (названому «Мідним вершником»), зроблених із бронзи (сплаву міді з оловом) утворюється зелений наліт, який періодично зчищають. Хімічних змін зазнає навіть срібло. Всі знають, що із часом срібні предмети темніють. Але найбільшого впливу кисню на відкритому повітрі за підвищеної вологості зазнає залізо. Іржа «з'їдає» не менш ніж 20 % від усієї його кількості, що виробляється, а це — мільйони тонн. Явище руйнування металів унаслідок хімічних реакцій з речовинами навколишнього середовища називають корозією.
Залізо, перебуваючи за звичайних умов на повітрі, повільно реагує водночас із киснем і водою (водяною парою). Таке перетворення можна описати схемами:
Fе + О2 + Н2О → Fе(ОН)2
Fе(ОН)2 + О2 + Н2О → Fе(ОН)3
Мідь реагує відразу з трьома речовинами: киснем, водою (водяною парою) і вуглекислим газом, що є у повітрі:
Сu + О2 + H2O + CO2→ (СuОН)2СО3
ІІ група. Чи замислювались ви, чому картини стародавніх майстрів, наприклад Рафаеля, Леонардо да Вінчі, Фрагонара, мають таку темну палітру?
Довідковий матеріал. У старовину багато картин писали масляними фарбами, до складу яких входили деякі сполуки Плюмбуму, наприклад, основний карбонат Рb3(ОН)2(СО3)2 - свинцеві білила. Під дією сірководню, що є в повітрі, свинцеві білила перетворювалися на чорний плюмбум(ІІ) сульфід, тому картини поступово тьмяніли:
Рb3(ОН)2(СO3)2 + H2S →PbS + Н2О + СО2.
Для реставрації картини поверхню її слід обробити будь-яким окисником, наприклад гідроген пероксидом:
РbS + Н2О2 → РbSО4 + Н2О.
Зараз через свою отруйність свинцеві білила в масляних фарбах майже не застосовуються.
ІІІ група. Що запропонував Ю. В. Кондратюк на світанку космічної ери використовувати як ефективне паливо для ракет?
Довідковий матеріал. Ю. В. Кондратюка (Шаргея) вважають одним з корифеїв астронавтики. Саме його роботи та розрахунки були використані американськими вченими для підготовки та організації першого пілотованого польоту на Місяць. Ю.В. Кондратюк запропонував як високоефективне пальне для ракет метали та деякі їх сполуки. Виявляється, що для виготовлення металевого пального придатні літій, магній, алюміній, рідкісноземельні метали, цирконій, а особливо берилій. Металеве пальне на основі берилію має один з найвищих питомих імпульсів, адже внаслідок згоряння 1 кг цього легкого металу вивільнюється 15900 ккал енергії.
Ве + О2 → ВеО.
Метали для ракетних двигунів можна використовувати в розплавленому, розпиленому вигляді, а також у вигляді суспензії в рідкому пальному. Так, колоїдне берилієве пальне може з успіхом замінити вибухонебезпечну суміш рідких водню й озону, яку також винайшов Ю. В. Кондратюк.
IVгрупа. Завдяки чому люди довгий час можуть перебувати на підводних човнах, космічних станціях, тобто там де немає доступу повітря?
Довідковий матеріал. Незамінними окисно-відновні реакції у забезпеченні космічного корабля, підводного човна киснем. Для регенерації вуглекислого газу на кисень використовують екімолярну суміш пероксидів калію і натрію (ν(Na2O2) : ν(K2O4)= 1:1), щоб тиск в апараті залишався незмінним.
Na2O2 + CO2 → Na2CO3 + O2
K2O4 + CO2 → K2CO3 + O2
3.Підведення підсумків роботи в групах
Запис відповідних схем окисно-відновних реакцій на дошці.
Вчитель. ОВР стали невід’ємним ланцюгом перетворень багатьох технічних процесів, що спонукає до створення нових приладів. Не менш важливими є ОВР, що використовуються в техніці, хімічній промисловості (виробництво ![]() ,
, ![]() ) та металургії (одержання чистих металів з руд).
) та металургії (одержання чистих металів з руд).
Робота в групах:
Завдання.
Скласти рівняння окисно – відновних реакцій.
І група
II група
ІІІ група
IV група
(Перевірка завдань)
VI. Підсумки уроку
- Усне заповнення схеми «Окисно-відновні реакції»
-
Відповідь на проблемне запитання «Окисно-відновні реакції: добро чи зло?» - Гра «Мікрофон»
Скажіть, будь ласка, що вам сподобалося, запам’яталось, що нового і корисного ви винесете з цього уроку?
- Оцінювання роботи учнів на уроці.
VIII. Домашнє завдання:
- Спробуйте скласти сенкан за правилом: 1-й рядок – іменник, 2-й рядок – два прикметники, 3-й – два дієслова (дія), 4-й – фраза, що виражає ваше особисте ставлення до теми, 5-й – синонім до назви, теми – одне слово.
Додаток
|
І група Виробництво сульфатної кислоти здійснюють у три стадії, дві з яких ОВР. І стадія: випалювання сульфідів, найчастіше піриту. ІІ стадія: одержання сульфур VІ оксиду
А – визначити ступіні окиснення; Б – визначити відновник та окисник; В – підібрати коефіціенти методом електронного балансу (пояснити); |
|
ІІ група
Виробництво
І стадія: одержання Нітроген (ІІ) оксиду з амоніаку ІІ стадія: перетворення його на Нітроген (ІV) оксид
ІІІ сталія: одержання нітратної кислоти з Нітроген (ІV) оксиду
А – визначити ступіні окиснення; Б – визначити відновник та окисник; В – підібрати коефіціенти методом електронного балансу (пояснити); |
|
ІІІ група Різноманітні відновники використовуються в металургії, наприклад одержання заліза у доменних печах:
А – визначити ступіні окиснення; Б – визначити відновник та окисник; В – підібрати коефіціенти методом електронного балансу (пояснити);
|
|
ІV група Так утворюється чавун
А – визначити ступіні окиснення; Б – визначити відновник та окисник; В – підібрати коефіціенти методом електронного балансу (пояснити); |


про публікацію авторської розробки
Додати розробку

