Урок хімії у 9 класі з теми "Хімічні властивості алканів"
Тема. Реакції обміну між розчинами електролітів. Умови їх протікання
Мета. На основі знань про розпад електролітів на йони розглянути реакції обміну; розвинути поняття про реакції обміну на якісно новому рівні; розкрити суть реакцій йонного обміну, з’ясувати причини та умови їх проведення; навчити учнів складати повні та скорочені,
рівняння реакцій йонного обміну, пояснювати їх суть з позицій електролітичної дисоціації; формувати вміння, проводити хімічні досліди, робити узагальнюючі висновки про умови, за яких реакції йонного обміну відбуваються до кінця.
Засоби навчання:
віртуальні лабораторні досліди: реакції обміну між розчинами електролітів, що відбуваються з утворенням осаду, виділенням газу, утворенням малодисоційованих сполук.
Форми навчання: фронтальна бесіда, гра, групова робота, комп’ютерне тестування.
Обладнання: таблиця розчинності солей, кислот та основ у воді; мультимедійний проектор комп’ютери з тестовими програмами, віртуальний дослід, мультимедійна вчительська презентація.
Тип уроку: комбінований урок
Хід уроку
І. Організація класу.
ІІ. Активізація і мотивація навчальної діяльності.
Сьогодні ми з вами продовжуємо дізнаватися нове про дисоціацію. А точніше про її широке практичне застосування.
Адже всі живі організми, що оточують нас, — велика біолабораторія, де відбуваються сотні тисяч хімічних реакцій, серед яких і ті , про які ми будемо говорити сьогодні на уроці.
Ці реакції проходять у живих організмах: рослинних, тваринних та людському.
За допомогою них підтримується в клітинах живих організмів клітинний потенціал.
Рослини засвоюють поживні речовини, наприклад, мінеральні добрива з водного розчину, де вони перебувають у вигляді йонів.
У разі порушення обміну речовин відбувається нагромадження одних йонів і зменшення інших. Наприклад, коли у шлунку збільшується кількість гідроген-йонів, виникає підвищена кислотність шлункового соку, що призводить до різних захворювань.
Тож, знання про ці реакції мають велике практичне значення. А значить нам потрібно добре розібратися. Мабуть ви вже здогадалися що це за реакції?
(варіанти відповідей)
Слайд №2 (тема і завдання уроку)
А зараз перевіримо: готові ми гарно засвоїти нову тему. Для цього перевіримо запас наших знань.
- Фронтальна бесіда
- • Що таке «електролітична дисоціація»?
- • Які речовини називають електролітами?
- Які речовини можуть бути електролітами?
- • Які електроліти бувають за силою?
- Як визначити силу електроліту?
- Що таке ступінь дисоціації?
- Дайте визначення реакції обміну.
- Виконання індивідуальних та групових завдань
- По одному учню від групи займають місце за комп’ютером, де проходять тестування по темі «Дисоціація»
- А всі учні в групах працюють над завданням за виборо. (Консультанти, у разі потреби, надають допомогу )
(усна перевірка виконання завдання в групах)
Відпочинемо і зіграємо в гру «Плутанина»
(Робота зі слайдом) Вибрати, які йони не можуть існувати в розчині одночасно.
- Перевірка виконання завдання за слайдом. Зробити висновок про випадки реакцій обміну, що відбуваються до кінця.
(записати в зошити)
ІІІ. Вивчення нового матеріалу.
1.Віртуальний дослід №1 «Виділення газу»
Аналіз протікання реакції. Написання рівняння за поясненням вчителя на дошці)
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑;
2Na+ + CO32- + 2H+ + 2Cl- = 2Na+ + 2Cl- + H2O + CO2↑;
CO32- + 2H+ = H2O + CO2↑.
2. Віртуальний дослід №2. «Випадіння осаду»
Аналіз протікання реакції. Самостійне покрокове написання рівняння (за слайдом) 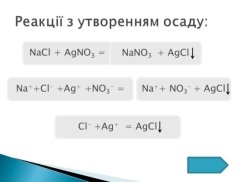
3.Віртуальнйи дослід №3. «Утворення малодисоційованої речовини (води)»
Аналіз досліду. Написання рівняння учнями на дошці.
Ba(ОН)2 + 2НС1 = BaСІ2 + 2Н2О.
Ba+ +2 ОН- + 2Н+ + 2СІ- = Ba+ + 2СІ- + 2Н2О;
2ОН- + 2Н+ = 2Н2О, або
ОН- + Н+ = Н2О.
IV. Закріплення вивченого, узагальнення знань.
- Із запропонованих реакцій вибрати ті, що відбуваються докінця.
- Рівняння №1 записати в повному та скороченому йонному виглдяді.
- Два останні рівняння записати в зошит, а вдома написати повні і скорочені молекулярні рівняння.
V. Підсумки уроку
- В чому суть реакції йонного обміну.
- В яких випадках реакція йонного обміну відбувається до кінця.
VІ. Домашнє завдання.
Опрацювати параграф 8
Напишіть молекулярні повні та скороченні йонні рівняння між речовинами (Рівняння 3,4)
Переглянути відео урок «Йонні рівняння» на сайті школи і записати рівняння, запропоновані на цьому уроці.


про публікацію авторської розробки
Додати розробку
