Урок "Хімічні властивості кисню. Реакції сполучення. Поняття про оксиди"
Хімія 7 клас № Дата:
Тема: Хімічні властивості кисню: взаємодія з вугіллям, сіркою, фосфором. Реакції сполучення. Поняття про оксиди
Мета: ознайомити учнів з хімічними властивостями кисню на прикладі його взаємодії з вугіллям, сіркою, фосфором; закріпити й розширити знання учнів про хімічні реакції, уміння складати рівняння хімічних реакцій з участю кисню; дати уявлення про реакції сполучення та про оксиди як складні речовини; розвивати увагу, спостережливість та логічне мислення; виховувати самостійність та активність.
Очікувані результати:
- Учні ознайомляться з хімічними властивостями кисню на прикладі його взаємодії з вугіллям, сіркою, фосфором та зможуть їх охарактеризувати;
- Закріплять і розширять знання про хімічні реакції;
- Вмітимуть складати рівняння хімічних реакцій з участю кисню;
- Матимуть уявлення про реакції сполучення та про оксиди як складні речовини;
- Будуть уважними, спостережливими та логічно мислитимуть під час виконання вправ;
- Будуть самостійними та активними на уроці.
Тип уроку: комбінований.
Форми роботи: розповідь, відео-демонстраційний експеримент, фронтальне опитування.
Обладнання: відеоматеріали про одержання кисню та про взаємодію кисню з сіркою, вугіллям і фосфором, періодична система хімічних елементів Д.І.Менделєєва
Міжпредметні зв’язки: з біологією
ХІД УРОКУ
І. Організація класу
ІІ. Актуалізація опорних знань
- Перевірка домашнього завдання
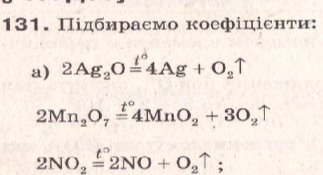
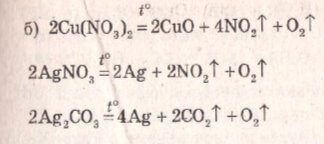
- Тестування
1. Формула простої речовини кисню:
а) О3; 6) О; в) О2.
2. У процесі дихання кисень:
а) поглинається; б) виділяється в) не використовується.
3. У лабораторії кисень одержують:
а) шляхом розкладу калій перманганату; б) з рідкого повітря;
в) розкладаючи воду.
4. Якщо у пробірку із киснем внести жевріючу скіпку, то вона:
а) погасне; б) горить менш інтенсивніше;
в) горить без змін; г) спалахує.
5. Відносна атомна маса Оксигену:
а) 16; б) 32; в) 48.
6. У процесі фотосинтезу кисень:
а) поглинається; 6) виділяється; в) не використовується.
7. Агрегатний стан кисню за стандартних умов:
а) твердий; б) рідкий; в) газоподібний.
8. На малюнку зображено дослід, що демонструє добування кисню у лабораторії:
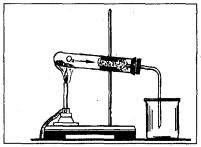 а) з калій перманганату;
а) з калій перманганату;
б) з перекису водню;
в) з води.
- Актуалізаційна бесіда
Джозеф Прістлі якось взяв,
Окись ртуті нагрівав,
І побачив дивний газ
Він без кольору, без назв,
Краще свічка в нім горить
А чи дихати ним можна?
Скаже тобі кожний.
Новий газ із колби вийшов
Не знайомий він нікому.
Ним же дихають і миші
Під закритим ковпаком.
А людині , як потрібний,
Безколірний, ну і що ж?
І в окисненні він рідний
Для життя він необхідний.
Як він зветься повсякчас?
Киснем зветься кожен раз.
- Чому ви вважаєте, що це є кисень?
Кисень- це газ без кольору і запаху, підтримує процеси горіння і дихання.
III. Мотивація навчальної діяльності
- Розповідь
Проста речовина кисень підтримує горіння. Кисню, що міститься в повітрі, досить для горіння дров у багатті, природного газу в грубці, вугілля в каміні тощо. Якщо використовувати для горіння чистий кисень, воно відбувається інтенсивніше.
- Оголошення теми і завдань уроку
На цьому уроці ми розглянемо процес взаємодії кисню з деякими простими речовинами, тобто вивчимо хімічні властивості кисню. (Запис числа і теми в зошити)
IV. Вивчення нового матеріалу
Спалювання неметалів (фосфору, вуглецю, сірки) у повітрі й кисні
Дослід 1. Взаємодія кисню з фосфором (під витяжкою)
У ложку для спалювання речовин набираємо червоний фосфор, підпалюємо його, вносимо в склянку, заповнену киснем. Що спостерігаємо?
З’являється білий димок, це утворюється сполука Фосфору з Оксигеном. Запишемо рівняння реакції.
4Р + 5О2->2Р2О5
Висновок. Кисень унаслідок нагрівання енергійно взаємодіє з деякими речовинами, при цьому виділяється тепло і світло.
Такі реакції називаються реакціями окиснення.
Окиснення — це хімічна реакція взаємодії речовин (простих і складних) з киснем.
Горіння — це хімічна реакція, за якої відбувається окиснення речовин з виділенням тепла і світла. У більшості випадків у результаті цих реакцій утворюються оксиди.
Оксиди — це складні речовини, що складаються з двох елементів, один з яких — Оксиген з валентністю II.
Розгляньмо ще приклади взаємодії кисню з простими речовинами.
Дослід 2. Взаємодія кисню з вугіллям
Чистий вуглець – це вугілля.
У ложку для спалювання речовин кладемо вугілля і вносимо його в полум’я спиртівки. Вугілля розігрівається, але не загоряється. У суміші з азотом повітря кисень взаємодіє з вугіллям повільно.
Тепер внесемо ложку з розігрітим вугіллям у склянку, заповнену киснем. Вугілля швидко згоряє. У колбі нічого не залишається? Куди поділося вугілля?
С + О2 = СО2
В разі недостатньої кількості кисню утворюється інша сполука Карбону з Оксигеном – чадний газ СО:
2С + О2 = 2СО
Наллємо в ту ж склянку вапняної води, вона каламутніє. Ця реакція використовується для виявлення в повітрі вуглекислого газу.
Висновок. У чистому кисні реакція горіння відбувається інтенсивніше.
Дослід 3. Взаємодія кисню із сіркою. У ложку для спалювання речовин набираємо сірку, спалюємо на повітрі й у кисні. На повітрі блакитнувате полум’я стелиться на поверхні сірки, процес протікає повільніше. У кисні — яскраве полум’я, процес швидший. Заповнюємо склянку водою, підфарбованою індикатором метиловим оранжевим, вода змінює колір.
Учень записує рівняння горіння сірки в кисні: S+ О2 = SО2
Дослід 4. Взаємодія кисню повітря з магнієм
Магнієві ошурки закріплюємо в щипцях, нагріваємо в полум’ї пальника і спостерігаємо реакцію горіння. Записуємо рівняння: 2Мg + О2 = 2МgО
— До якого типу можна віднести реакції горіння? (До реакцій сполучення)
Реакції сполучення — це реакції, в результаті яких із двох речовин утворюється одна складна.
Висновок: кисень взаємодіє з металами й неметалами.
V. Закріплення матеріалу
- № 136 ст.110
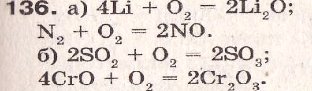
- № 138 ст.110

- № 139 ст.110
![]()
- № 140 ст.110

- № 141 ст.110
![]()
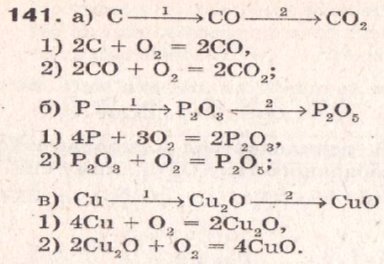
VI. Підбиття підсумків та оцінювання
1) Що ми вивчили на уроці?
2) Чим сподобався вам урок? Чим саме?
3) Ваші побажання щодо подальшого проведення уроків хімії?
VII. Домашнє завдання
Вивчити §18. Повторити § 16-17.
На 3 бали - № 135 ст.110
На 6 балів - № 137 ст.110
На 9 балів - № 142 ст.110
На 12 балів - № 142 -143 ст.110
Підготуватися до практичної роботи.
Лист самооцінювання
|
№ |
Вид роботи |
Максимальна кількість балів |
Ваш бал |
|
1 |
Домашнє завдання |
По 0,5 |
|
|
2 |
Тестування |
По 0,5 |
|
|
3 |
Уріняння реакцій на дошці під час вивчення нового матеріалу |
По 0,5 |
|
|
4 |
Усні відповіді на запитання вчителя |
По 1 |
|
|
5 |
Тренувальні вправи: № 136 |
По 1 |
|
|
6 |
№ 138 |
По 1 |
|
|
7 |
№ 139 |
По 1 |
|
|
8 |
№ 140 |
По 1 |
|
|
9 |
№ 141 |
По 1 |
|
|
|
Всього |
|
Оцінка: |


про публікацію авторської розробки
Додати розробку
