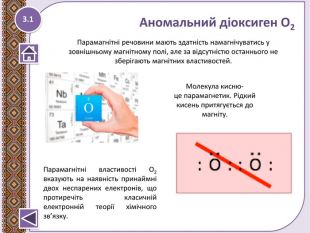
Урок. "Хімічний зв’язок і будова речовини. Природа хімічного зв’язку. Електронегативність елементів. Полярний і неполярний ковалентний зв’язок."
ТЕСТОВІ ЗАВДАННЯ ДО ЕЛЕКТРОННОГО УРОКУ
Формат 1 (Так/Ні).
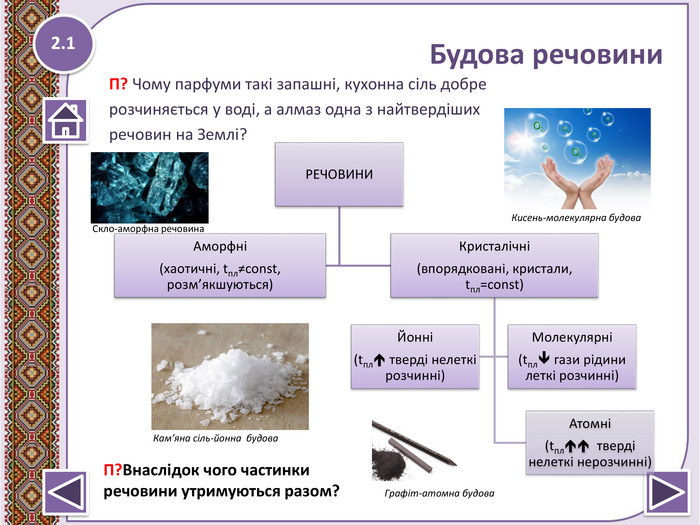
Електронна густина ковалентного зв’язку в молекулі сірководню H2S зміщена в бік Гідрогену?
- Так
- Ні *
Формат 2 (один з багатьох).
Найбільш електронегативним елементом є:
- Fr
- O
- Cl*
- H
- Ca
Ковалентний неполярний зв’язок характерний для кожної з двух речовин:
- Гідроген хлорида та аммоніака
- Азота та кисню*
- Літій оксида та літій гідроксида
- Вуглекислого газу та сірководню
Зв’язок, що утворюється за рахунок однієї чи декількох спільних електронних пар називається:
- Ковалентним*
- Водневим
- Іонним
- Металічним
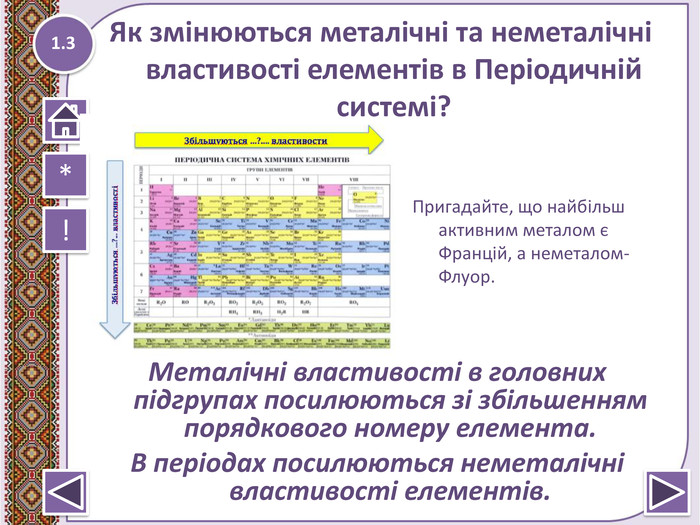
Електронегативність Сульфуру більша ніж електронегативність :
- Хлора
- Флуора
- Фосфора*
- Оксигена
Деяка речовина, складається з двох неметалів, зв’язок між ними ковалентний, за звичайних умов це газ. Оберіть цю речовину:
- NaCl
- CuCl2
- K2O
- HBr*
Формат 3 (багато з багатьох).
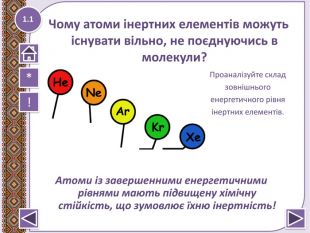
Із поданого переліку хімічних елементів виберіть ті два, електронна структура яких відповідає правилу октета:
- Флуор
- Натрій
- Аргон*
- Кальцій
- Сульфур
- Неон*
Ковалентний полярний зв‘язок характерний для наступних трьох молекул:
- Гідроген хлорид*
- Метан*
- Алюміній карбід
- Феррум оксид
- Сірководень*
Із поданого переліку виберіть два вірні твердження:
- Чим вище електронегативність елемента R, тим вище полярність зв’язку R-F в його фториді
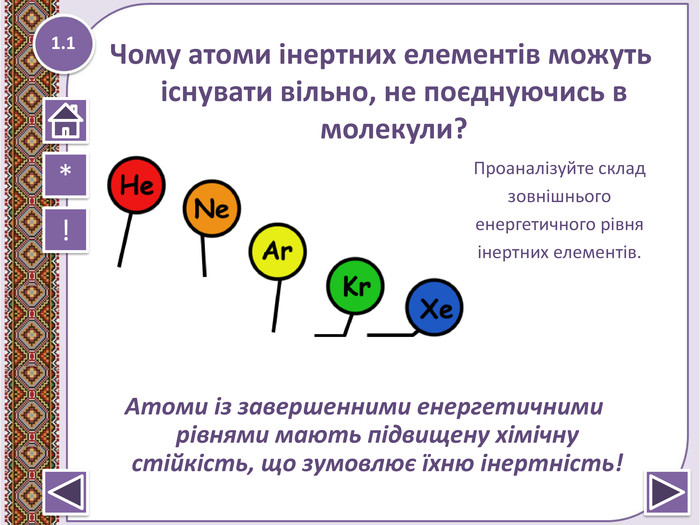
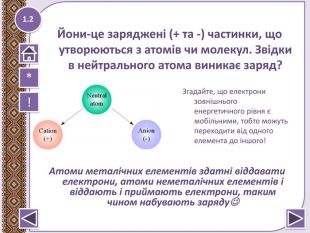
- Під час утворення хімічного зв’язку атоми елементів прагнуть набути конфігурації найближчого інертного елемента*
- Іонний зв’язок виникає між атомами неметалічних елементів
- При утворенні ковалентного неполярного зв’язку спільна електронна пара зміщується до одного з неметалів
- Найменшу температуру плавління мають речовини молекулярної будови*
Формат 4. (послідовність)
Під час взаємодії атомів неметалів, що мають різну електронегативність, виникає ковалентний полярний зв’язок. Чим більша різниця електронегативностей атомів що взаємодіють, тим більша полярність зв’язку. Розташуйте наступні хімічні зв’язки в напрямку збільшення їх полярності:
- H-H
- C-H
- C-Cl
- Н-Cl
Формат 5 (Відповідність).
Визначте правильну відповідність між формулою сполуки та типом хімічного зв’язку:
|
1 O3 |
1 ковалентний неполярний |
|
2 CaCl2 |
2 іонний |
|
3 HF |
3 ковалентний полярний |
|
4 Zn |
4 металічний |
|
|
5 водневий |
Визначте правильну відповідність між формулою сполуки та типом будови:
|
1 Кисень |
1 Молекулярна кристалічна гратка |
|
2 Кварц |
2 Атомна кристалічна гратка |
|
3 Калій сульфат |
3 Іонна кристалічна гратка |
|
|
4 Аморфна речовина |
|
|
|
ТЕМА: Хімічний зв’язок та будова речовини. Природа хімічного зв’язку. Електронегативність атомів. Види хімічного зв’язку. Полярний та неполярний хімічний зв’язок.
- Заповніть пропуски в тексті.
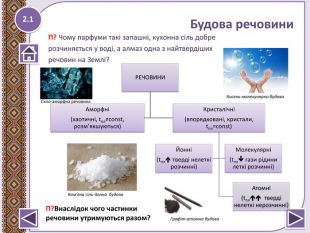
За будовою речовини поділяють на 1__________ та 2______________. Перші не мають впорядкованої структури, постійних температур плавлення та кипіння. До таких речовин належить 3_______. Другі поділяють на три різновиди: 4________, йонні та молекулярні. 4__________ речовини тверді, нерозчинні в воді, мають високі температури плавлення (алмаз, графіт) ; йонні речовини 5__________ розчіняються у воді, тверді, мають 6__________ температури плавлення (7_________); молекулярні речовини зазвичай леткі, газувати, рідини, тверді, запашні, мають 8_________ температури плавлення ( 9____________).
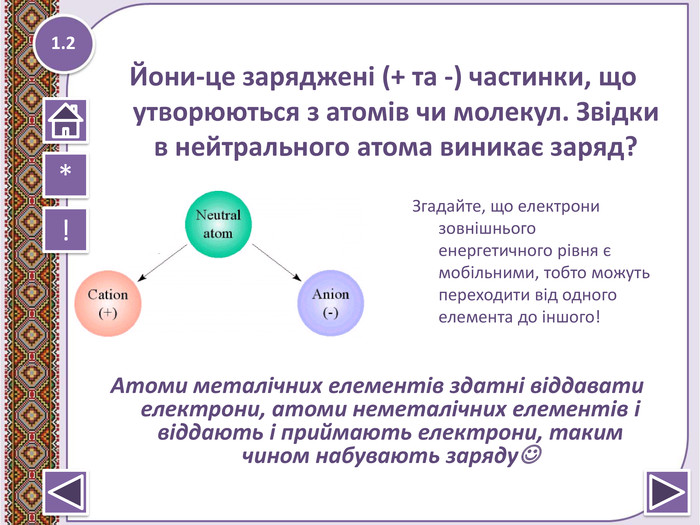
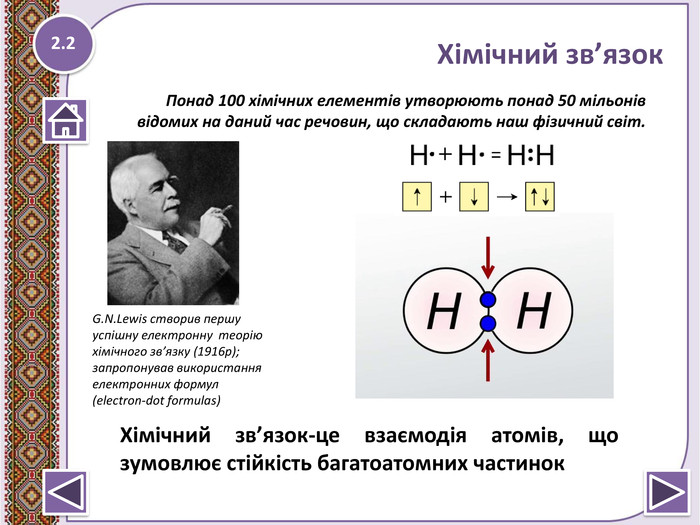
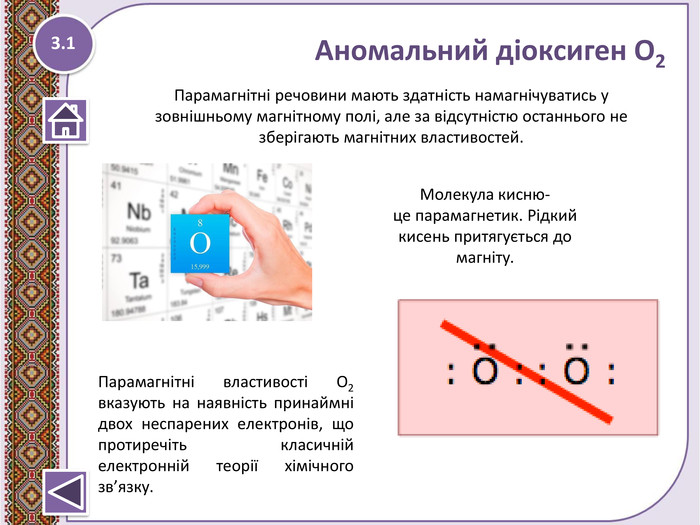
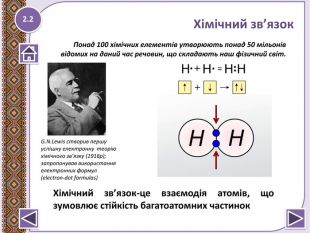
Хімічний зв’язок-це взаємодія атомів, що зумовлює стійкість багатоатомних частинок.
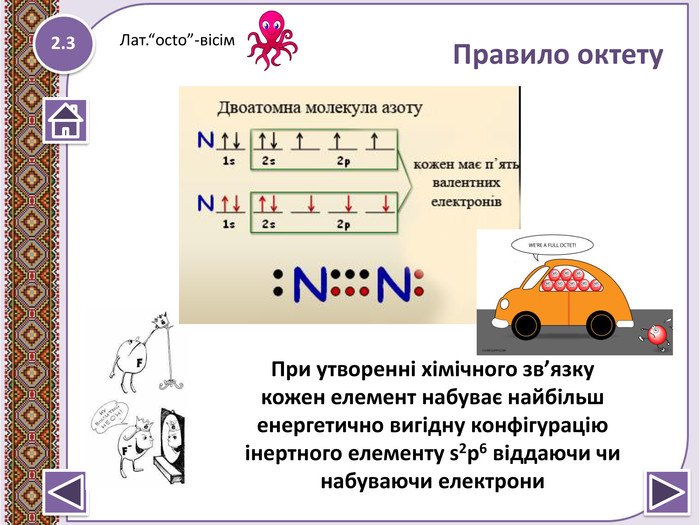
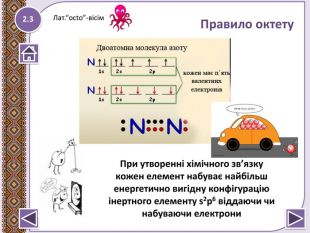
Правило октету “При утворенні хімічного зв’язку кожен елемент набуває найбільш енергетично вигідну конфігурацію інертного елементу s2p6 віддаючи чи набуваючи електрони”
2. Складіть схему утворення зв’язку в молекулі Cl2. Поясніть на даному прикладі правило октету.
Сl))) 1s- 2s- 2p- 3s-3p- (доповніть електронні формули)
|
|
|
|
|
(складіть електронно-графічну схему утворення зв’язку)
|
|
|
|
|
Сl))) 1s- 2s- 2p- 3s-3p- (доповніть електронні формули)
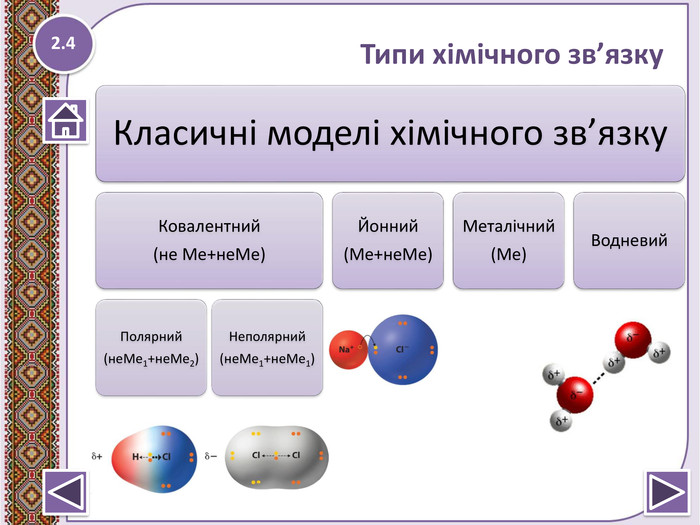
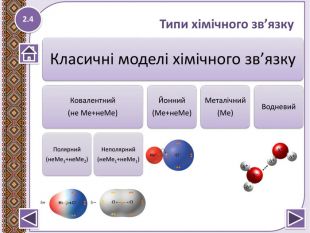
Типи зв’язку
|
Тип зв’язку |
Ковалентний |
Йонний |
Металічний |
Водневий |
|
|
Полярний |
Неполярний |
||||
|
Особливості утворення |
неМе1+неМе2 |
неМе1+неМе1 |
Ме+неМе |
Ме |
Між полярними молекулами |
|
Приклади речовин |
|
|
|
|
|
Електронегативність-це здатність атомів хімічних елементів притягувати спільні електронні пари.
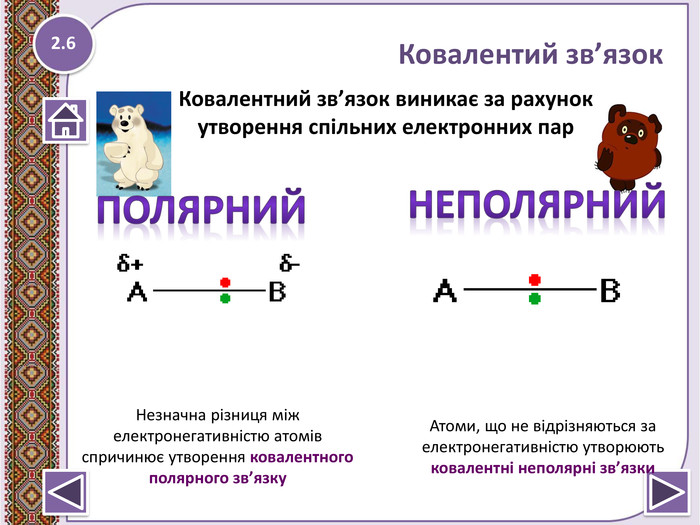
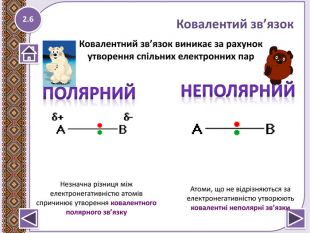
Ковалентний зв’язок- виникає за рахунок утворення спільних електронних пар.
3. Покажіть розташування спільної електронної пари при утворенні ковалентного полярного зв’язку в молекулі НCl та ковалентного неполярного зв’язку в молекулі Сl2.
H-----Cl Cl-----Cl


про публікацію авторської розробки
Додати розробку