Урок ХІМІЯ 9 клас " Узагальнення знань з теми Класифікація хімічних реакцій"
Тема: Узагальнення знань з теми «Хімічні реакції»
Мета уроку:
Знаннєвий компонент – сформувати знання і розуміння суті понять: хімічна реакція, ступінь окиснення, окисник, відновник, процеси окиснення і відновлення, тепловий ефект реакції, швидкість хімічних реакцій; наводить приклади основних типів хімічних реакцій; відновників і окисників.
Діяльнісний компонент – навчити визначати ступені окиснення елементів у сполуках за їхніми формулами, розрізняти реакції сполучення, заміщення, обміну, розкладу; окисно-відновні та реакції без зміни ступеня окиснення; екзо- та ендотермічні, оборотні й необоротні реакції; окисники і відновники; валентність і ступінь окиснення елемента; складати хімічні формули бінарних сполук за ступенями окиснення елементів; рівняння найпростіших окисно-відновних реакцій на основі електронного балансу, термохімічні рівняння; рівняння оборотних і необоротних реакцій; класифікує реакції за різними ознаками; характеризувати процеси окиснення, відновлення, сполучення, розкладу, заміщення, обміну; вплив різних чинників на швидкість хімічних реакцій; роль окисно-відновних процесів у довкіллі; застосовувати закон збереження маси речовин для складання рівнянь хімічних реакцій.
Ціннісний компонент – навчити обґрунтовувати процеси окиснення та відновлення з погляду електронної будови атомів; висловлювати судження про значення хімічних реакцій та знань про них у природі, промисловості, побуті.
Розвивати ключові компетентності:
- Спілкування державною мовою: навчити використовувати в мовленні хімічні терміни, поняття, символи, сучасну українську наукову термінологію і номенклатуру; формулювати відповідь на поставлене запитання.
- Екологічна грамотність і здорове життя: навчити усвідомлювати причинно-наслідкові зв’язки у природі і її цілісність; використовувати хімічні знання для пояснення користі і шкоди здобутків хімії для людини.
- Інформаційно-цифрова компетентність: сфопмувати уміння критично співставляти і оцінювати хімічну інформацію з різних інформаційних ресурсів.
- Основні компетентності у природничих науках і технологіях: розвивати уміння пояснювати природні явища, процеси в живих організмах на основі хімічних знань; виконувати проекти, використовуючи знання з біології; використовуючи міжпредметні контекстні завдання.
- Уміння вчитись впродовж життя: формувати уміння організовувати самоосвіту з хімії: визначати мету, планувати, добирати необхідні засоби; виконувати навчальні проекти хімічного й екологічного змісту.
- Ініціативність: навчати виявляти здатність до роботи в команді, бути ініціативним, генерувати ідеї, брати відповідальність за прийняття рішень, вести діалог задля досягнення спільної мети під час виконання хімічного навчального проекту.
Реалізовувати наскрізні змістові лінії:
- «Екологічна безпека і сталий розвиток»: усвідомлювати причинно-наслідкові зв’язки у природі і її цілісність;
- «Громадянська відповідальність»: ознайомити учнів зі здобутками вітчизняних учених та їхньою громадянською позицією, навчити працювати в команді, відповідально ставитись до завдань, визначених колективом, та ретельно виконувати свою частину роботи;
- «Здоров'я і безпека»: навчити дотримуватися правил безпечного поводження з речовинами і матеріалами в лабораторії, побуті й довкіллі; сформувати обізнаність із заходами безпеки під час реакції горіння, маркованням небезпечних речовин;
- «Підприємливість і фінансова грамотність»: націлити учнів на мобілізацію знань, практичного досвіду і ціннісних установок у ситуаціях вибору і прийняття рішень.
Очікувані результати навчально-пізнавальної діяльності учнів:
- характеризують процеси окиснення та відновлення, вплив різних чинників на швидкість хімічних реакцій, роль окисно-відновних процесів у довкіллі;
- класифікують хімічні реакції;
- висловлюють судження про значення хімічних реакцій та знань про них у природі, промисловості та побуті;
- усвідомлюють причиннно-наслідкових зв’язків у природі та її цілісності, значення хімічних реакцій та знань про них у природі;
- оцінюють розвиток вітчизняного виробництва на основі досягнень хімічної науки, вміння працювати в команді;
- дотримуються запобіжних заходів під час відновно-окислювальних процесів.
Тип уроку: урок узагальнення й систематизації знань.
Форма проведення: урок-гра.
Форми роботи: робота з мультимедійними засобами навчання, робота в малих групах, колективна, індивідуальна робота і в парах.
Обладнання: Періодична система хімічних елементів Д.І Менделєєва, таблиця розчинності, ряд активності металів, картки-завдання, мультимедійні засоби навчання (проектор, комп’ютер ).
«Збиратися разом – це початок, триматися разом – це процес, працювати разом – це успіх»
Г. Форд
ХІД УРОКУ
І. Організаційний етап
Привітання, побажання хорошого настрою.
Рефлексія. Вчитель пропонує всім учням провести вправу « Світлофор» (заздалегідь вчитель має покласти на парту три паперові фігури: червоного, жовтого та зеленого кольору – Додаток 1). Учні вибирають один із трьох кольорів.
Червоний – страх, переживання, погане самопочуття.
Жовтий – байдужість, спокій.
Зелений – гарний настрій, готовність до роботи).
ІІ. Етап перевірки виконання домашнього завдання
ІІІ. Актуалізація і мотивація навчальної діяльності
Сьогоднішній урок ми проведемо у формі гри. Наша мета – узагальнити і систематизувати знання про класифікацію хімічних реакцій за різними ознаками з метою підготовки до контрольної роботи; удосконалити вміння працювати самостійно, допомагати іншим та працювати в групах.
IV. Узагальнення та систематизація набутих знань
1. Плакат думок (приклад малюнок 1)
Потрібно об’єднати учнів у пари чи групи (3-4). Гарний різновид вправи для інтровертів, тих, хто не любить публічно виступати чи краще сприймає інформацію візуально. В центрі плакату або А4 учні пишуть слово «Реакції» і потім добирають всі терміни, які пов’язані з даним терміном. Людина, яка пише термін, має обов’язково пояснити як він зв’язаний з ключовим словом.

Рис.1. Плакат думок
1. Мозковий штурм
Учням по черзі вчитель (або вибраний вчителем учень) задає питання дуже швидко. Учні мають дуже швидко відповідати на їх. Ніхто не має права виправляти, якщо відповідь на запитання неправильна. Тільки після закінчення обговорюються невірні відповіді.
Запитання:
- Реакція під час перебігу якої з декількох речовин утворюється одна- … (Сполучення)
- Ступінь окиснення флуору (-1)
- Реакція, між двома складними речовинами, в результаті якої утворюються дві нові складні речовини (Обміну)
- Зміна концентрації речовини за одиницю часу (Швидкість хімічної реакції)
- Кількість теплоти, що виділяється або поглинається під час хімічної реакції (Тепловий ефект реакції).
- Рівняння, у якому вказано тепловий ефект - (Термохімічне)
- Стан, коли швидкість прямої реакції дорівнює швидкості зворотної реакції (Хімічна рівновага)
- Біологічний каталізатор - … (Фермент)
- Атом, молекула або йон, які приєднують електрони (Окисник)
- Атом, молекула або йон, які віддають електрони (Відновник)
- Ступінь окиснення простої речовини (0)
- Реакція, яка проходить з виділенням тепла (екзотермічна)
- За зміною ступенів окиснення реакції є (окисно-відновні та без зміни ступенів окиснення)
- Ступінь окиснення цієї групи елементів або 0, або + (металічні)
- Хімічні реакції в моєму житті
Клас ділиться на групи по 4-6 учнів в кожній. Всі отримують однакове завдання – написати, де в нашому житті проходять хімічні реакції і які саме. Написати хімічне рівняння, урівняти та класифікувати його за всіма вивченими класифікаціями. Можна використовувати гаджети.
- Якнайшвидше і найвірніше
Індивідуальна робота – завдання відрізняються за складністю, тому вчитель роздає їх згідно можливостей учнів ( 1 рівняння -1 учень). В завданні необхідно проставити ступені окиснення, розставити коефіцієнти згідно методу електронного балансу, вказати окисник/відновник та процеси окиснення/відновлення.
Окисно - відновні реакції
1. H2S + K2Cr2O7 + H2SO4 → S + Cr2(SO4)3 + K2SO4 + H2O.
2. PbO2 +MnSO4 + H2SO4 → HMnO4 +PbSO4 + H2O.
3. MnO2 + KClO3 + KOH → K2MnO4 + KCl + H2O.
4. NaCrO2 + Br2 + NaOH → Na2CrO4 + NaBr + H2O.
5. K2Cr2O7 + SnSO4 + H2SO4 → Cr2(SO4)3 + Sn(SO4)2 + H2O + K2SO4 .
6. Mg + H2SO4 → MgSO4 + H2S + H2O.
7. Cu + HNO3 → Cu(NO3)2 + NO2 + H2O.
8. Ni + H2SO4 → NiSO4 + SO2 + H2O.
9. Fe + HNO3 → Fe(NO3)3 + NO + H2O.
10. Co + HNO3 → Co(NO3)2 + N2 + H2O.
- N2 + O2 → NO
- NO + O2 → NO2
- Zn + HCl →ZnCl2 + H2
- C +O2 → CO
- C+ O2 →CO2
- Mg + HСl = MgСl2 + H2
- Інтерактивні ігри (біля інтерактивної дошки (можна й працювати в гаджетах).
Учні розбиваються по групах - 2-3 учні в кожній.
Режим доступу до ігор: https://learningapps.org/7906181
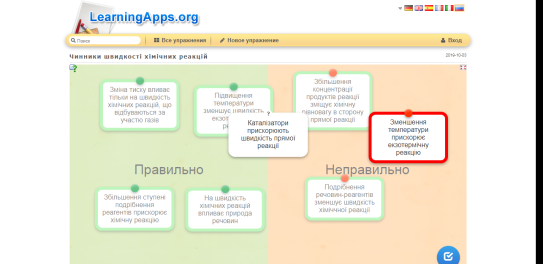
Рис.2. Гра «Чинники швидкості хімічних реакцій»
Режим доступу: https://learningapps.org/4475664

Рис.3. Гра «Хімічні реакції»
Режим доступу: https://learningapps.org/4667981
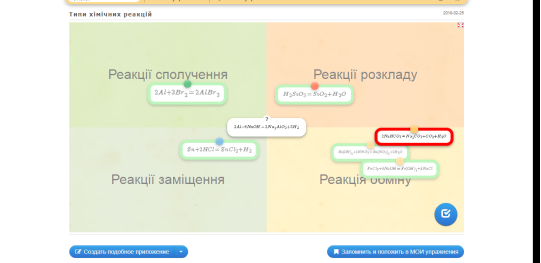
Рис.4. Гра «Типи хімічних реакцій»
- Пройти тест на сайті https://quizizz.com: https://quizizz.com/admin/quiz/5dc6d97883f16a001b7324b4/-
Всім учням класу необхідно зайти на сайт та ввести код (шестизначне число). Всі учні класу автоматично розподіляються на чотири команди. На екрані дошки чітко видно успіхи своєї команди. По закінченню гри школярі бачать якість своєї роботи не тільки в групі, а й особисто своїх знань.
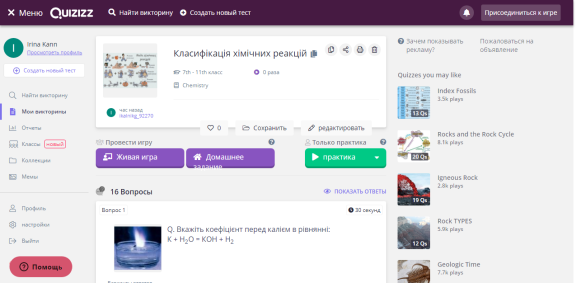
Рис.5. Вхід на сайт та вигляд тесту
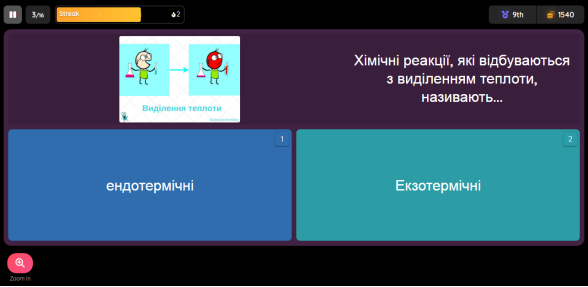
Рис.6. Вигляд тесту на екрані учня
Рис.7. Звіт тестування
V. Підведення підсумків. Оцінювання роботи учнів
VІ. Домашнє завдання
- Повторити конспекти з теми «Хімічні реакції» та підготуватись до контрольної роботи.
- Гра « Чорна скринька» На демонстраційному столі стоїть чорна скринька, в якій знаходиться певна хімічна речовина.
Учням даються 3 твердження про цю речовину. На наступний урок вони мають сказати, що там. Якщо відповідь відсутня, вчитель надає ще два твердження про цю речовину.
Твердження:
- Речовину вперше отримав К. Шеєле і продемонстрував вулкан з її участю.
- Речовина є сильним окисником, часто її називають хімічним хамелеоном.
- ЇЇ розчин використовують в медицині як антисептик.
- ЇЇ розчин – якісний реактив в органічній хімії.
- Темно фіолетові кристали використовують для добування кисню в лабораторії.
Рефлексія Вчитель пропонує всім учням знову провести вправу « Світлофор».
Додаток 1



Додаток 2
Окисно - відновні реакції
|
H2S + K2Cr2O7 + H2SO4 → S + Cr2(SO4)3 + K2SO4 + H2O |
|
PbO2 +MnSO4 + H2SO4 → HMnO4 +PbSO4 + H2O |
|
NO + O2 → NO2 |
|
C +O2 → CO |
|
C+ O2 →CO2 |
|
Zn + HCl →ZnCl2 + H2 |
|
Mg + HСl = MgСl2 + H2 |
|
N2 + O2 → NO |
|
Co + HNO3 → Co(NO3)2 + N2 + H2O |
|
Fe + HNO3 → Fe(NO3)3 + NO + H2O |
|
Ni + H2SO4 → NiSO4 + SO2 + H2O |
|
Cu + HNO3 → Cu(NO3)2 + NO2 + H2O |
|
Mg + H2SO4 → MgSO4 + H2S + H2O |
|
K2Cr2O7 + SnSO4 + H2SO4 → Cr2(SO4)3 + Sn(SO4)2 + H2O + 2SO4 |
|
NaCrO2 + Br2 + NaOH → Na2CrO4 + NaBr + H2O |
|
MnO2 + KClO3 + KOH → K2MnO4 + KCl + H2O |


про публікацію авторської розробки
Додати розробку
