Урок "Карбонатна кислота"
Епіграф: „... Розум полягає не тільки в знанні,
але й умінні застосовувати знання на практиці”.
(Давньогрецький філософ Аристотель)
Тема заняття: Карбонатна кислота. Солі карбонатної кислоти, їх поширеність у природі та застосування. Принцип дії вогнегасника
Мета: використовуючи інтерактивні технології, дослідити склад та властивості карбонатної кислоти, на основі знань про загальні властивості кислот і солей з’ясувати умови взаємного перетворення карбонатів, розширити знання про кислі солі на прикладі гідроген карбонатів, формувати вміння складати рівняння відповідних реакцій; навчити розпізнавати карбонат – іони в розчині, стимулювати творчі здібності студентів; розвивати навички робити логічні підсумки, виділяти головне, розвивати інтерес до предмету; формувати навички екологічно грамотної поведінки в побуті, виховувати любов і повагу до природи, до процесів, що відбуваються в ній, формувати дбайливе ставлення до навколишнього середовища.
Повинні знати: характерні та специфічні властивості карбонатної кислоти; якісну реакцію на карбонат-іон, застосування карбонатів і принцип дії вогнегасника.
Повинні вміти: складати рівняння реакцій, які ілюструють хімічні властивості карбонатної кислоти.
Тип заняття: комбінований
Форма роботи: індивідуальна, захист міні-презентацій.
Обладнання: періодична система хімічних елементів Д.І. Менделєєва, таблиця розчинності кислот, основ і солей у воді, зразки карбонатів: крейда, мармур, вапняк, сода, черепашки молюсків, яєчна шкарлупа, перлини, відео – досліди.
І. Організаційний момент.
Перевірка наявності учнів та їх підготовки до заняття.
ІІ. Актуалізація опорних знань. Мотивація навчальної діяльності
Сьогодні на занятті ми будемо не тільки хіміками, а й слідчими особової справи. Ми з’ясуємо чи насправді були причетні солі карбонатної кислоти до смерті великої цариці Єгипту Клеопатри. І, хоча, пройшло дуже багато часу, саме сьогодні настав той момент, коли хімія допоможе пролити світло на цю історичну подію, яка довгий час була вкрита оманою.
Постановка завдання
Що відбулося в ті далекі часи?
„... Вона вийняла з вуха одну з тих величезних перлин і... опустила перлину в вино (оцет). Настало мовчання, приголомшені гості, завмерши, спостерігали, як незрівнянна перлина повністю розчиняється в міцному вині(оцті). Ось від неї не залишилося і сліду, і тоді Клеопатра підняла келих, покрутила його, збовтуючи вино, і випила його до останньої краплини.”
(Уривок із роману Г.Р. Хаггарда „Клеопатра”)
Невдовзі після цього Клеопатру знайшли мертвою в її оселі, що ж стало причиною смерті великої богині Єгипту?».
- Який напій випила Клеопатра?
- Чому перлина розчинилася?
Що потрібно знати, щоб дати відповіді на ці питання? (Учні висловлюють ідеї).
Сьогодні ми будемо вивчати склад будову та властивості карбонатна кислота та її солі.
ІІІ. Вивчення нового матеріалу
1. Молекулярна формула кислоти, фізичні властивості
Н2СО3 – слабка кислота, у розчині встановлена рівновага системи:
Н2О + СО2 Н2СО3 Н2О + СО2
За яких умов рівновага буде зміщуватися в бік утворення карбонатної кислоти? (Підвищення тиску, зниження температури)
У водних розчинах карбонатна кислота – слабкий електроліт:
Н2О + СО2 Н2СО3Н+НСО3-2Н+ + СО32- - рівновага значною мірою зміщена ліворуч.
2. Добування кислоти (відео дослід)
Коментар викладача
Добути карбонатну кислоту можна розчинивши вуглекислий газ у воді. Для цього візьмемо шматочок мармуру або вапняку, крейди та опустимо його в пробірку. Зверху доллємо кілька мл хлоридної кислоти. Спостерігатимемо за бурхливим виділенням бульбашок газу. Газ буде виділятися по газовідвідній трубці, кінець якої опустимо в посудину з водою. В воду додамо лакмус і будемо спостерігати за зміною забарвлення лакмусу. В нейтральному середовищі лакмус залишається фіолетовим. При утворенні розчину кислоти лакмус стає червоний. Отже в хімічному стакані утворився розчин карбонатної кислоти.
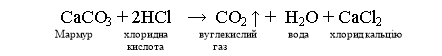
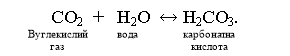
3. Хімічні властивості
Карбонатна кислота - одна із найбільш слабких кислот. Вона двохосновна і тому дисоціює ступінчато.
І. Н2СО3 Н+ + НСО-3 – гідрогенкарбонат – іон
ІІ. НСО-3 2Н+ + СО32– - карбонат – іон
Відповідно до цього двохосновна карбонатна кислота утворює два ряди солей:
кислі – гідрогенкарбонати (NаНСО3)
середні – карбонати (Nа2СО3)
Карбонатна кислота проявляє властивості характерні кислотам.
- Реагує з активними металами
- Реагує з оксидами металів
- Реагує з основами
- Солі карбонатної кислоти та їх практичне значення
Ми з вами продовжуємо знайомитися з солями карбонатної кислоти та їх практичним значенням. (Складаємо опорний конспект у вигляді таблиці).
|
Характеристики |
Середні солі |
Кислі солі |
|
Загальна назва |
Карбонати |
Гідрогенкарбонати |
|
Приклади |
Na2CO3 натрій карбонат CaCO3 кальцій карбонат |
NaHCO3 натрій гідрогенкарбонат Ba(HCO3)2 барій гідрогенкарбонат |
|
Відношення до Н2О |
Розчинні тільки карбонати лужних металів та NН4+ |
Розчинні майже всі |
|
При прожарюванні |
Розкладаються тільки нерозчинні СаСО3 = СаО + СО2↑ |
Всі 2NаНСО3 = Nа2СО3 + Н2О + СО2↑ |
- Взаємоперетворення карбонатів і гідрогенкарбонатів.
(відео дослід)
Коментар викладача
Поклади СаСО3 + дощова вода + СО2
↓ СаСО3↓ + Н2О + СО2 = Са(НСО3)2
Са(НСО3)2 у воді + температура (або час)
↓ Са(НСО3)2 = СаСО3↓ + Н2О + СО2
накип (осад)
- Практичне значення карбонатів і гідрогенкарбонатів.
Студенти підготували міні – презентацій (випереджувальне завдання).
А тепер всі перегляньте, будь ласка, таблицю « Практичне застосування солей карбонатної кислоти» і запишіть її.
« Практичне значення солей карбонатної кислоти»
|
Формула |
Технічна назва |
Практичне значення |
|
СаСО3 |
Кальцій карбонат а) крейда
б) мармур в) вапняк |
Будівництво, фармакологія; скляна та гумова промисловість Будівництво, скульптура Будівництво, одержання вапна СаО |
|
СаСО3·MgСО3 |
Доломіт |
Вогнетривкий матеріал |
|
Nа2СО3 |
кальцинована сода |
Виробництво скла, мила |
|
Nа2СО3·10Н2О |
кристалічна сода |
Текстильна промисловість |
|
К2СО3 |
поташ |
У виробництві тугоплавкого скла, мила, фотографій. |
|
NаНСО3 |
питна сода
|
У медицині, харчовій промисловості. |
- Якісна реакція на карбонат – іон
(відео дослід)
Коментар викладача
В пробірку насипаємо кілька шматочків мармуру або крейди і доливаємо розчин хлоридної кислоти. Спостерігаємо бурхливе виділення бульбашок газу. Підносимо до отвору пробірки палаючий сірник, а він тухне. Тому що виділяється вуглекислий газ, а він не підтримує горіння. Отже, якісною реакцією на солі карбонатної кислоти є взаємодія з розчинами кислот.
СаСО3 + 2НСl → С02 ↑ + H2O + CaCl2
Мармур хлоридна вуглекислий вода хлорид кальцію
кислота газ
Іонне рівняння:
Са2+ +СО3 2-+ 2Н+ + 2Сl- → С02 ↑ + H2O + Ca2+ + 2Cl –
СО32- + 2Н+ → СО2↑ + Н2О
Ми вже знаємо склад, властивості карбонатної кислоти і зможем дати відповіді на питання поставлені на початку заняття.
- Який напій випила Клеопатра? (Вино яке прокисло і в ньому утворився оцет - кисле середовище).
- Чому перлина розчинилася? (Перлина - природний карбонат кальцію СаСО3)
(І ми знаючи властивості карбонатної кислоти та її солей також можемо провести аналогічну реакцію. Тільки нам треба кисле винне середовище замінити хлоридною кислотою HCI, а природній карбонат кальцію, яким була перлинка замінити карбонатом кальцію, як то мармур або вапняк).
Ми можемо з певність сказати, що та дивовижна перлина не була повинна в смерті цариці. Кажуть, так королі розчиняли перли в вині, в яких є органічні кислоти. Зараз ми трошки відчули себе справжніми королями.
- Принцип дії вогнегасника
(відео)
Коментар викладача
Переходимо до розгляду останнього пункту плану – принцип дії вогнегасника.
Вуглекислотний вогнегасник заповнюють зрідженим вуглекислим газом. Під час переходу з рідкого стану в газоподібний вуглекислота збільшується в об'ємі в 400—500 разів, що супроводжується різким охолодженням до температури -72 °С і частковою кристалізацією. Щоб уникнути обмороження рук, не слід торкатися металевого розтруба.
Вогнегасник використовується для гасіння пожеж, спричинених електроприладами, у транспорті, музеї, картинних галереях, архівах.
(Демонстрація вогнегасника.)
Складові компоненти вогнегасника:
1. Стальний балон;
2. Пусковий пристрій (нажимного типу);
3. Сифонна трубка (подає вуглекислий газ із балона);
4. Розтруб (утворювач снігу);
5. Ручка (для перенесення).
Для приведення в дію вогнегасника необхідно:
1-й крок — розтруб (утворювач снігу) спрямувати на вогнище;
2-й крок — натиснути на важіль пускового пристрою.
Запишіть складові частини вогнегасника.
ІV. Закріплення знань
- Що поєднує перлину, мармур, вапняк, крейду, яєчну шкарлупу, панцери найпростіших?
- Прийом «Встав пропущені символи»
а) Ca(OH)2 + … → CaCO3↓ + H2O (СО2)
б) МgCO3 → … + СО2↑ (МgО)
в) Са(HCO3)2 → … + CO2↑ + H2O(СаСО3)
г) … + НСl → BaCl2 + CO2↑ + H2O (ВаСО3)
VІ. Узагальнення та систематизація
- Прийом «Доповніть речення»
Формула карбонатної кислоти ……(Н2СО3).
За здатністю до дисоціації карбонатна кислота належить до …… електролітів.(Слабкий).
Якісною реакцією на карбонати є взаємодія з ……(Сильними кислотами).
При розчиненні у воді …… утворюється карбонатна кислота. (СО2).
Крейда, мармур, вапняк – все це ……. (Карбонати).
Карбонатна кислота утворює два ряди солей ……(Кислі та середні).
При термічному розкладанні карбонатів утворюється …… газ. (СО2)
Формула магній карбонату …..(МgСО3).
Формула натрій гідроген карбонату ….NаНСО3
2. Цікаві завдання.
- Незнайко знав що палаючи предмети можна гасити водою та піском. Знайко порадив як більш ефективний засіб питну соду. Чи згодні ви з ним?
(Відповідь:2NаНСО3→Nа2СО3 +СО2++Н2О.)
- Незнайко занедужав. Доктор Пилюлькін порекомендував йому полоскати горло розчином питної соди. І попередив, щоб Незнайко не розчиняв її в киплячій воді. «А чому це не можна робити?» - запитав себе малюк.
(Відповідь:22NаНСО3→Nа2СО3 +СО2++Н2О.)
- Як обчистити яйце, не розбиваючи його?
(Відповідь: обробити розведеним розчином оцтової
або хлоридної кислоти.)
VІІ. Підведення підсумків
Ми сьогодні з вами дослідили хімічні властивості карбонатної кислоти та іі солей, відчули себе в ролі не тільки хіміків, а й в ролі в ролі царів, які вживали дивовижні напої. Підведіть підсумки своєї роботи, визначте свій статус.
Скажіть будь ласка, що вам сподобалось, запам’яталось, що нового і корисного ви винесете з цього занятті?
Рефлексія
- Я дізнався …
- Я навчився …
- Мені сподобалося …
- Мене здивувало …
VIII. Домашнє завдання
- § 13 П.П. Попель, Л.С. Криля Хімія 10 клас
- Виконати вправи № 127,128
- Підготуватися до лабораторної роботи №4 ст..96-97
- Творче завдання: підготувати повідомлення про будівельні матеріали, письмово – повідомлення на одну із тем:
- Виготовлення скла: історія розвитку.
- Види скла його застосування,
- Кераміка її застосування.
- Цемент, бетон – фундамент сучасного будівництва


про публікацію авторської розробки
Додати розробку
