Урок "Кількість речовини. Моль. Число Авогадро"
Тема: Кількість речовини. Моль — одиниця кількості речовини. Число Авогадро.
Мета : Освітня :
1.Забезпечити в ході уроку закріплення понять та введення нових понять " кількість речовини ", " моль - одиниця кількості речовини "; з'ясувати значення сталої Авогадро.
2.Формувати вміння користуватися набутими знаннями при розв'язуванні розрахункових задач ( на визначення кількості речовини, числа структурних частинок).
Розвиваюча:
1.Розвивати абстрактне та образне мислення учнів.
2.Розвивати самостійність та творчість учнів при розв'язуванні задач.
3.Розвивати пізнавальний інтерес учнів, включаючи в зміст уроку елементи нових знань та зв'язок їх з життям.
Виховна :
1.Сприяти в ході уроку формуванню світоглядних ідей про матеріальність світу на основі кількісної характеристики речовини.
Засоби навчання: підручник, періодична система хімічних елементів Д. І. Менделєєва; зразки різних речовин кількістю речовини 1 моль: 18мл води, 56г залізних ошурок (можна замінити іншим металом), 58,5г кухонної солі, 342г цукру, куб об'ємом 22,4л із повітрям (грань куба = 28см).
Базові поняття та терміни: атом, молекула, кількість речовини, моль, стала Авогадро.
Тип уроку: вивчення нового матеріалу.
Методи та методичні прийоми: пояснювально-ілюстративні; репродуктивні, частково пошукові, практичні.
Хід уроку:
- Організаційний момент.
- Привітання вчителя.
- Перевірка відсутніх та готовності учнів до уроку (наявність підручників, робочих зошитів, ручок тощо).
- Привернення уваги учнів.
- Мотивація навчально-пізнавальної діяльності.
Учитель зазначає, що на наступних уроках мова піде про кількісні відношення в хімії і, наголошуючи на їх важливості, наводить висловлювання
Д. І. Менделєєва щодо діяльності алхіміків: «Ошибка их исследования состояла в том, что они не мерили і не весили».
У побуті ми часто не розрізняємо поняття кількості і маси речовини. Проте це різні величини. Якщо вам купили 1 кг цукерок, то йдеться про що ? ( Про масу)
А якщо вам купили 5 шоколадок, то про що? (про кількість)
Але макаронні вироби чи сірники рахувати складно та недоцільно, тому їх продають пакетами та коробками, тобто порціями.
Оскільки розміри сірників приблизно однакові, то у всіх коробках їх буде однакова кількість.
Розміри атомів і молекул дуже маленькі, порахувати їх кількість у певній порції речовини можна, але це буде де велике число. Тому у хімії та фізиці використовують особливу величину «кількість речовини»
Не завжди важливо знати масу чи об'єм речовини. Часто набагато важливіше для визначення кількості речовини знати число окремих атомів чи молекул. У хімії, крім використання таких величин, як «маса» й «об'єм», застосовують величину «кількість речовини».
Кількість речовини — це фізична величина, яка показує, скільки найменших частинок (структурних одиниць) даної речовини — атомів, молекул, йонів, електронів тощо — міститься в тому чи іншому зразку речовини.
- Актуалізація теоретичних знань.
Бесіда.
Як ви пам'ятаєте, хімія вивчає речовини і їхні перетворення. Склад речовин виражають хімічними формулами, а суть хімічних перетворень - рівняннями реакцій.
— Яку інформацію про склад речовини надає хімічна формула?
— Як виражається кількісний склад речовини?
— Яку інформацію надає рівняння хімічної реакції?
— Як визначаються кількісні співвідношення по рівнянню хімічної
реакції?
У хімічних перетвореннях беруть участь окремі атоми або молекули речовин. Тому при вивченні хімічних перетворень важливо знати кількісні співвідношення між реагуючими речовинами.
- Виклад нового матеріалу.
Розповідь учителя.
Позначається кількість речовини : n - ( ню )
Одиницею вимірювання кількості речовини є моль( це моль, як грам для маси, літр для об’єму ). Моль – це кількість речовини, яка містить стільки структурних частин, скільки атомів міститься в 12 г Карбону.
Назва одиниці вимірювання кількості речовини походить від латинського слова " moles ", що в перекладі значить " маленька маса".
Поняття моль з’явилось значно пізніше, завдяки німецькому хіміку В.Оствальду, який тлумачив це слово як «велику масу»
Встановлено, що в 1 моль будь-якої речовини міститься 6,02٠10²³ структурних частин
1моль води - 6,02٠10²³ молекул H2O
1моль міді - 6,02٠10²³ атомів Сu
1 моль кисню - 6,02٠10²³ молекул O2.
Число 6,02٠10²³ назвали на честь відомого італійського вченого Амедео Авогадро ця величина називається " стала Авогадро " й позначається N а.
Nа = 6,02٠10²³ моль ˉ 1.
Число Авогадро – це дуже велике число. Наприклад, якби всю поверхню Землі (включаючи річки, озера, моря й океани ) вистелити рівномірним шаром такої кількості однодоларових купюр, то утворився б шар заввишки 2 метри. Проте молекули, які ми лічимо за допомогою сталої Авогадро, є дуже маленькими часточками. Якщо ми візьмемо 6٠10²³ молекул води, то навіть не зможемо наповнити склянку.
1 моль — це кількість речовини, в якій число частинок (атомів, молекул, іонів) дорівнює числу атомів Карбону, що містяться в 12г вуглецю.
Запитання вчителя до учнів:
Як ви гадаєте, якщо ми візьмемо один моль двох різних речовин, чи будуть це однакові кількості за зовнішнім виглядом? (Ні. Об'єм або маса, який буде займати 1 моль речовини, буде залежати від об'єму або маси, який займає молекула цієї речовини. Оскільки в різних речовинах різні молекули, то й об'єм, і маса 1 моль речовин будуть різні.)
Демонстрація.
Учитель демонструє різні речовини кількістю в 1 моль. Увага учнів звертається на те, що маса й об'єм 1 моль різних речовин відрізняються.
Запитання вчителя до учнів:
— Який висновок про співвідношення розмірів і мас молекул (або атомів) води, заліза, кухонної солі, цукру й газу можна зробити?
Знаючи сталу Авогадро, можна будь-яку кількість речовини виразити в молях. Якщо речовина містить N молекул (або структурних одиниць), то кількість речовини дорівнює: n= N/ NA
Навпаки, знаючи кількість речовини в молях, можна знайти число частинок:
N = n * NA
V. Первинне закріплення з коментуванням
Мета: засвоєння нового способу дії
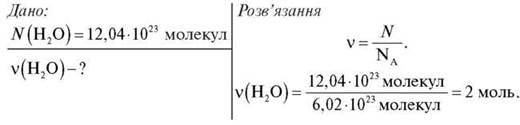
1. Обчисліть кількість речовини в порції води, що містить 12,04 · 1023 молекул води.
VІ. Узагальнення та систематизація знань.
- Самостійна робота.
Виконайте завдання. Заповніть таблицю:
|
Речовина |
n |
N |
|
Са |
1,9 моль |
? |
|
О3 |
0,5 моль |
? |
|
КОН |
? |
0,9 • 1023 |
|
НI |
6 моль |
? |
|
Н2 |
? |
21 • 1023 |
VІІ. Рефлексія.
Мета: самооцінка результатів діяльності та усвідомлення нового знання
1. Назвіть основні фізичні величини, які вивчаються в темі.
2. Назвіть основні формули теми.
3.Яке значення має ця тема для вивчення хімії.
Виставлення оцінок та їх мотивація.
VІІI. Домашнє завдання. Інструктаж з домашнього завдання.
Опрацювати §.
Виконати завдання с. . (Письмово)
Підготувати повідомлення на тему: «Амедео Авогадро і його вклад в науку - хімія»


про публікацію авторської розробки
Додати розробку
