Урок "кількість речовини. Моль – одиниця кількості речовини. Стала Авогадро".
ПЛАН-КОНСПЕКТ УРОКУ З ХІМІЇ
Виконав: студент 45 групи Безсмертний Богдан
Тема уроку: кількість речовини. Моль – одиниця кількості речовини. Стала Авогадро.
Мета уроку: сформувати уявлення учнів про хімічне поняття «кількість речовини»; показати сутність фізичної величини кількості речовини; ознайомити з одиницею вимірювання кількості речовини; увести поняття «моль», «стала Авогадро». розвивати в учнів уміння робити логічно обумовлені висновки; розвивати навчально-пізнавальний інтерес до вивчення хімії.
Тип уроку: вивчення нового матеріалу.
Обладнання та матеріали: періодична система хімічних елементів Д. І. Менделєєва; картки з завданнями; комп‘ютер, програма «Віртуальна хімічна лабораторія», демонстрація № 8.6. зразки різних речовин кількістю речовини 1 моль.
Базові поняття й терміни: атом, молекула, кількість речовини, моль, стала Авогадро.
Форми й методи: хімічний диктант, постановка проблемного питання, розповідь учителя з демонстрацією на комп’ютері, розв’язування задач, колективне складання таблиці, робота в парах.
ХІД УРОКУ
Організація класу (2-3 хвилини).
Підготовка вчителем класу до уроку. Визначення відсутніх; перевірка наявності підручників, таблиці Мендєлєєва, роздаткового матеріалу. Оголошення теми уроку.
Актуалізація опорних знань (3-4 хвилини).
Фронтальна бесіда.
- Із чого складаються всі речовини на Землі? (З атомів, молекул, іонів)
- Наведіть приклади речовин молекулярної та немолекулярної будови. (І2, Cl2; NaCl, CaF2, алмаз).
- В яких одиницях вимірюються розміри атомів? (нм, тобто 10-9 м, rа = 10-14 см, якщо атом збільшити до розміру друкарської крапки, то пропорційно збільшена людина досягала б зросту близько 7 км).
- Якою є маса атома? (Це маленька частинка, реальна маса якої оцінюється величиною порядку 10-27 -10-26 кг).
- Скільки молекул води Н2O міститься в краплі води? (Багато, порядку 1023 молекул).
Формулювання мети і завдань уроку (2-3 хвилини)
Пригадайте:
- усі речовини складаються з дуже маленьких частинок; найменші з них — атоми, для зручності ми їх уявляємо у вигляді кульок;
- атоми можуть об’єднуватися один з одним і утворювати молекули;
- кожна речовина характеризується лише їй притаманними молекулами.
Отже, сьогодні тема нашого уроку кількість речовини. Моль – одиниця кількості речовини. Стала Авогадро.
Мотивація навчальної діяльності (2-3 хвилини)
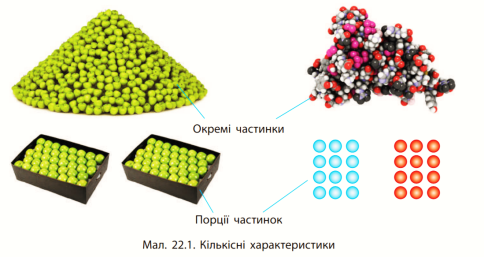
Купуючи цукерки, ми вказуємо їхню масу: скільки грамів треба зважити. Але за певних обставин знання маси або об’єму буде недостатнім. Наприклад, нам потрібно купити стільки яблук, щоб вистачило на всіх учнів у школі. Досить складно на ринку полічити тисячу чи дві тисячі яблук. Значно простішим буде полічити ящики яблук (за умови, що ми знаємо, скільки яблук міститься в одному ящику). Тобто в цьому випадку ми рахуємо не окремі частинки, а кількість груп (порцій) частинок.
Цитата: це завжди здається неможливим, поки це не буде зроблено (Нельсон Мандела).
Вивчення нового матеріалу (20-25 хвилин)
Кількість речовини. Вам відомо, що речовини мають різну будову — атомну, молекулярну, йонну. Перетворення одних речовин на інші відбуваються внаслідок сполучення атомів у молекули, розпаду молекул на атоми, перегрупування атомів або йонів. Коментуючи реакцію горіння вуглецю:
C + O2 = CO2
ви скажете, що кожний атом Карбону взаємодіє з однією молекулою кисню з утворенням молекули вуглекислого газу. Щоб підготувати хімічний дослід, немає потреби перераховувати атоми, молекули реагентів.
Це й неможливо зробити. Хіміки використовують фізичну величину, яка визначається кількістю найменших частинок речовини в певній її порції. Назва цієї величини — кількість речовини. Її позначають латинською літерою n; раніше для цього використовували грецьку літеру ν («ню»).
 Кількість речовини — фізична величина, що характеризує кількість структурних одиниць речовини (атомів, молекул, йонів тощо).
Кількість речовини — фізична величина, що характеризує кількість структурних одиниць речовини (атомів, молекул, йонів тощо).
! Моль — одиниця вимірювання кількості речовини.
Атоми й молекули дуже малі, тому не дивно, що їх у навколишньому світі незліченна кількість. Навіть у найменшому кристалі цукру міститься понад мільярд мільярдів молекул. Тому практично неможливо перераховувати окремі молекули. Для вимірювання кількості речовини використовують спеціальну одиницю — моль.
 1 моль — це така кількість речовини, що містить 6,02 · 1023 структурних одиниць цієї речовини (атомів, молекул, йонів тощо).
1 моль — це така кількість речовини, що містить 6,02 · 1023 структурних одиниць цієї речовини (атомів, молекул, йонів тощо).
Демонстрація: https://www.youtube.com/watch?v=WwKQIm8aLYg
У кожної речовини є власні структурні одиниці. Наприклад, вугілля складається з атомів Карбону, а сірка — з молекул S8. Тому зразки різних речовин кількістю речовини 1 моль мають різні маси та об’єми (мал. 22.3).


Запитання до учнів:
Який висновок про співвідношення розмірів і мас молекул (або атомів) води, заліза, кухонної солі, цукру, магнію … можна зробити?
Число Авоґадро. Число 6,02 · 1023 називають числом Авоґадро на честь італійського науковця Амедео Авоґадро. Чому саме таке число було обране для визначення моля речовини? Стільки атомів міститься у зразку вуглецю масою 12 г, що в сучасній науці використовують як стандарт для визначення атомної одиниці маси.
Зважаючи на це, можна дати ще одне визначення моля:
 1 моль — це така кількість речовини, у якій кількість частинок (атомів чи молекул) дорівнює кількості атомів Карбону 12С, що міститься в зразку вуглецю масою 12 г.
1 моль — це така кількість речовини, у якій кількість частинок (атомів чи молекул) дорівнює кількості атомів Карбону 12С, що міститься в зразку вуглецю масою 12 г.

 Числу Авоґадро чисельно дорівнює стала Авоґадро NA. Ця стала, на відміну від числа Авоґадро, виражається в одиницях на моль (1/моль або моль–1): NA = 6,02 · 1023 моль–1
Числу Авоґадро чисельно дорівнює стала Авоґадро NA. Ця стала, на відміну від числа Авоґадро, виражається в одиницях на моль (1/моль або моль–1): NA = 6,02 · 1023 моль–1
Розв’язання задач із використанням кількості речовини.
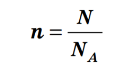 Знаючи сталу Авоґадро, можна будь-яку кількість речовини виразити в молях. Якщо речовина містить N молекул (або структурних одиниць), то кількість речовини дорівнює:
Знаючи сталу Авоґадро, можна будь-яку кількість речовини виразити в молях. Якщо речовина містить N молекул (або структурних одиниць), то кількість речовини дорівнює:
Навпаки, знаючи кількість речовини в молях, можна обчислити кількість частинок:
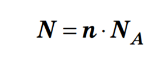
![]() Задача 1. У кімнаті міститься 2,77·1026 молекул кисню. Обчисліть кількість речовини кисню в кімнаті.
Задача 1. У кімнаті міститься 2,77·1026 молекул кисню. Обчисліть кількість речовини кисню в кімнаті.

![]() Задача 2. Обчисліть, скільки атомів Оксигену й Гідрогену містяться у воді кількістю речовини 5 моль.
Задача 2. Обчисліть, скільки атомів Оксигену й Гідрогену містяться у воді кількістю речовини 5 моль.

![]() Задача 3. У склянці міститься близько 11 моль молекул води. Обчисліть кількість молекул у склянці.
Задача 3. У склянці міститься близько 11 моль молекул води. Обчисліть кількість молекул у склянці.
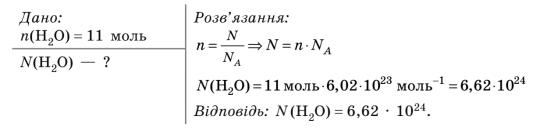
Повернімося до хімічної реакції С + О2 = СО2, згаданої на початку параграфа. Якщо вести мову не про один атом Карбону і одну молекулу кисню чи вуглекислого газу, а про 6,02•1023 частинок кожного типу, то рівняння реакції з відповідними записами матиме такий вигляд:
![]()
Отже, кількості речовини реагентів і продуктів відповідають (або пропорційні) коефіцієнтам у хімічному рівнянні. Це справедливо для будь-якої реакції. Наводимо ще один приклад:
![]()
![]() Узагальнення і систематизація (5-7 хвилин)
Узагальнення і систематизація (5-7 хвилин)
Робота в парах за завданнями:
- Скільки молекул міститься у воді кількістю речовини 15 моль?
- Скільки молекул міститься в сульфатній кислоті кількістю речовини 12 моль?
2. Дано:
- 1,3∙1023 атомов Сульфуру;
- 1,2∙1023 атомов Сульфуру.
Обчисліть кількість речовини.
- У ложці води міститься близько 0,5 моль речовини. Обчисліть кількість молекул води в ложці.
- У склянку вміщується близько 1,5 моль цукру. Обчисліть кількість молекул цукру в склянці.
- Скільки атомів міститься в міді кількістю речовини 1,5 моль, 2,5 моль?
Дайте відповіді на питання:
- Що нового ви дізнались на уроці?
- Чи все було зрозуміле?
- Що викликало утруднення?
Домашнє завдання (2-3 хвилини)
Вивчити § 19 підручника, виконати завдання 130; 131*.


про публікацію авторської розробки
Додати розробку
