Урок "Корозія металів.Види корозії".
Про матеріал
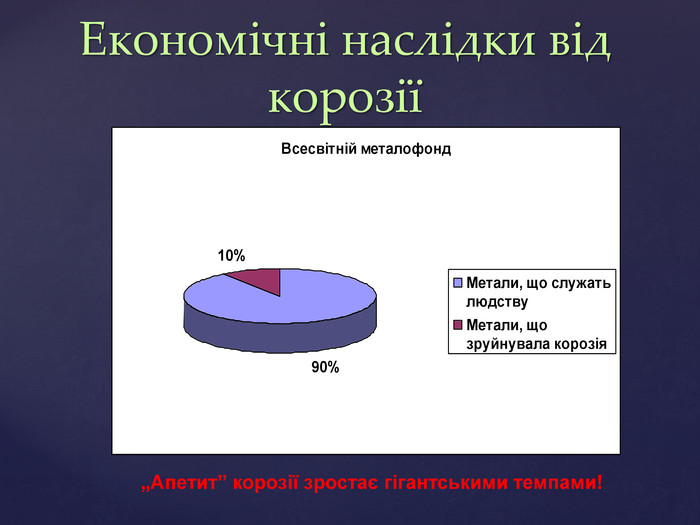
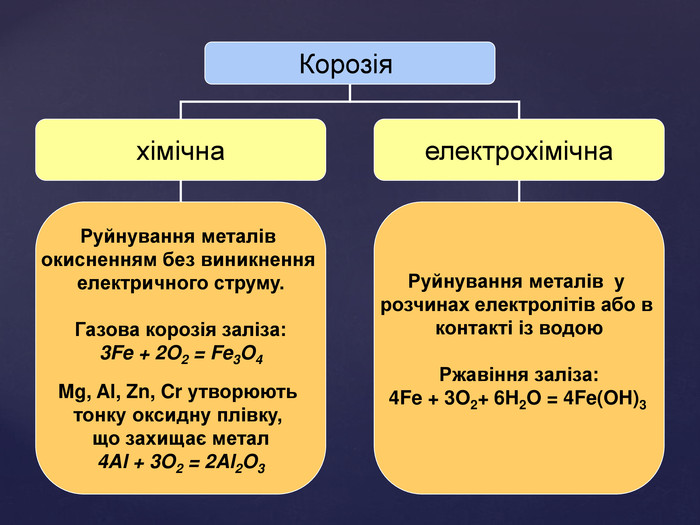
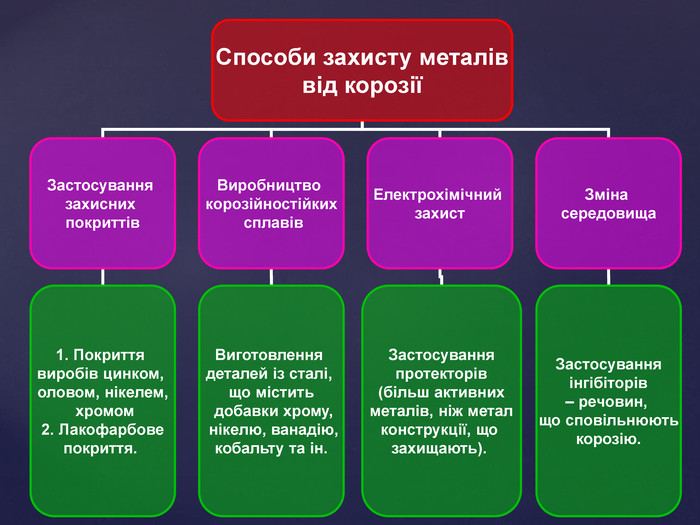
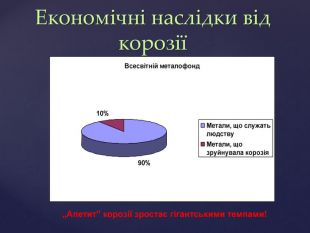
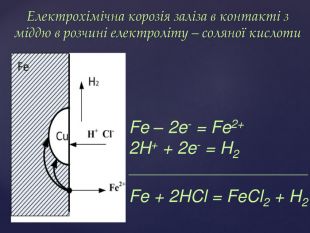
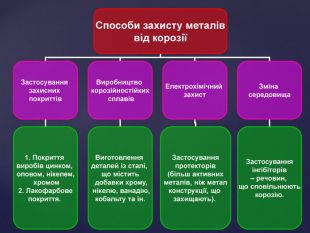
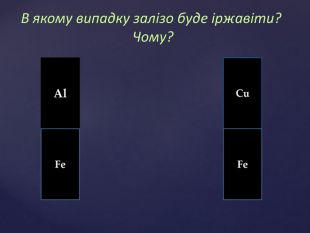
Тема корозії металів цікава і актуальна. Сучасний світ неможливо уявити без металів і сплавів. Та, на жаль, корозія цих матеріалів завдає величезних збитків народному господарству. В ході уроку учні набувають компетентностей. Вони не тільки засвоюють поняття «корозія», знайомляться з її видами, але й вивчають методи захисту металів від корозії, тобто вчаться використовувати здобуті знання на практиці. Учні залучаються до дослідницької роботи, проводять експерименти, спостерігають за їх наслідками, вчаться робити висновки. Готуючи повідомлення до теми уроку, учні вчаться працювати самостійно з підручником, шукати інформацію з кількох джерел, критично її аналізувати, працювати з інтернет-ресурсом, набувати практичних навиків роботи з хімічними реактивами. Учні вчаться працювати у складі групи, брати на себе обов’язки і виконувати їх, що сприяє формуванню лідерських якостей, навичок спілкування.
Я вважаю, що на цьому уроці розвивається одна з актуальних проблем сучасної методики викладання – проблема розвиваючого навчання, а саме - самовизначення, самореалізація, формування і розвиток навичок критичного мислення.
Перегляд файлу
Зміст слайдів
ppt
До підручника
Хімія (профільний рівень) 10 клас (Буринська Н.М. та інші)
Оцінка розробки

Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку