Урок "Ковалентний зв'язок". 8 клас. Хімія
Тема: Ковалентний полярний і ковалентний неполярний зв'язки
Цілі :
Формування ключових компетентностей: саморозвитку й самоосвіти – створення проблемних ситуацій, уміння
розв’язувати завдання;
інформаційної – вміння робити короткий раціональний запис, робити висновки та узагальнення;
соціально-трудової – вміння оперувати знаннями, розвивати гнучкість отриманих знань; комунікативної – вміння працювати в колективі. Формування предметних компетентностей:
дати поняття ковалентного зв’язку, з’ясувати механізм утворення ковалентного зв’язку, його види, дати поняття «диполь», розвивати поняття
«електронегативність», набути навичок складання електронних і структурних формул будови молекул; виховувати вміння виділяти головне, актуалізувати, порівнювати, зіставляти, конспектувати.
Тип уроку: вивчення нового матеріалу.
![]()
![]() Засоби і форми роботи: програмно-методичний
комплекс та ІКТ: презентація, лепбук, сигнальні картки, інструктивні картки;
прийоми «Лови помилку», «Графічний диктант», «Наведи порядок», «Лабіринт дій»,
«Хрестики-нолики», «Мікрофон», робота учнів з таблицями, схемами, робота в
парах, евристична бесіда.
Засоби і форми роботи: програмно-методичний
комплекс та ІКТ: презентація, лепбук, сигнальні картки, інструктивні картки;
прийоми «Лови помилку», «Графічний диктант», «Наведи порядок», «Лабіринт дій»,
«Хрестики-нолики», «Мікрофон», робота учнів з таблицями, схемами, робота в
парах, евристична бесіда.
Хід уроку
I. Організація початку уроку.
II. Мотивація навчальної діяльності.
III. Підготовка учнів до засвоєння, актуалізація опорних знань.
IV. Вивчення нового матеріалу. V. Перевірка засвоєння знань.
VI. Підбиття підсумків уроку. Рефлексія. VII. Інформація про домашнє завдання.
І. Організація початку уроку. (3 хв)
Привітання з класом. Смайл «Радість» для гарного настрою і легкого засвоєння теми. Девіз уроку «Все пізнається в порівнянні» (Л). (слайд 1)
Роз’яснення, щодо використання сигнальних карток (зелена і жовта), створення спільного лепбука (Л).
Налаштування на робочу атмосферу.
ІІ. Мотивація навчальної діяльності (2хв)
(слайд)
Коли реальність відкриває таємниці, зникають в тінь і гаснуть всі дива... (слайди) Дійсно, це диво, що у світі існують мільйони різноманітних речовин і всі ці речовини мають свої властивості. Від чого ж залежать властивості речовин?
А все починалось… з маленького атома, маленького чарівника. Атомоходи, зорельоти, підкорення космосу та морських глибин – все у ньому. Людина здавна здогадувалася про те, що речовини складаються з найменших частинок. Ці частинки – атоми – не існують поодинці, а об’єднуються в групи й утворюють молекули. Атоми й молекули дуже малі, їх можна побачити тільки в електронний мікроскоп.
Отже, сьогодні ми поринемо у віртуальний світ атомів і молекул, з’ясуємо як вони об’єднуються, які типи зв’язків утворюють, та як це впливає на властивості речовин. [1]
ІІІ. Підготовка учнів до засвоєння, актуалізація опорних знань. (7 хв)
1. Усне завдання. «Лови помилку», «Закінчи речення» (слайди) Ø Взаємодію між атомами, молекулами, йонами, завдяки якій частинки утримуються разом називають математичним зв'язком.
Ø Хімічний зв'язок утворюється за рахунок дії сил прищеплення та відбиття.
Ø Електронегативність - це здатність атома притягувати до себе протони та нейтрони.
Ø
![]()
![]() Металічні елементи володіють ……… електронегативністю
ніж неметалічні.
Металічні елементи володіють ……… електронегативністю
ніж неметалічні.
Ø Електронегативність елементів у групах ……. зі збільшенням порядкового номеру.
Електронегативність елементів у періодах ……. зі збільшенням порядкового номеру.
2. Робота біля дошки. Доповнити схему «Хімічні зв’язки» (Роздатковий матеріал) (Ковалентний, йонний, металічний, водневий, атомний, кисневий – вибрати правильні відповіді) (слайд)
3. Перевірка домашнього завдання. Вправа 2. (Друкований зошит) Розставити елементи за збільшенням електронегативності (Л)
4. Письмова роба в зошиті. «Графічний диктант». Самоперевірка (слайд) 1) кількість електронів у атомі відповідає порядковому номеру елемента (+);
2) кількість електронів у атомі на зовнішньому рівні дорівнює номеру періода
(-)
3) кількість неспарених електронів у атомі можна визначити за формулою: 8- номер групи (+)
4) на s-орбіталі максимум може знаходитись 2 електрони (+)
5) на р-орбіталі може розміщуватись 10 електронів (-)
Хвилинка відпочинку. (слайд )
IV. Вивчення нового матеріалу. (20хв.) Евристична бесіда.
Хімія вивчає речовини. Їх з кожним роком стає все більше. Адже ХХІ століття – вік синтетичної хімії. Деякі з них вам уже добре відомі. (слайд)
Картинка – рослина зелена. Пригадайте, який природний процес відбувається в рослинах? (фотосинтез) Які речовини виділяються і поглинаються? (вуглекислий газ і кисень) Яка найпоширеніша речовина в космосі? (водень) Що спільного у цих речовин? (гази)
А яка найпоширеніша речовина на Землі? (вода) А ви дивилися на пляшечки з ліками? Більшість з них спиртові розчини. Отже, спирт і вода подібні за агрегатним станом – рідини.
А чи знаєте ви які зв’язки у молекулах цих речовин? Сьогодні ми дізнаємося особливості хімічного зв’язку у газах і рідинах.
Тема уроку. Запис у зошиті (Л)(слайд) Очікування від уроку (Л): (слайд) учень
![]()
![]() називає
види хімічного зв’язку наводить
приклади сполук із ковалентним (полярним і неполярним) ХЗ пояснює утворення
ковалентного (полярного і неполярного) зв'язків
складає електронні та структурні формули молекул; характеризує особливості
ковалентного зв’язку
називає
види хімічного зв’язку наводить
приклади сполук із ковалентним (полярним і неполярним) ХЗ пояснює утворення
ковалентного (полярного і неполярного) зв'язків
складає електронні та структурні формули молекул; характеризує особливості
ковалентного зв’язку
визначає вид хімічного зв’язку в типових випадках, полярність ковалентного зв'язку; (роздатковий матеріал кожному)
Поняття про ковалентний зв'язок. Прийом «Наведи порядок».
Скласти визначення із окремих слів: Зв'язок, який виникає в результаті утворення спільних електронних пар. (роздатковий матеріал) (Л)
Пояснення механізму утворення ковалентного неполярного зв’язку на прикладі молекули Н2. (Підручник с. 85 – таблиця Електронегативності елементів) Запис електронної та структурної форм. (слайд)
За карткою (роздатковий матеріал) учні вчаться пояснювати механізм утворення зв’язку у молекулі.
Первинне засвоєння знань: За алгоритмом (роздатковий матеріал) учні складають електронну та структурну формулу для молекули кисню (азоту). (Л)
Пояснюють механізм утворення зв’язку. (слайд)
Фізкуль хвилика. Вправи для очей, рухи головою. Потягування.
Пояснення механізму утворення ковалентного полярного зв’язку на прикладі молекули НCl. (Підручник с. 85 – таблиця Електронегативності елементів).
Запис електронної та структурної форм. (слайд)
За алгоритмом учні складають електронну та структурну формулу для молекули води. (Л) Пояснюють механізм утворення зв’язку. (слайд)
Пояснюємо, що таке частковий заряд – дельта, вводимо поняття диполь.
За схемою формулюємо визначення ковалентного полярного і неполярного зв’язку (запис у друкованому зошиті). (слайд)
V. Перевірка засвоєння знань. (8 хв)
Робота в групах (парах) (Л) (слайд)
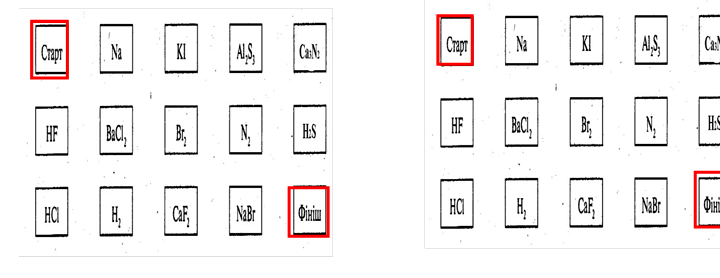
Прийом «Хрестики нолики». Визначити ряд, в якому розташовано сполуки з ковалентним неполярним зв’язком.
«Лабіринт дій». Прокласти шлях до фінішу через клітинки, у яких знаходяться сполуки з ковалентним зв’язком.
Робота в друкованому зошиті с. 50 № 4, 5, 11
VI. 
 Підбиття
підсумків уроку. Рефлексія.
(слайд) (3хв) «Мікрофон»
Підбиття
підсумків уроку. Рефлексія.
(слайд) (3хв) «Мікрофон»
ü Мені сподобалося…
ü Було складно…
ü Було цікаво…
ü Я дізнався (дізналася) … Оцініть свою роботу на уроці:
Заповнення таблиці «Очікуванні результати» (+\?)
Узагальнюємо матеріал - лепбук.
VII. Інформація про домашнє завдання (2хв) (слайд)
Підручник (Попель, Крикля, Нова програма 8 клас) - §15, 16
Зошит(О.А. Дубовик) – с. 49 №1-3
с. 51 №1-3
Творче завдання – підібрати інформацію про довжину, енергію зв’язка.
Використана література:
[1] Стеценко І.В., Овчаренко І.Ю. Усі уроки хімії. 8 клас – Х.: «Основа», 2016. –
287.
додатки
Алгоритм складання електронної та структурної формул для сполук з ковалентним зв’язком
Записуємо загальну формулу речовини.
Електронна формула
1. Записуємо окремо атоми, що входять до складу сполуки.
2. Визначаємо кількість електронів на зовнішньому рівні атомів (за номером групи).
3. Визначаємо кількість неспарених електронів у атомі (8 - № групи або за валентністю у бінарних сполуках).
4. Електрони позначаємо крапками, неспарені електрони записуємо окремо.
5. Обводимо спільну електронну пару
![]() Н∙ + ∙Н → Н ∙∙ Н
Н∙ + ∙Н → Н ∙∙ Н
Структурна формула
1. Записуємо окремо атоми, що входять до складу сполуки.
2. ![]()
![]() Кожну спільну електронну пару
позначаємо валентною рискою.
Кожну спільну електронну пару
позначаємо валентною рискою.
Н−Н О=О Н−Cl
Словесне пояснення механізму утворення ковалентного зв’язку
У молекулі виникає ковалентний неполярний зв'язок за рахунок спільних електронних пар між атомами з однаковою електронегативністю.
У молекулі виникає ковалентний полярний зв'язок за рахунок спільних електронних пар між атомами та з різною електронегативністю.
Спільна електронна пара зміщується до атома , як більш електронегативного елемента.
|
Зв'язок |
який |
виникає |
в результаті |
|
утворення |
спільних |
електронних |
пар. |
|
|
|
|
|
|
Зв'язок |
який |
виникає |
в результаті |
|
утворення |
спільних |
електронних |
пар. |
|
|
|
|
|
|
Зв'язок |
який |
виникає |
в результаті |
|
утворення |
спільних |
електронних |
пар. |
Очікувані результати
|
Очікування |
+/? |
|
|
Знати |
визначення ковалентного зв’язку |
|
|
ковалентного полярного зв’язку |
|
|
|
ковалентного неполярного зв’язку |
|
|
|
Вміти |
пояснювати утворення ковалентних зв’язків |
|
|
розрізняти сполуки з ковалентним полярним, неполярним зв’язком |
|
|
|
складати електронні та структурні формули речовин з ковалентним зв’язком |
|
|
«Хрестики-нолики» «Хрестики-нолики»
виграшний шлях – сполуки з ковалентним неполярним зв’язком
|
|
|
|
Li2O |
N2 |
CaCl2 |
|
BCl3 |
O2 |
I2 |
|
BaS |
Br2 |
CO2 |
|
Li2O |
N2 |
CaCl2 |
|
BCl3 |
O2 |
I2 |
|
BaS |
Br2 |
CO2 |
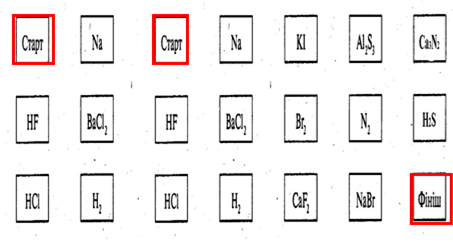 |
«Лабіринт дій» - ковалентний зв'язок - «Лабіринт дій»
-
Дуже цікава розробка уроку. Матеріал чітко відповідає темі уроку. Сучаний урок з багатьма видами робіт. По розробці видно,що вчитель творча людина!!! Дуже дякую!


про публікацію авторської розробки
Додати розробку
