Урок на тему "Хімічні властивості насичених одноосновних карбонових кислот. Реакція естерифікації. Застосування і одержання етанової кислоти"
Урок 29
Тема. Хімічні властивості насичених одноосновних карбонових кислот. Реакція естерифікації. Застосування і одержання етанової кислоти.
Ціль загальноосвітня: ознайомити учнів із хімічними властивостями насичених карбонових кислот на прикладі оцтової кислоти та інших кислот;
Ціль розвиваюча: розвивати навички складати рівняння реакцій , що характеризують хімічні властивості насичених одноосновних карбонових кислот, доводити дослідним шляхом їхні кислотні властивості; розуміти суть і типи записаних реакцій на основі їхньої будови; порівняти хімічні властивості мінеральних та карбонових кислот (знайти спільні та відмінні риси); навчити учнів виявляти органічні кислоти у продуктах харчування.
Розвивати навички використання мережі інтернет для пошуку необхідної інформації, використання смартфонів та кьюаркодів у навчальних цілях.
Ціль виховна: формувати вміння працювати в групі; виховувати почуття взаємодопомоги, інтерес до предмета.
Очікувані результати.
Знанневий компонент: пояснює вплив характеристичної (функціональної) групи на хімічні властивості карбонових кислот.
Діяльнісний компонент: складає рівняння реакцій, які описують хімічні властивості насичених одноосновних карбонових кислот (взаємодія з індикаторами, металами, лугами, солями, спиртами), одержання етанової кислоти (окиснення етаналю, етанолу); порівнює хімічні властивості насичених одноосновних карбонових і неорганічних кислот; характеризує хімічні властивості насичених одноосновних карбонових кислот; способи одержання, етанової кислоти, прогнозує хімічні властивості карбонових кислот на основі знань про властивості характеристичних (функціональних) груп.
Обладнання та реактиви: пробірки, хімічна склянка, скляні палички – 5 шт, універсальний індикаторний папір, сік лимона та яблука, квашеної капусти, молоко, сметана.
Для демонстрації: пробірки, хлоридна кислота, оцтова кислота, магній, розчини індикаторів метилоранж та фенолфталеїн, крейда, кальцій оксид, натрій гідроксид.
Тип уроку: урок-дослідження.
Хід уроку
Епіграф: «Зібратися разом- це початок, триматися
разом – це прогрес, працювати разом – це успіх»
Генрі Форд
І етап. Організаційний момент
Перевірка готовності учнів до уроку. Я рада вітати усіх присутніх учнів, учителів у кабінеті хімії.
ІІ етап. Створення емоційного настрою.
Щоб наш урок був результативним, давайте налаштуємось на успіх.
По черзі учні зачитують пам’ятку успіху:
Будьте уважними.
Активно пізнавайте і аналізуйте почуте на уроці.
Самостійно встановлюйте зв’язки відомого і невідомого.
Учіться досліджувати і відчувати радість відкриття, досягати мети.
Реалізуйте свої знання у повсякденному житті.
Епіграфом нашого уроку є слова Генрі Форда. (зачитування епіграфу)
Максимально зосередьтеся для роботи у групі, щоб ваша діяльність принесла задоволення від процесу здобування знань, дозволила реалізувати свої здібності. Можливо, отримані навички принесуть у майбутньому успіх у всіх задуманих справах і починаннях.
ІІІ етап. Перевірка виконання домашнього завдання
Розпочнемо із перевірки домашнього завдання, який ми проведемо у вигляді взаємоперевірки.
Зробіть взаємоперевірку домашнього завдання. Поставте за виконані вправи оцінку у зошит та щоденник, критерії оцінювання ви побачите на слайді.(слайд3 ).
Впр. 130, 132 ст. 113-114. Відповіді на слайді
ІV. Мотивація навчальної діяльності
Пропоную наш урок провести в незвичній формі: урок-дослідження. Уявимо, що наша школа – це науково – дослідницький інститут, а кабінет хімії – це інститут хімії. Даний інститут складається з великої кількості кафедр, серед яких є кафедра неорганічної хімії, органічної хімії, прикладної хімії та кафедра хімічного синтезу. Представники даних кафедр працюватимуть разом за одним столом.
Кожна кафедра включається у роботу при вивченні нового матеріалу, заслухаємо працівників кожної кафедр, які будуть звітувати про виконану роботу. Усі записи занотовуємо у своїх журналах лабораторних досліджень, які знаходяться у вас на столах.
Проблемне питання, яке повстало перед інститутом хімії.
Як ви вважаєте, чи існує різка відмінність між хімічними властивостями мінеральних та карбонових кислот?
До закінчення уроку нам потрібно знайти вирішення даної проблеми.
Давайте порівняємо хімічні властивості мінеральних та карбонових кислот на прикладі хлоридної та оцтової кислоти. На основі вивченого матеріалу ми зробимо узагальнення.
V. Повідомлення теми і завдань уроку
Тема уроку «Хімічні властивості насичених одноосновних карбонових кислот. Реакція естерифікації. Застосування і одержання етанової кислоти».
Давайте разом окреслимо основні завдання уроку.
- Дослідити хімічні властивості насичених одноосновних карбонових кислот.
- Навчитися виявляти органічні кислоти у продуктах харчування.
- Порівняти хімічні властивості мінеральних та органічних карбонових кислот: знайти спільні властивості та специфічні, характерні тільки для карбонових кислот.
- Пояснити, якою функціональною групою визначаються специфічні хімічні властивості карбонових кислот.
- Розглянути способи добування етанової кислоти.
- Розширити свої знання про сфери застосування оцтової кислоти.
- Отримати інформацію, яку використаємо у повсякденному житті.
VІ. Актуалізація опорних знань
Мозковий штурм
Щоб розв’язати дану проблему, давайте пригадаємо.
- Які сполуки називаються мінеральні кислоти?
- Наведіть приклади відомих вам кислот, які ми використовуємо у побуті.
- За допомогою яких сполук можна виявити мінеральні кислоти?
- Які частинки, що входять до складу мінеральних кислот, змінюють забарвлення індикатора?
- Які хімічні властивості характерні для мінеральних кислот?
- Які сполуки називаються насичені одноосновні карбонові кислоти?
- Що таке функціональна група? На що вона впливає?
- Яка функціональна група міститься у карбонових кислотах?
VІІ. Вивчення нового матеріалу
1. Електролітична дисоціація (Вплив кислот на індикатори).
Ми пригадали, що мінеральні кислоти можна виявити за допомогою речовин-визначників або індикаторів. Які індикатори використовують для визначення кислот? ( метилоранж або лакмус). Індикатор фенофталеїн не використовують, бо він не змінює свого кольору.
Поміркуйте, чи можна виявити органічні кислоти, використовуючи індикатори? (відповіді учнів). Давайте перевіримо за допомогою експериментальних досліджень. В кінці досліду, зверніть увагу, чи однаковий колір індикатора у розчинах хлоридної та оцтової кислоти.
Дем. «Дія кислот на індикатора».
У дві пробірки наливаю 1 мл розчину хлоридної та оцтової кислоти й додаю декілька крапель індикатору метилового оранжевого.
Якого кольору став розчин хлоридної та оцтової кислоти. Про що це свідчить?
Які частинки завжди утворюються при дисоціації мінеральних чи органічних кислот?
Прошу представника кафедри неорганічної хімії записати на дошці рівняння електролітичної дисоціації хлоридної кислоти.
Оцтова кислота є слабкою кислотою, тому змінює забарвлення індикатора частково. Реакція дисоціації є оборотною, відбувається у двох зворотних напрямках. Часто при написанні йонно-молекулярних рівнянь формула оцтової кислоти пишеться у молекулярній формі, так як це слабкий електроліт, що дисоціює у невеликій кількості.
СН3СООН ↔ СН3СОО- + Н+
На основі проведених експериментальних досліджень робимо висновок: колір індикатора у
розчинах кислот однаковий, тому що зумовлений наявністю однакових частинок у розчині – катіонів Гідрогену, а різна інтенсивність кольору пояснюється неоднаковою кількістю частинок, що утворюються під час дисоціації. Оцтова кислота – слабкий електроліт – інтенсивність забарвлення індикатора слабка. Поява карбоксильної групи привела до появи властивостей слабкого електроліту.
? Яким способом можна виявити лимонну, молочну, яблучну кислоти у розчині або у продуктах харчування?
Як у домашніх умовах перевірити: молоко свіже чи воно проскисло?
Проведемо лабораторний дослід № 1 та спробуємо виявити органічні кислоти у харчових продуктах. Перед початком роботи пригадаємо правила БЖД, які слід дотримуватись при роботі: бути акуратними, уникати потрапляння реактивів на шкіру. Свої спостереження та висновки занотовуємо у зошитах для лабораторних робіт на сторінці 2.
Лабораторний дослід № 1
Тема. Виявлення органічних кислот у харчових продуктах
Мета. Навчитися визначати органічні кислоти у продуктах харчування.
Хід роботи
Завдання 1. Виявлення йонів Гідрогену
У чотири пробірки налийте по черзі сік лимона та сік яблука, сік квашеної капусти, молоко. У порцелянову чашку покладіть чайну ложку сметани. На універсальний індикаторний папір скляною паличкою нанесіть по черзі краплю соку лимона, яблучного соку, сік квашеної капусти, молоко та сметану. Запишіть спостереження у таблицю. Кожного разу використовуйте чисті та сухі скляні палички.
|
Індикатор |
Забарвлення індикатора у нейтрально-му середовищі |
Забарвлення індикатора у продуктах харчування |
||||
|
сік лимона |
сік яблука |
сік квашеної капусти |
молоко |
сметана |
||
|
універ- сальний індикатор- ний папір |
|
|
|
|
|
|
|
рН розчину |
|
|
|
|
|
|
Висновок:
За допомогою яких речовин можна виявити органічні кислоти у продуктах харчування?_________
Які йони, що містяться в розчинах кислот, змінюють забарвлення індикаторів?___________
Чи усі досліджувані продукти містили органічні кислоти?
Підсумок. Використовуючи індикатори можна виявити будь-яку органічну кислоту, що є електролітом, яка міститься у продуктах харчування або розчинах.
У свіжому молоці колір індикатора не зміниться (нейтральне середовище), у кислому – зміниться, завдяки наявній молочній кислоті (кисле середовище).
Ви пригадали, що мінеральні кислоти взаємодіють з металами, основними оксидами, основами та солями.
Якою частинкою, яка входить до складу мінеральних кислот, визначаються хімічні властивості
цих сполук. (катіоном Гідрогену)
Якщо під час дисоціації карбонової кислоти утворюються катіони Гідрогену, чи можуть ці
сполуки виявляти хімічні властивості, що аналогічні мінеральним кислотам. Давайте перевіримо експериментальним шляхом.
2. Взаємодія з активними металами (до водню).
Дем 2. У дві пробірки наливаю розчини оцтової і хлоридної кислот. В обидві пробірки додаю магнієвий порошок. Порівняємо швидкість взаємодії цих кислот з магнієм та продукти реакції.
Висновок: швидше з магнієм реагує хлоридна кислота, тому що вона сильніший електроліт. Під час проведених реакцій утворюються аналогічні продукти реакції: виділяється водень та утворюється сіль.
Прошу представників кафедр неорганічної та органічної хімії по черзі записати на дошці
рівняння взаємодії хлоридної кислоти з магнієм та спробувати по аналогії записати рівняння взаємодії оцтової кислоти з магнієм.
2СН3СООН + Mg → (СН3СОО)2Mg + H2
Д/З записати проведені рівняння реакцій у йонно-молекулярній формі (перевірити правильність записів можна у підручнику Савчин М.М. Хімія 10 клас рівень стандарту 2018 року ст. 83)
3. Взаємодія з основними та амфотерними оксидами.
Дем 3. У пробірку наливаю розчини хлоридної та оцтової кислот. Додаю трохи порошку кальцій оксиду. Порівнюємо швидкість взаємодії цих кислот з кальцій оксидом та продукти реакції.
Висновок: швидше з кальцій оксидом реагує хлоридна кислота, тому що вона сильніший електроліт. Слід зазначити, під час проведених реакцій утворюються аналогічні продукти реакції: виділяється вода та утворюється сіль.
Прошу представників кафедр неорганічної та органічної хімії по черзі записати на дошці
рівняння взаємодії хлоридної кислоти з кальцій оксидом та спробувати по аналогії записати рівняння взаємодії оцтової кислоти із даним оксидом.
2СН3СООН + CaO → (СН3СОО)2Ca + H2O
4. Взаємодія з лугами та амфотерними гідроксидами.
Дем 4.У пробірку наливаю розчин лугу NaOH й додаю декілька крапель фенолфталеїну. Розділяю на дві пробірки, по краплях додаю розчин хлоридної та оцтової кислоти до кожної пробірки до знебарвлення розчину. Порівнюємо швидкість взаємодії цих кислот з лугом та продукти реакції.
Висновок: Слід зазначити, під час проведених реакцій нейтралізації утворюються аналогічні продукти реакції: виділяється вода та утворюється сіль.
Прошу представників кафедр неорганічної та органічної хімії по черзі записати на дошці
рівняння взаємодії хлоридної кислоти з натрій гідроксидом та спробувати по аналогії записати рівняння взаємодії оцтової кислоти із натрій гідроксидом.
СН3СООН + NaOH → СН3СООNa + H2O
5. Взаємодія з солями слабких кислот.
Дем 5.У пробірки додаю шматочки крейди, доливаю розчини хлоридної та оцтової кислоти.
2СН3СООН + СaСO3 → (СН3СОО)2Сa + H2O + СО2
Висновок: Слід зазначити, під час проведених реакцій утворюються аналогічні продукти реакції: виділяється вуглекислий газ, вода та утворюється сіль.
На відміну від оцтової кислоти, хлоридна кислота реагує із більшою кількістю солей за умови утворення осаду.
Додаткове запитання
Вапняний наліт на кранах, накип у чайнику — це кальцій карбонат. Як можна позбавитись накипу або вапняного нальоту, використовуючи властивості етанової кислоти? Які ще органічні кислоти можна використовувати для видалення вапняного нальоту й накипу?
?? Чи можливі якісь специфічні хімічні властивості для карбонових кислот. Якою функціональною групою вони повинні бути зумовлені?
Давайте спрогнозуємо специфічні хімічні властивості карбонових кислот, повторивши будову карбоксильної групи, яка є функціональною групою.
Ми знаємо, що карбоксильна група складається з двох функціональних груп: карбонільної та гідроксильної, які зв’язані та взаємно впливають одне на одну. Атом Оксигену, що міститься у складі карбонільної групи, відтягує на себе електронну густину зв’язку між атомом Карбону і Оксигену. Внаслідок чого зв'язок між атомом Гідрогену та Оксигену у гідроксильній групі та зв’язок між атомом Карбону та Гідроксильною групою поляризується, тому може легко розриватись при взаємодії певними речовинами та заміщуватись на інші групи.
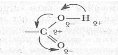
Дана будова карбоксильної призведе до того, під час взаємодії з спиртами гідроксильна група відривається із легкістю, а на її місце стає залишок спирту. Так відбувається реакція етерифікації.
Специфічні реакції
Карбонові кислоти завдяки наявності карбоксильної групи здатні взаємодіяти зі спиртами з утворенням естерів:
![]()
етилетаноат (етиловий естер оцтової кислоти)
Дана реакція має назву реакція естерифікації – реакція між карбоновою кислотою та спиртом з утворенням естеру та води.
Висновок: реакція естерифікації характерна тільки для карбонових кислот завдяки наявності карбоксильної групи.
Повертаємось до проблемного питання. Яке було поставлено на початку уроку: Як ви вважаєте. Чи існує різка відмінність між хімічними властивостями мінеральних та карбонових кислот?
(відповідь учнів)
Добування етанової кислоти
Інформацію про добування етанової кислоти у промисловості презентує кафедра хімічного синтезу. (Інформацію занотовуємо у лабораторний журнал).
Отримати етанову кислоту можна різними способами.
- Окиснення спиртів (біохімічне окиснення). Відбувається під дією оцтовокислих бактерій. Вперше збудника цього бродіння було відкрито Луї Пастером. Відбувається у два стадії: спочатку утворюється альдегід оцтовий, який окиснюється до оцтової кислоти.
С2Н5ОН + O2 кат→ СН3СОOН + Н2О
У такий спосіб оцтову кислоту добувають у харчовій промисловості.
- Окиснення альдегідів.
СН3СОН + [O] → СН3СОOН
- Велике значення має спосіб одержання оцтової кислоти, заснований на окисненні бутану:
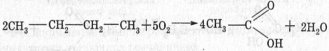
Де застосовують етанову кислоту? Надаємо слово кафедрі прикладної хімії.
Застосування.
Найбільшого використання серед карбонових кислот набули оцтова та мурашина.
Оцтова кислота - один з базових продуктів промислового органічного синтезу. Більш ніж
65% світового виробництва оцтової кислоти йде на виготовлення полімерів, похідних целюлози та вінілацетату.
Застосування оцтової кислоти зумовлено комплексом фізичних і хімічних властивостей, притаманній цій речовині. Найважливіші галузі її застосування: хімічна промисловість, харчова промисловість, медицина і побутові потреби.
Оцтову кислоту використовують у виробництві ацетатного волокна; барвників, засобів боротьби з комахами та рослинами; розчинників та екстрагентів; фруктових есенцій; органічного скла,
сировина для виготовлення полімерів.
У харчовій промисловості оцтова кислота використовується як харчосмакова приправа;
Консервант, застосування фруктових есенцій при виробництві газованих напоїв.
У побуті ми часто використовуємо оцет (9-% розчин оцтової кислоти) як консервант та харчову приправу до їжі (Е 260). засіб для дезинфекції, засіб для видалення накипу; помічник на кухні.
У медицині використовують похідне оцтової кислоти ацетилсаліцилову кислоту для лікування та зниження температури тіла.
У косметології для виготовлення косметичних засобів; виготовлення віддушок.
Вчитель. А чи знаєте ви що у світі є музеї оцту, ось і учні 10 класу вирішили створити інтерактивну міні-виставку оцту у кабінеті хімії. Слово надається Мельник Ірині, яка більш детально розповість про цю виставку.
Інтерактивна виставка оцту
У світі є різні музеї: музеї історії, музеї архітектури, музеї, присвячені видатним особистостям, певним подіям… Але чи знаєте ви, що є музеї, присвячені одній речовині. Наприклад, в Києві діє відомий музей води.
У деяких країнах існують музеї, присвячені винятково оцту. Наприклад, в 2001 році був відкритий перший у Китаї Музей оцту на березі гарного озера в провінції Шаньси. За зовнішнім виглядом музей схожий на вежу (9 поверхів), що піднімається на великій площі. У ньому експонуються матеріали про історію розвитку оцту й більше 200 оригінальних речей для виготовлення, зберігання й транспортування оцту. У провінції Шаньси, що називають «столицею оцту», існує особлива культура пиття оцту і його приготування. Є подібний музей оцту й у Південній Дакоті (США). Там є що подивитися для тих, хто цікавиться оцтом. Музей заснував стипендію для студентів, що спеціалізуються на дослідженнях оцту.
Учні 10 класу вирішили створити інтерактивну виставку оцту в кабінеті хімії. Керівник проекту – Мельник Ірина. Ми упродовж місяця збирали інформацію про оцет, його історію, виробництво, застосування, значення. На основі зібраних матеріалів створили наступні експозиції: (слайд )
- Хімія оцту
- Історія і добування оцту
- Різновиди оцту
- Оцет в моєму домі: практичні поради
- Оцтова кулінарія
- Яблучний оцет для краси
- Оцет – помічник здоров’я
- Застосування оцтової кислоти
- Оцтові історії
- Оцтове дерево
- Оцет в мистецтві
Більш детально дану інформацію можна отримати, відвідавши дану виставку у кабінеті хімії у позаурочний час.
Ще більше 4000 років тому в Стародавньому Єгипті та інших країнах вміли готувати вино з виноградного соку, при скисанні якого утворювався оцет. Ним як харчовою приправою вміли користуватися майже 3000 років тому. Назва оцет ототожнювалася з самим поняттям про кисле та кислоти. Саме слово “кислий”, “кислота” походить від лат. аcetum – “оцет”, аcіdum –”кислий”.
Хочу зосередити вашу увагу на експозиції «Різновиди оцту». Кожному з нас відомо два-три різновиди оцту. Виявляється їх набагато більше.
Сорти оцту: синтетичний оцет (столовий), натуральний, бальзамічний, яблучний, солодовий, червоний і білий винний оцет, рисовий, ківовий, фруктовий, кокосовий, медовий, оцет з ізюму, трав’яний, зерновий, тростинний, фініковий, березовий, туалетний оцет.
Королем всіх оцтів можна вважати бальзамічний оцет – це різновид винного оцту, але готують його по більш складній технології із сортів винограду з підвищеним вмістом цукру. Після ферментації й випарювання оцет поміщають у дерев'яні бочки, де він ще не менш 12 років «доходить», здобуває колір, смак, запах і щільність. Причому щорічно, 10% іде на випар, і в остаточному підсумку, з 100-літрової бочки виходить приблизно 15 літрів оцту.
Не менш цікава експозиція виставки, яка знадобиться кожному з нас у повсякденному житті, - «Оцет в моєму домі: практичні поради».
Ознайомившись із цією експозицією, ви дізнаєтесь багато корисних порад та секретів, які полегшать вам прибирання дому, приготування їжі, знадобляться у побуті господиням.
Чи знаєте ви, що жирний посуд, пательню легше вимити, якщо у воду додати трохи оцту. Так само перуться кухонні рушники, відмиваються губки й щітки.
Щоб очищені свіжі гриби не чорніли, треба покласти їх у воду, додавши в неї солі й оцту.
Щоб мухи не залітали у вікна, змажте віконні рами оцтом.
Готуючись чистити овочі і особливо молоду картоплю, змочіть руки оцтом, не витирайте, а дайте висохнути. На руках не буде плям.
Оцет також використовується і при фарбування писанок. Оцет додається для міцності фарб. Щоб фарба краще бралася, шкарлупу яйця перед розписуванням протравляють оцтом.
При готуванні омлету з яєць або яєчні потрібно додати 2-3 краплі оцту, щоб уникнути пригоряння.
Якщо зварити рис із додаванням оцту, йог оможна буде довше зберегти.
Оцет ефективно видаляє воскові плями й плями від усіляких смол, добре дезінфікує,
Крім того, з оцту можна приготувати ефективну й безпечну "рідину для миття скла", яка прекрасно чистить і не залишає розводів. Для цього потрібно лише розбавити дві чайні ложки оцту в 1 л води.
Не менш корисна для красунь експозиція «Яблучний оцет для краси»
Найцікавішим з точки зору користі для здоров'я, є яблучний оцет.
Яких тільки корисних і життєво необхідних речовин не знайшли в ньому! Органічні кислоти (яблучна, аскорбінова, пантотенова), Калій, який допомагає при роботі серця, Флуор, Кальцій, Фосфор, Магній, Ферум (бореться з анемією), вітаміни, мікроелементи, і цілий ряд ферментів. Крім того, він містить цінну баластову речовину – пектин і найсильніший антиоксидант – провітамін А.
Звідси й всі чудові властивості яблучного оцту: він сприяє розщепленню жирів і вуглеводів, знижує апетит і тягу до солодкого, очищає й тонізує організм, нормалізує перебіг процесів обміну в організмі.
Широко розповсюджене застосування яблучного оцту як засобу для схуднення.
Яблучний оцет використовується і як зовнішній засіб. Добре всім відомо яким шовковистим й блискучим стає волосся після ополіскування його розведеним яблучним (або винним) оцтом.
Оцтовий лосьйон – ідеальний тонізуючий засіб для шкіри. Яблучний оцет у нерозведеному виді використовують для лікування шкірних захворювань: грибкових ушкоджень, боротьби із сухістю шкіри. Якщо у вас дуже чутлива шкіра, то використовуйте яблучний оцет з великою обережністю! Підходить яблучний оцет для видалення пігментних плям і ластовиння.
Відвідавши експозицію «Оцет - помічник здоров’я», ви дізнаєтесь, як виготовити тонізуючий засіб, антитоксичний засіб, як вилікувати ангіну, нирки, головний біль, та багато інших проблем.
У давні часи натуральний оцет став одним з найперших засобів для застосування проти розладу травлення.
Оцет - корисний продукт, є чудовим антисептиком. У народній медицині яблучний оцет рекомендують вживати у разі багатьох хворобливих станів.
Але є і свої протипоказання: гастрит, виразкова хвороба шлунка та дванадцятипалої кишки.
А вся детальна інформація знаходиться у буклетах, які у вас на столі.
Ось і закінчилась наша віртуальна екскурсія. Так і хочеться сказати: «Без оцту, як не крути, і ні туди і ні сюди». Використовуєте оцет, хай іде на користь.
Закріплення
- Інтерактивна справа «Слідство ведуть хіміки»
Під час введення за допомогою комп’ютера результатів лабораторних досліджень загубилися деякі формули речовин. Допоможіть визначити можливі варіанти, якщо частина інформації збереглася.
А) С3Н7СООН + …→ (С3Н7СОО)2Zn + …
Б) … + Ва(ОН)2 → (С2Н5СОО)2Ва + …
В) НСООН + СаСО3→ …+ …+….
Г) ……… + …→СН3СООС4Н9 + …
- Розв’язок задачі
Звернемось до стародавньої легенди, яка стверджує, як цариця Клеопатра виграла оригінальне парі, з’ївши сніданок, який коштував декілька мільйонів доларів. У ній розповідається, що цариця Клеопатра виграла оригінальне парі, з´ївши „сніданок”, який коштував 100 000 систерцій. Ось як це описано в повісті Г. Хаггарда „Клеопатра – володарка зорі”: „...Вона вийняла з вуха одну з величезних перлин...і... опустила її в оцет. Запала мовчанка, вражені гості, завмерши, спостерігали, як незрівнянна перлина повільно розчиняється в міцному оцті. От від неї не залишилось і сліду, і тоді Клеопатра підняла кубок, покрутила його, і випила весь до останньої краплі.”
Більш того, Пліній назвав перлину "найбільшим в усьому світі, чудовим і по-справжньому унікальним твором природи" вартістю 100 000 сестерціїв. На сьогоднішній день у науковців є припущення, що це був справжній історичний факт.
Умова задачі 1
Яка б маса оцтової кислоти витратилась на розчинення перлини, масою 10 г. Перлина за своєю хімічною будовою є кальцій карбонат.
Кожна кафедра отримує свій варіант завдання. Хто перший розв’яже задачу правильно, отримає оцінку високого рівня.
VIІ. Рефлексія
Вправа "Мікрофон" - "Сьогодні на уроці я…"
Учні висловлюються по черзі.
- Сьогодні я дізнався… Було цікаво…Було складно… Тепер я зможу…. У мене вийшло…
- Мене здивувало… Я навчився… Я отримав… Я зміг… Я спробую… Мені захотілося…
VIІ. Домашнє завдання
Написати рівняння реакцій у йонно-молекулярній формі для оцтової кислоти (можна скористатись підручником Савчин М.М. § 17 ст. 83-85. за посиланням:
 ttps://lib.imzo.gov.ua/xmlui/handle/123456789/964
ttps://lib.imzo.gov.ua/xmlui/handle/123456789/964
Підручник Попель П.П. Крикля Л.С. Хімія 10 клас §19 ст 116-119, впр. 140, 143 а.
Творче завдання. Підберіть матеріал і підготуйте проект на тему:
- «Рецепти консервування овочів, де використовується оцет». (каф. хімічного синтезу)
- «Музеї оцту у світі». (каф. неорганічної хімії)
- «Етери та естери у косметиці». (каф. органічної хімії)
- «Застосування естерів в харчовій і парфумерній галузях промисловості». (к. приклад.хімії)
Підведення підсумків уроку..


про публікацію авторської розробки
Додати розробку
