Урок на тему "Карбон і Силіцій та їхні сполуки"
Розробка даного уроку дасть можливість:
- узагальнити та систематизувати знання учнів, отримані при вивченні теми « Карбон і Силіцій та їхні сполуки» ;
- продовжувати розвивати навички розв'язування задач, роботи з тестами на комп'ютері; розвивати креативне мислення учнів;
- виявити найкращого знавця хімії з даної теми.
Тема. Карбон і Силіцій та їхні сполуки
Мета:
- узагальнити та систематизувати знання учнів, отримані при вивченні теми « Карбон і Силіцій та їхні сполуки» ;
- продовжувати розвивати навички розв’язування задач, роботи з тестами на комп’ютері; розвивати креативне мислення учнів;
- виявити найкращого знавця хімії з даної теми.
Завдання : закріпити : теоретичні відомості про Карбон і Силіцій та
їхні сполуки, опрацювати презентацію з даної теми;
практичні вміння і навички під час виконання завдань і
тестів на комп’ютері;
розвивати: вміння учнів узагальнювати та конкретизувати
вивчений матеріал;
логічне мислення, мовлення;
здатність висловлювати свої думки;
пізнавальний інтерес учнів до більш глибокого вивчення
хімії ;
виховувати особистість, здатну творчо мислити і
застосовувати свої знання у нестандартних ситуаціях.
Тип уроку: узагальнення та систематизації знань.
Форма проведення : урок – змагання.
Форми роботи : бесіда, самостійна робота, робота у парах, розв’язування
розрахункових задач, тестування, «Мозковий штурм»,
експериментальна робота, індивідуальна творча робота.
Обладнання : комп’ютери, інтерактивна дошка, склянки з реактивами,
картки з диференційованими завданнями, картки
самоперевірки, плакати з будовою атомів Карбону та
Силіцію.
Реактиви: розчин хлоридної кислоти , розчини солей : хром (ІІІ)
хлориду, купрум (ІІ) сульфату, ферум (ІІІ) хлориду,
барій хлориду, кобальт (ІІ) сульфату, «рідке скло»,
куряче яйце.
Міжпредметні зв’язки : біологія, географія , фізика, математика,
інформатика, українська мова.
ХІД УРОКУ
І. Вступне слово вчителя.
Добрий день , дорогі діти! Я дуже рада нашій сьогоднішній зустрічі. Думаю, що вона буде дуже корисною для нас усіх. Адже сьогодні ми закінчуємо вивчення теми « Карбон і Силіцій та їхні сполуки» і проводимо узагальнення і систематизацію тих знань, які вже маємо.
А проведемо ми наш урок , як урок – змагання з теми« Карбон і Силіцій та їхні сполуки» (Запис у зошити теми уроку).
- Що ви очікуєте від сьогоднішнього заняття?
- Яку мету поставимо перед собою?
(Використання методики незакінчених речень:
"Гадаю, що...."
"Сподіваюся на..."
"Дізнаюся нове про..."
"Має бути цікаво, тому що...)
Учитель (доповнює): отже, ми маємо повторити та систематизувати матеріал з даної теми, продовжувати розвивати навички розв’язування задач, роботи з комп’ютером; розвивати здатність висловлювати свої думки; а крім цього виявити найкращого знавця хімії з даної теми, який стане власником ордена «Кращий знавець хімії Карбону та Силіцію».
Девізом уроку візьмемо слова видатного німецького мислителя і філософа Й. Гете : « Просто знати - ще не все, знання необхідно використовувати».
- Як ви розумієте ці слова?
- Чому вони підходять до нашого уроку?
Любі діти! Хай нам усім на уроці вистачить терпіння використати наші знання у певних ситуаціях.
Кожен учень отримує заліковий листок, де самостійно рахує свої бали протягом уроку.
Починаємо наше змагання! Бажаю вам успіху, упевненості, удачі.
II. Перевірка домашнього завдання, актуалізація опорних знань.
І конкурс нашого змагання – « Конкурс на кращого оратора»
(самооцінка від 1 до 5 балів)
Домашнім завданням для деяких учнів було створити презентацію на тему « Карбон і Силіцій та їхні сполуки ». Прошу бажаючих представити свою роботу і пояснити , чому два елементи, розміщені в одній групі, одній підгрупі з майже однаковою будовою атомів, проявляють такі різні властивості і утворюють такі різні сполуки:
один - основа живої природи; другий - основа неживої природи.
Виходить Карбон (лат. Саrboneum). Перед собою тримає плакат з будовою атома.
![]()
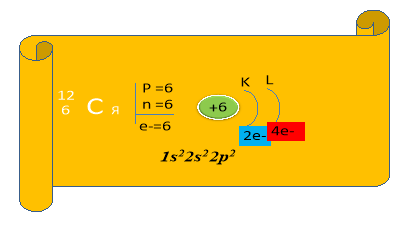
![]()
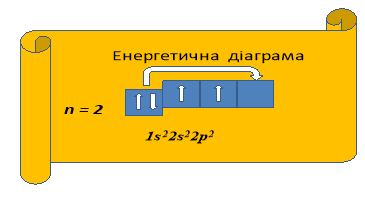

Живу я на другому поверсі семиповерхового будинку в квартирі № 6, кімнати в якій розташовані в два яруси: на першому ярусі кухня, на другому — чотири окремі кімнати. В одній з цих кімнат живемо ми з дружиною, ще дві займають наші діти, четверта ж кімната залишається вільною. Але за бажанням ми з дружиною можемо переселитися в різні кімнати, тоді в кожній кімнаті буде по мешканцю.
Виходить Силіцій (лат. Siliсiит) з плакатом і говорить:
А у нас з дружиною квартира №14 на третьому поверсі цього ж будинку, тільки вільних кімнат, навіть коли ми не разом, залишається ще п’ять.
![]()
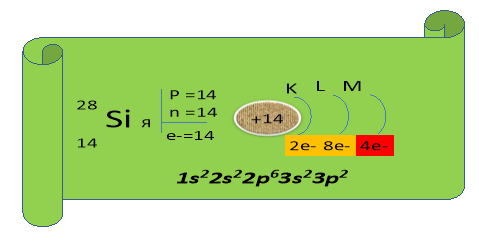
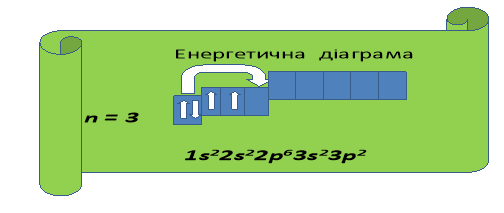
![]()
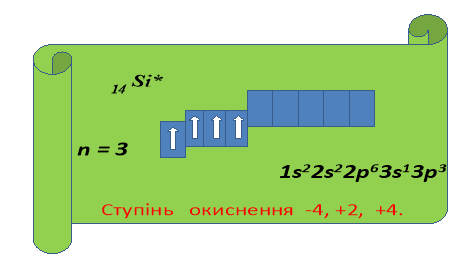
Вчитель. Дякуємо за оригінальну презентацію . Запитання класу:
- Що ж є спільного у будові цих атомів і чим вони відрізняються один від одного?
(Обидва елементи, маючи на зовнішньому енергетичному рівні однакову кількість електронів (4), повинні проявляти однакові властивості. Насправді ж 4 електрони Карбону розташовані ближче до ядра, тому С в першу чергу є окисником, тобто приймає електрони, проявляючи ступінь окиснення - 4, а Si має 4 електрони на третьому енергетичному рівні, тому є дуже слабким окисником, але значно сильнішим відновником, ніж С.
Карбон — біогенний елемент, його сполуки відіграють основну роль у живих організмах, бо утворюють найміцніші та найпоширеніші гідрогенні сполуки, а Si утворює нестійкі сполуки з Гідрогеном, проте дуже стійкі й поширені його оксигеновмісні сполуки.
Обидва елементи утворюють прості речовини — вуглець і кремній, які так само дуже різняться за своїми властивостями.)
- А тепер на допомогу учням, які готували презентацію у програмі Power Point приходить наш помічник - комп’ютер. Тож надаємо їм слово .
- Дякуємо за ваші доповіді, не забудьте себе оцінити.
IIІ. Використання знань, умінь і навичок.
Вчитель. ІІ конкурс нашого змагання має назву « Хімічний конвеєр », який складається з трьох етапів :
- Тести:
- Протягом 10сек вибрати єдину правильну відповідь із тестових завдань, що з’являються на моніторі ;
- записати відповідь у зошит ;
- отримати якомога більше балів за правильні відповіді (всього 2 бали), перевіривши себе за допомогою комп’ютера
Умова конкурсу:
не спілкуватись із товаришами.
|
І варіант |
ІІ варіант |
|
1.Алотропною модифікацією Карбону є : а) графіт ; б) вуглекислий газ ; в) антрацит. |
1.Силікатна кислота відноситься до : а) міцних кислот ; б) слабких кислот ; в) кислот середньої сили.
|
|
2. Із галогеноводневих кислот діоксид силіцію реагує тільки з : а) HF ; б) HCl ; в) HBr ; г) HI. |
2.Алмаз має ґратку : а) йонну ; б) молекулярну ; в) атомну ; г) металічну.
|
|
3.Оксид карбону(ІІ) відноситься до оксидів : а) амфотерних ; б) несолетворних ; в) основних ; г) кислотних. |
3.Аморфний силіцій можна добути за реакцією SiO2 з: а) F2 ; б) Mg ; в) MnO ; г)Cl2 . |
|
4.Реакція між калій силікатом і хлоридною кислотою відбувається тому , що утворюється : а) нерозчинна речовина ; б) розчинна речовина ; в) виділяється газ ; г) реакція не відбувається. |
4. Реактивом на карбонат - йон є: а) розбавлена кислота ; б) розбавлений луг ; в) концентрована сульфатна кислота ; г) розчинна сіль барію.
|
2. Задача:
- Розв’яжи розрахункову задачу:
|
8 балів . Обчисліть масу міді , яку можна добути , відновлюючи купрум ( ІІ) оксид за допомогою 24 кг вуглецю . Виробничі втрати міді становлять 5 %. |
|
10 балів . Яка маса натрій силікату утворюється , якщо для його добування взяли 12 г силіцій (IV) оксиду і 14 г натрій гідроксиду ? |
|
12 балів. Який об’єм карбон (IV) оксиду можна добути під час дії хлоридної кислоти на мармур масою 200 кг , що містить 15 % домішок ,якщо практичний вихід СО2 складає 90 %. |
- Перевір себе карткою самоперевірки
- Вистав оцінки у заліковий листок у відповідності до набраних балів.
3. «Мозковий штурм» - «Улюблений представник з даної теми»:

Завдання ІІІ етапу конкурсу:
- Пара учнів по черзі вибирає номінацію;
- протягом 1 хв відповідає на запитання , що з’являються на моніторі і одночасно читаються вчителем ;
- отримують бали, кількість яких відповідає кількості правильних відповідей ( від 1 до 10 балів)
Вчитель.
ІІІ конкурс нашого змагання називається «Цікавий дослід з даної теми» у ньому беруть участь самі творчі учні класу, деякі із них навіть створили невеликий фільм.
Оцініть своїх товаришів (від 1 до 5 балів) ,а також підрахуйте свої бали і здайте залікові листки.
Ну ось і все скінчилося змагання…
Хто ж орден в нас отримає за старання?
Це буде той, хто краще всіх: учив, творив і дослідив
Та максимальну кількість балів заробив!
Учень, який набрав найбільше балів, отримує звання «Кращий знавець хімії» та стає власником ордена «Кращий знавець хімії Карбону та Силіцію ». Три учні , що показали ІІ - IV результати, нагороджуються дипломами І – ІІІ ступенів.
IV. Домашнє завдання.
- Підготуватись до контрольної роботи
- повт. тему «Карбон та Силіцій»
- повт. алгоритми розв’язування задач на надлишок, на вихід продукту, генетичні зв’язки між класами неорганічних сполук.
V. Рефлексія.
- Чи справдилися ваші сподівання від уроку ?
- Над чим замислювались протягом заняття?
- Що найбільше сподобалось, запам’яталось?
- Що могло б бути краще ?
VI. Оцінювання роботи учнів .
|
Кількість набраних балів |
оцінка |
Рівень навчальних досягнень |
|
34 33 - 31 30 - 28 |
12 11 10 |
високий |
|
27 -25 24-22 21 - 19 |
9 8 7 |
достатній |
|
18-16 15-13 12 -9 |
6 5 4 |
середній |
|
8 – 6 5- 3 2 - 1 |
3 2 1 |
початковий |
|
Прізвище, ім’я учня |
Кількість набраних балів |
Сумарний бал |
||||
|
« Конкурс на кращого оратора»
|
« Хімічний конвеєр »
|
«Цікавий дослід з даної теми» |
|
|||
|
Тести
|
Задача |
«Улюблений представник з даної теми» |
||||
|
|
|
|
|
|
|
|
Картка самоперевірки розв’язку задачі №1
|
Складність |
Бали |
Розв’язання |
|
|
8 балів |
1,75{ |
Дано : m( C )=24 кг w (втрат)=5 % |
|
|
m(Cu)-? |
|||
|
2 { |
24кг x кг CuO + C = CO + Cu 12 кг 64 кг
М (С )=12 кг/моль М(Сu ) = 64 кг/моль m (С )=12 кг m (Сu )= 64 кг
|
||
|
1 { |
Х = 24 • 64 /12= 128 m теор. (Сu ) = 128 кг
|
||
|
2 { |
128 кг - 100 % Х кг - 5 %
Х = 128 • 5 / 100 = 6,4
m ( втрат ) = 6,4 кг
|
||
|
1 { |
m пр. (Сu ) = m теор. (Сu ) - m ( втрат )
m пр. (Сu ) =128 - 6,4 = 121,6 кг |
||
|
0,25 { |
Відповідь : m(Cu) =121,6 кг
|
||
Картка самоперевірки розв’язку задачі № 2
|
Складність |
Бали |
Розв’язання |
||
|
10 балів |
1,75{ |
Дано : m( SiO2 )=12 г m( NaOH )=14 г |
|
|
|
m( Na2 Si O3 )-? |
||||
|
2 { |
0,35 моль X г 2 NaOH + SiO2 = Na 2 Si O3 + H 2O 2 моль 122 г
М (NaOH )= 40 г/моль М (SiO2 )=60 г/моль М(Na2 Si O3 ) = 122 г/моль m( NaOH )= 40 г m (SiO2 )= 60 г m (Na2 Si O3 )= 122 г
|
|||
|
1 { |
n = m / М
|
n(NaOH ) = 14 /40 = 0,35 моль
|
||
|
1 { |
n (SiO2 ) = 12 / 60 = 0,2 моль |
|||
|
3{ |
n(NaOH ) : n (SiO2 ) = 2 :1 - за рівнянням реакції ,
за розрахунками : n (NaOH ) < n (SiO2 ) , бо
n1(NaOH ) = 0,4 моль
SiO2 взято у надлишку , розрахунок ведемо через NaOH
|
|||
|
1 { |
Х = 0,35 • 122 / 2 = 21,35
m( Na 2 Si O3 ) = 21,35 г |
|||
|
0,25 { |
Відповідь : m( Na 2 Si O3 ) = 21,35 г
|
|||
Картка самоперевірки розв’язку задачі № 3
|
Складність |
Бали |
Розв’язання |
|
|
12 балів |
1,75{ |
Дано : m( СаСО3)= 200 кг w (домішок ) = 15 % вихід = 90 % або 0,9 |
|
|
V пр.( СО2 )-? |
|||
|
2 { |
170 • 10 3 г X л СаСО3 + 2 HCl = Ca Cl 2 + H2O + СО2 | 100 г 22,4 л
М (СаСО3 )= 100 г/моль Vm( СО2 ) = 22,4 л/ моль m(СаСО3)= 100 г V( СО2 ) = 22,4 л |
||
|
4 {
|
m(домішок ) = w (домішок ) • m(техн..) /100 %
m(домішок ) =15 % •200 кг /100 % = 30 кг
m( ч.р.) = m(техн..) - m(домішок )
m( ч.р.) =200 кг - 30 кг = 170 кг = 170 • 10 3 г |
||
|
1{ |
Х = 170 • 103 • 22,4 / 100 = 38,08 • 103 л
|
||
|
3{ |
Вихід = V пр. / V теор.
V пр.= Вихід • V теор. V пр( СО2 ) = 0,9 •38,08 • 103 = 34,3 м3
|
||
|
0,25 { |
Відповідь : V пр( СО2 ) = 34,3 м3
|
||


про публікацію авторської розробки
Додати розробку
