Презентація «Структура електронної оболонки атома» 8 клас
| Презентація допоможе учням та вчителю при проведенні уроку на тему «Електронні та графічні електронні формули атомів хімічних елементів № 1-20». |




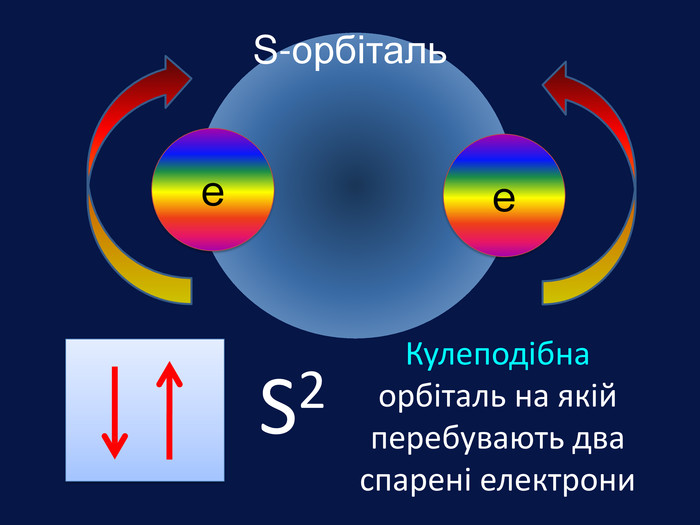























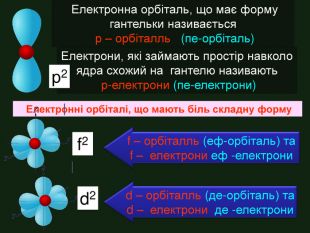
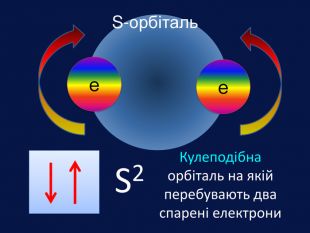
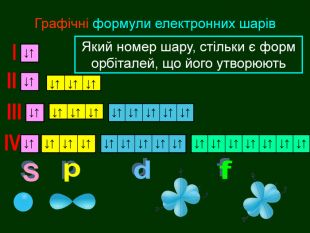
Електрони перебувають навколо ядра тільки в русі, займаючи певний простір, який можна уявити за допомогою геометричних фігур. Електрони, які займають простір навколо ядра схожий на кулю називають s-електрони Електронна орбіталь, що має форму кулі називається s- орбіталль (ес-орбіталь)↑↓s2 Графічно орбіталі прийнято позначати квадратом в якому вказують стрілками електрони, що рухаються та надписом
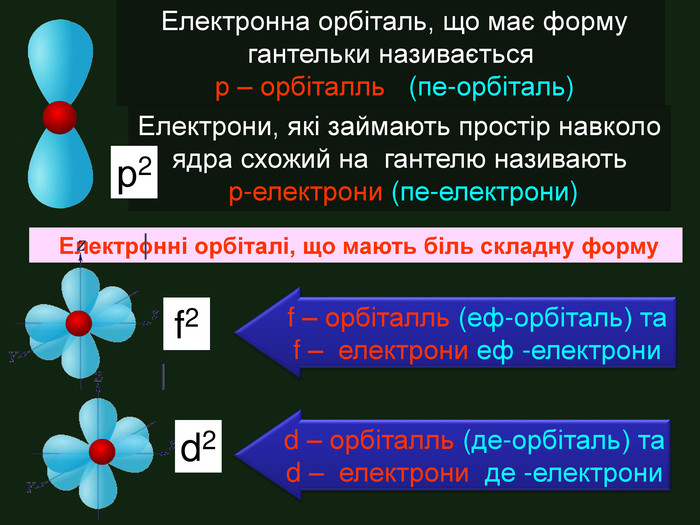
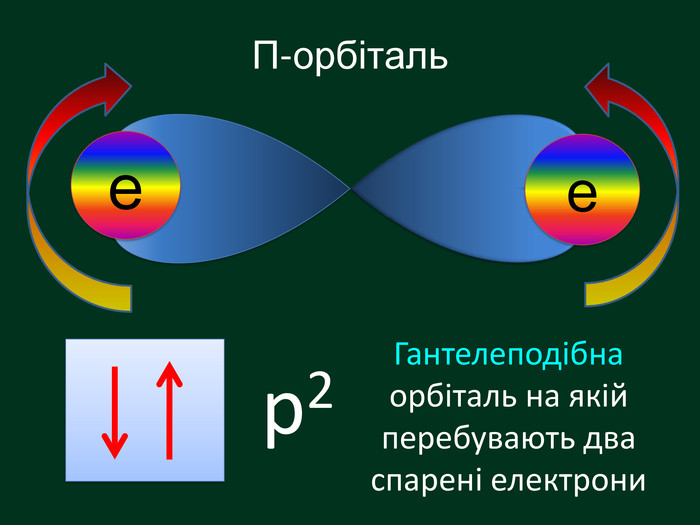
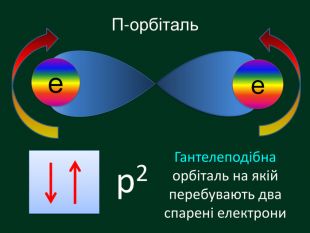
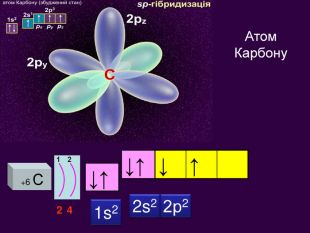
Електронна орбіталь, що має форму гантельки називається р – орбіталль (пе-орбіталь)Електрони, які займають простір навколо ядра схожий на гантелю називають р-електрони (пе-електрони) Електронні орбіталі, що мають біль складну форму f – орбіталль (еф-орбіталь) та f – електрони еф -електрони р2f2d2d – орбіталль (де-орбіталь) та d – електрони де -електрони
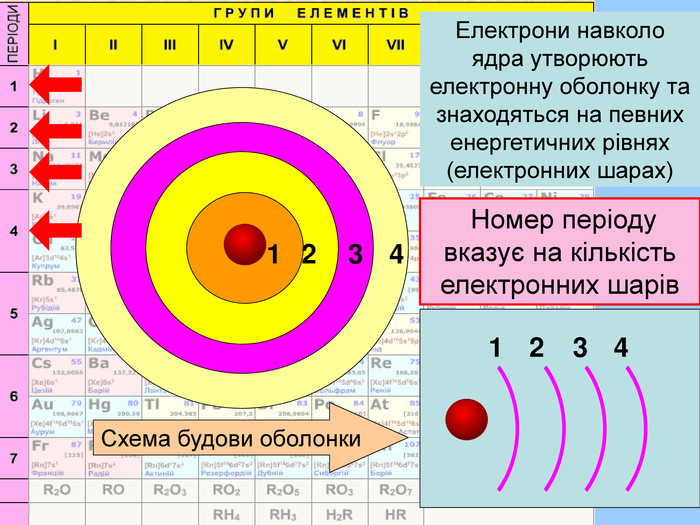
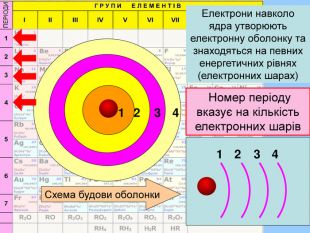
Єлектронна оболонка — це сукупність електронів, що рухаються навколо ядра та утримуються в атомі силами притягання ядра. Для її уявлення необхідно знати найважливішу характеристику електрона, яку можна точно визначити (розрахувати). Такою характеристикою є енергія. Модель атома описується будовою електронної оболонки.
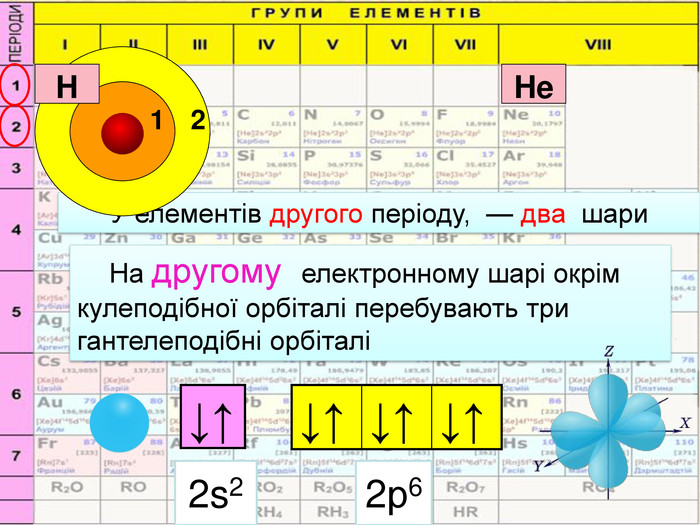
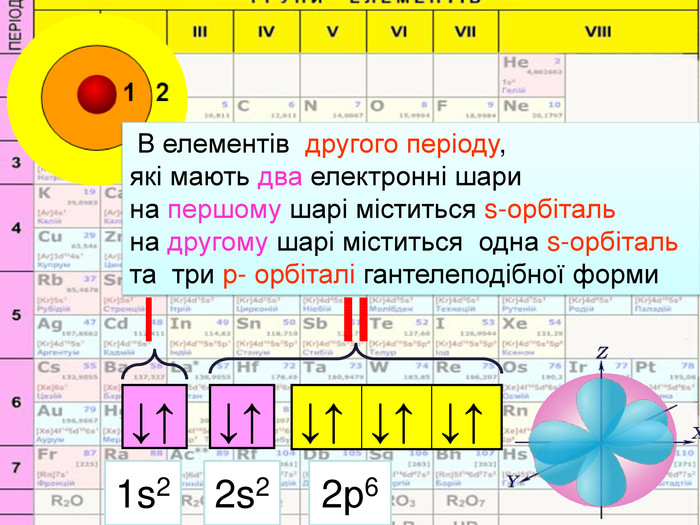
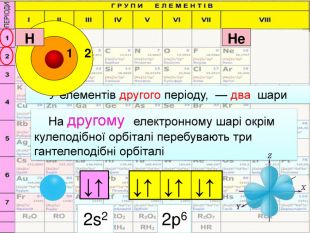
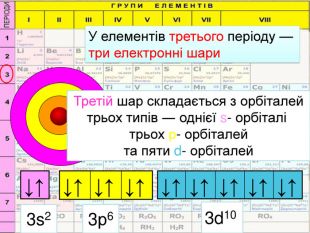
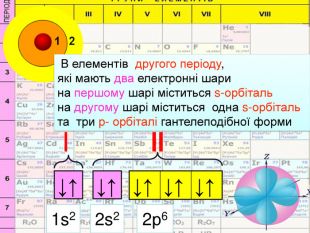
HHe. У елементів першого періоду Гідрогену та Гелію один електронний шар на якому перебувають електрони з кулеподібною формою орбіталі (s-електрони);1 Спарені електрони однієї орбіталі зображують у квадратику, який має назву енергетична комірка, у вигляді протилежно спрямованих стрілок1s2 Цифра перед буквою вказує на номер енергетичного рівня↓↑rrr
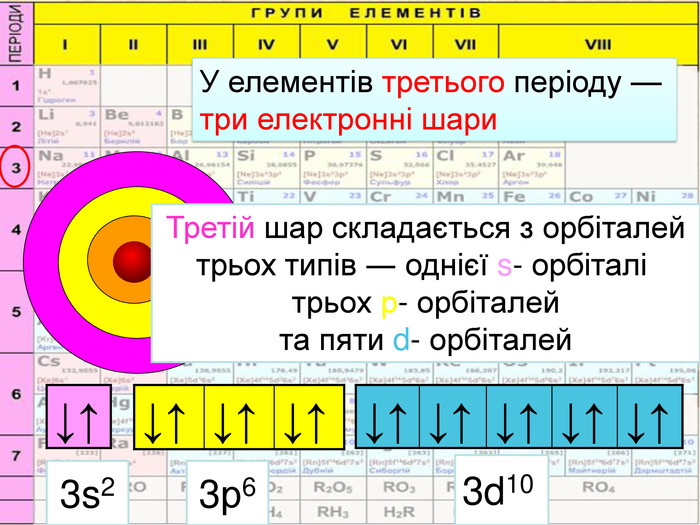
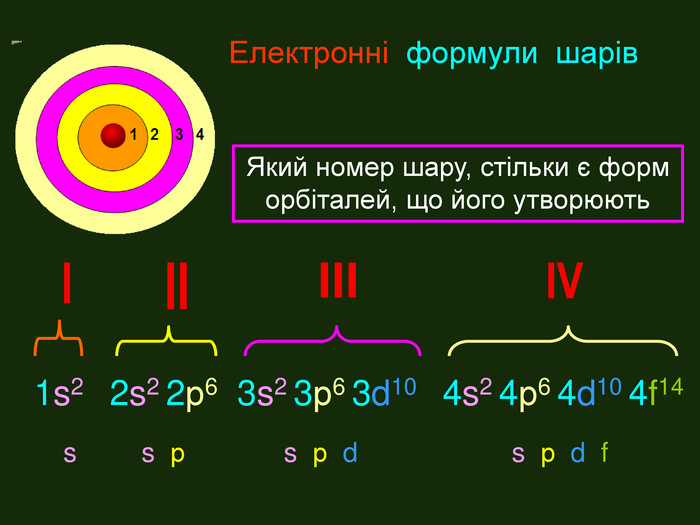
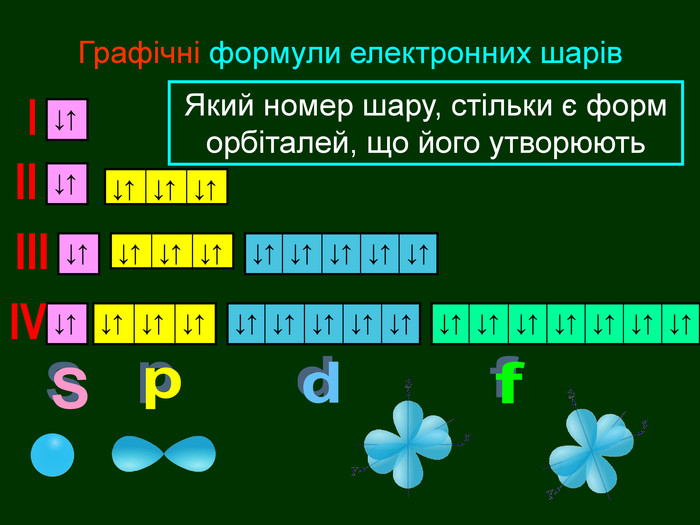
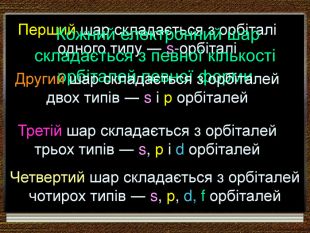
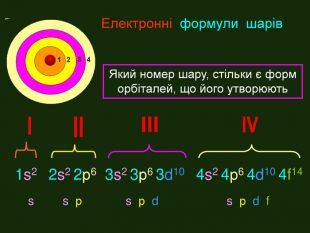
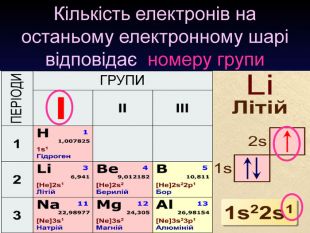
Перший шар складається з орбіталі одного типу ― s-орбіталі Кожний електронний шар складається з певної кількості орбіталей певної форми. Другий шар складається з орбіталей двох типів ― s і р орбіталей. Третій шар складається з орбіталей трьох типів ― s, р і d орбіталей. Четвертий шар складається з орбіталей чотирох типів ― s, р, d, f орбіталей
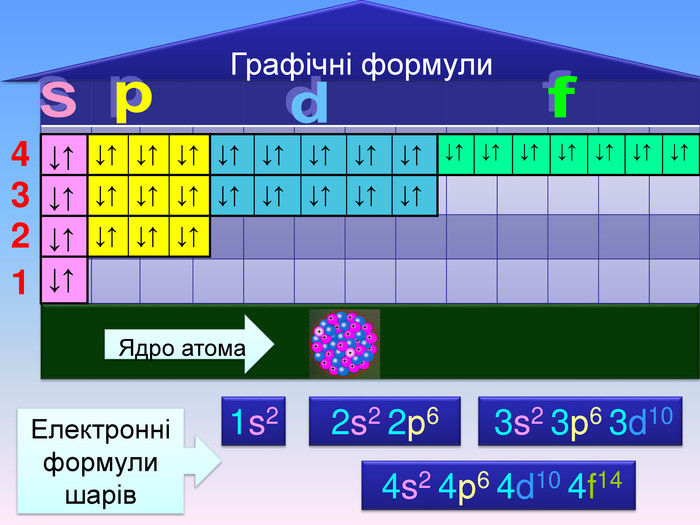
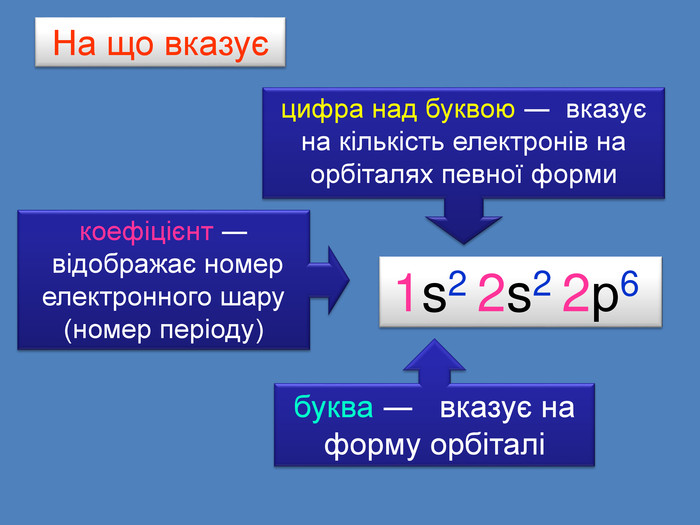
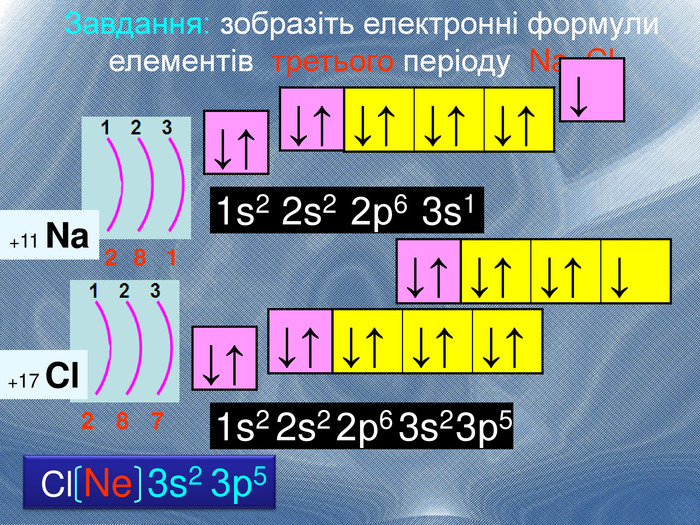
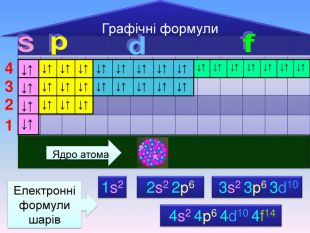
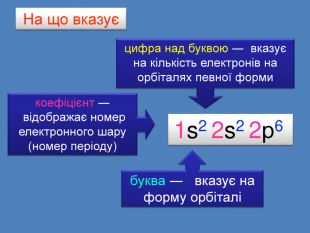
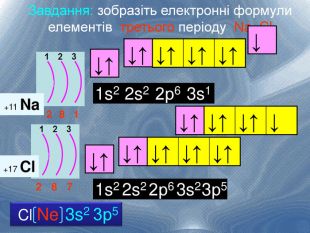
Електронна формула атома це запис розподілу орбіталей певної форми на електронних шарах та кільткості електронів електронів на орбіталях1s2 2s2 2р6 3s2 3р6 4s1ЇЇ ще називають електронна конфігурація атомакоефіцієнт ― цифра перед буквою, що відображає номер електронного шару (номер періоду)буква ― вказує на форму орбіталі цифра над буквою ― вказує на кількість електронів на орбіталях певної форми
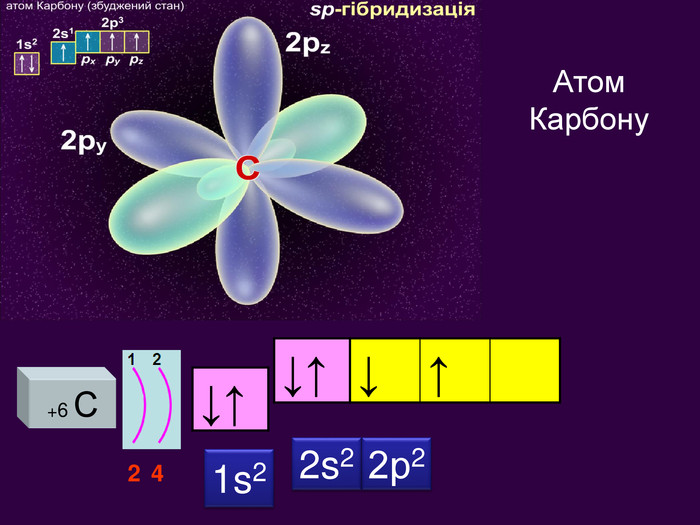
Іноді записують електронні формули в скороченому вигляді. Для цього відокремлюють ту частину формули, яка відповідає будові атома найближчого інертного газу. Тому електорнну формулу можна записати так: S Ne 3s2 3р4 В електронній формулі атома Сульфуру можна виділити електрони, які відповідають будові атома Неону: 1s2 2s2 2р6 3s2 3р4
Відображення розподілу електронів за енергетичними комірками називають графічною формулою↑↓ енергетична комірка де позначені спарені електрони однієї орбіталі у вигляді протилежно спрямованих стрілок, що вказують на рух електронів навкруги своєї осі в протилежні сторниклітинка ― орбіталь, стрілки ― електрони, що обертаються навколо осі, вільна клітинка ― вільна орбітальrr
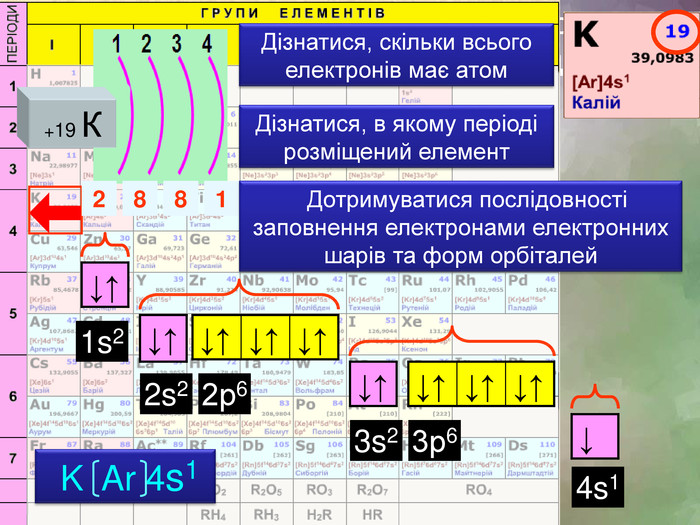
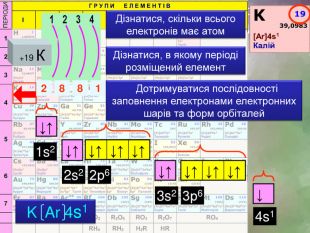
Завдання: зобразіть електронні формули елементів четвертого періоду скориставшись правилом Дізнатися, скільки всього електронів має атом. Дізнатися, в якому періоді розміщений елемент+19 К2881 Дотримуватися послідовності заповнення електронами електронних шарів та форм орбіталей↓↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↓1s22s23s24s12р63р6 K Ar 4s1
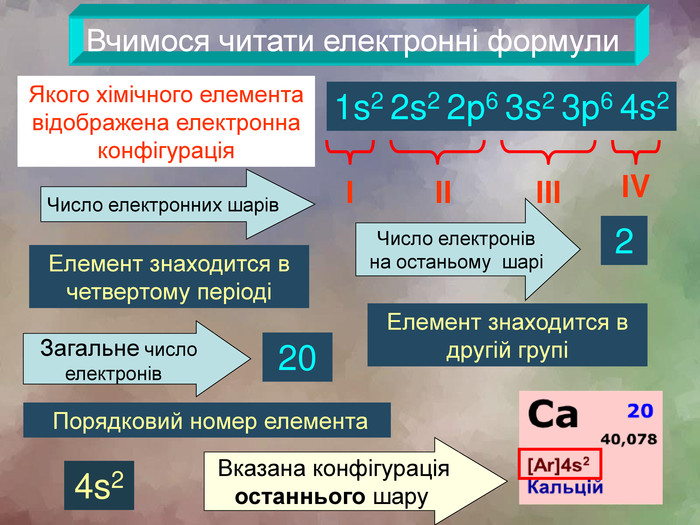
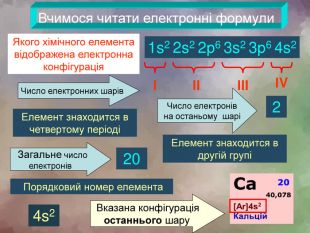
Вчимося читати електронні формули1s2 2s2 2р6 3s2 3р6 4s2 Якого хімічного елемента відображена електронна конфігураціяІІІІІІІV Число електронних шарів Число електронів на останьому шарі2 Елемент знаходится в четвертому періодіЕлемент знаходится в другій групі Вказана конфігурація останнього шару20 Порядковий номер елемента Загальне число електронів 4s2
Джерела. Григорович О. В. Хімія: підруч. для 8 класу загальноосвіт. навч.закл./ О. В. Григорович .̶ Харків: Вид-во «Ранок», 2016 Шаповалов С. А. Хімія. Довідник старшокласника та абітурієнта. Харків. Торсінг, 2005. Данильченко В.Є Халімон Є. В. Хімія. Навчальний посібник. 8-9 класи – Харків.: Країна мрій, 2008. – 128с.


про публікацію авторської розробки
Додати розробку


























-

Осовська Лада Вікторівна
10.10.2022 в 20:46
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Дерев'янко Людмила Василівна
04.10.2022 в 17:55
Дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Мандзюк Лідія
03.10.2022 в 18:31
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Болехан Інна Олександрівна
29.09.2022 в 08:06
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Prepodobna Olena
28.09.2022 в 18:13
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Linna Lina
23.06.2021 в 14:18
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Петрушевська Лілія Дмитрівна
16.12.2020 в 13:54
Дякую за роботу.
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Андрієвич Олена
09.11.2020 в 22:47
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Ясніцька Наталя Михайлівна
15.03.2020 в 22:43
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Єщенко Наталія Анатоліївна
23.09.2019 в 18:49
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Переяславець Ольга Валентинівна
08.10.2018 в 18:46
Зрозуміле і покрокове розкриття теми
Загальна:
4.3
Структурованість
4.0
Оригінальність викладу
5.0
Відповідність темі
4.0
-

Переяславець Ольга Валентинівна
08.10.2018 в 18:46
Зрозуміле і покрокове розкриття теми
Загальна:
4.3
Структурованість
4.0
Оригінальність викладу
5.0
Відповідність темі
4.0
-

Переяславець Ольга Валентинівна
08.10.2018 в 18:46
Зрозуміле і покрокове розкриття теми
Загальна:
4.3
Структурованість
4.0
Оригінальність викладу
5.0
Відповідність темі
4.0
Показати ще 10 відгуків