Урок на тему "Метан. Молекулярна, електронна і структурна формули метану, поширення у природі."
Розробка уроку з теми "Метан. Молекулярна, електронна і структурна формули метану, поширення у природі" містить інтерактивні вправи, розрахункові задачі. Зміст грунтується на матеріалі підручника авторів Попель П.П., Крикля Л.С. для 9 класу.
УРОК 1
Тема: Метан. Молекулярна, електронна і структурна формули метану, поширення у природі.
Мета: познайомити учнів з найпростішим представником органічних речовин – метаном; розглянути будову молекули метану, його молекулярну, структурну і електронну формулу; розкрити поняття «гібридизація електронних орбіталей», з’ясувати який тип гібридизації мають атом Карбону в молекулі метану; поглибити знання про фізичні властивості метану та про поширення метану в природі.
Обладнання: мультимедійна презентація до уроку, кулестержнева модель молекули метану, таблиця «Типи гібридизації»
Очікувані результати: наприкінці уроку учні повинні знати та складати молекулярну, електронну та структурну формули метану; описувати його фізичні властивості; втсновлювати причинно-наслідкові зв’язки між складом, будовою, властивостями ті біологічними фунціями метану.
Тип уроку: вивчення нового матеріалу
Хід уроку
І. Актуалізація опорних знань.
Перевірка домашнього завдання: Написати можливі структурні формули для речовини С5Н12.
Гра в м’яч «Так чи ні» (слайд 2)
(Вчитель по черзі кидає учням м’яч. Учень, піймавши м’яч, дає відповідь «так» чи «ні», коментує, в разі необхідності дає вірну відповідь.
1.Органічна хімія – це хімія сполук Карбону (так).
2. Карбон в органічних сполуках завжди чотиривалентний (так).
3.На зовнішньому енергетичному рівні атома Карбону міститься 6 електронів (ні).
4. В основному стані в атомі Карбону 4 неспарені електрони (ні).
5. В збудженому стані в атомі Карбону 2 неспарені електрони (ні).
6. Атоми Карбону здатні утворювати як йонні, так і ковалентні сильно полярні зв’язки (ні).
7. Атоми Карбону здатні утворювати між собою міцні ковалентні зв’язки і з’єднуватися в довгі ланцюжки або цикли (так).
8. Основні положення теорії хімічної будови органічних речовин сформулював Д.І. Менделєєв (ні).
9. Хімічна будова - це послідовність з’єднання атомів відповідно до їхньої валентності в молекулі (так).
10. Властивості речовин залежать тільки від того, атоми яких елементів і в якій кількості утворюють молекулу (ні).
11. Структурні формули – це такі формули, в яких символи хімічних елементів сполучаються рисочками, кількість яких дорівнює валентності елемента в сполуці (так).
12. Ізомери – це речовини,що мають однаковий склад, але різну будову (так).
13. Ізомери – це речовини, що мають однакові властивості (ні).
14. Структурні формули бувають розгорнуті та скорочені (так).
15. До складу вуглеводнів входять С, Н, О та іноді інші елементи (ні).
ІІ. Мотивація навчальної діяльності (слайд 3)
 Ми почали знайомство з органічними речовинами. На сьогоднішньому уроці пропоную вам познайомитися з найпростішою органічною речовиною. Цю речовину в побуті називають болотним газом або рудниковим газом. 98% цієї речовини входить до складу природного газу. Молекулярна формула цієї речовини – СН4, а хімічна назва – метан.
Ми почали знайомство з органічними речовинами. На сьогоднішньому уроці пропоную вам познайомитися з найпростішою органічною речовиною. Цю речовину в побуті називають болотним газом або рудниковим газом. 98% цієї речовини входить до складу природного газу. Молекулярна формула цієї речовини – СН4, а хімічна назва – метан.
Мета уроку: розглянути метан як найпростішу органічну речовину. Познайомитися з будовою молекули метану, типом гібридизації електронних орбіталей атома Карбону. Навчитися писати молекулярну, структурну, електронну формули молекули. Описати фізичні властивості метану та поглибити знання про поширення метану в природі.
ІІІ. Вивчення нового матеріалу
- Будова молекули метану. ( слайд 4 )
-
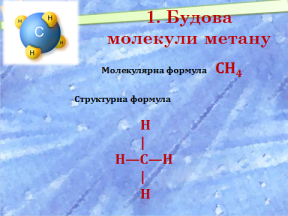 Молекулярна формула метану: СН4. Тобто до складу молекули входить 1 атом Карбону і 4 атома Гідрогену.
Молекулярна формула метану: СН4. Тобто до складу молекули входить 1 атом Карбону і 4 атома Гідрогену.
Напишіть структурну формулу метану
(Вчитель демонструє кулестержневу модель метану).
-
 Яку будову має атом Карбону у збудженому стані? (слайд 5 )
Яку будову має атом Карбону у збудженому стані? (слайд 5 )
На зовнішньому шарі знаходиться 4 електрона: 1s – електрон та 3p – електрона. s- електрони рухаються по кулеподібній орбіталі, а p – електрони – по гантелеподібній орбіталі.
![]()
![]()
![]()
s – орбіталь та 3 p- орбіталі
Отже валентність Карбону ІV. Дійсно атом Карбону в молекулі метану утворює 4 ковалентні полярні зв’зки з атомами Гідрогену. На моделі видно, що всі 4 зв’язки рівноцінні. Виникає питання: яким чином 1s-електрон і 3 p-електрони утворюють рівноцінні зв’язки атомами Гідрогену?
Справа в тому, що електрони зовнішнього енергетичного рівня атома Карбону гібридизуються. ( слайд 6 )
 Гібридизація – вирівнювання різних орбіталей одного атома за формою та енергією.
Гібридизація – вирівнювання різних орбіталей одного атома за формою та енергією.
Оскільки гібридизується 1s і 3p- електронні орбіталі, тому говорять, що в атом Карбону перебуває у стані sp3 – гібридизації. Утворюється 4 гібридні орбіталі.
-
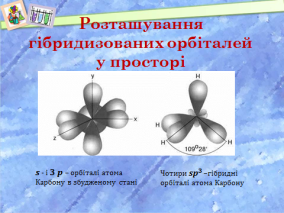 Як розташовуються ці орбіталі в просторі? (слайд 7 )
Як розташовуються ці орбіталі в просторі? (слайд 7 )
Оскільки електрони мають негативний заряд, то орбіталі відштовхуються. Найдалі один від одного вони стають тоді, коли кут між осями гібридних орбіталей становить 109°28'
-
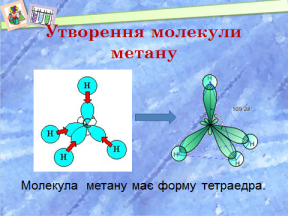
 Як утворюється молекула метану? (слайди 8, 9 )
Як утворюється молекула метану? (слайди 8, 9 )
4 атома Гідрогену мають по 1 електрону. Це s- електрони з кулястою хмарою. Електронні хмари Карбону перекриваються з електронними хмарами Гідрогену. Утворюються ковалентні полярні зв’язки. Молекула має форму тетраедра. (демонстрація молекули)
 Структурна формула відображає послідовність з’єднання атомів у молекулі, але не відображає їх розміщення в просторі (це площинні схеми молекул) (слайд 10)
Структурна формула відображає послідовність з’єднання атомів у молекулі, але не відображає їх розміщення в просторі (це площинні схеми молекул) (слайд 10)
Реальну будову (розміщення атомів у тривимірному просторі) передають кулестержневі або маштабні моделі молекули. (ст. 106 мал. 47 П.П. Попель, Л.С. Крикля)

- Фізичні властивості метану. ( слайди 11,12 )
Робота з підручником (ст. 107 П.П. Попель, Л.С. Крикля )
-
 Поширення метану в природі. (слайди 13 – 16 )
Поширення метану в природі. (слайди 13 – 16 )
Повідомлення учнів за здалегідь заданим завданням
- Метан входить до складу природного газу (98%), є важливим компонентом попутного нафтового газу.
-
 Чимало метану в складі копального газу міститься у кам'яно-вугільних шахтах , тому його називають рудниковим газом. Вибухи суміші метану з киснем повітря (1:10) часто спричиняють масову загибель шахтарів.
Чимало метану в складі копального газу міститься у кам'яно-вугільних шахтах , тому його називають рудниковим газом. Вибухи суміші метану з киснем повітря (1:10) часто спричиняють масову загибель шахтарів.
Цікаво! У 19 столітті в сольовій копальні «Камера Спалена», що в горі Величка (Польща), були робітники, яких називали «грішниками, що каються». Вони надягали мокрий одяг з каптурами і повзали шахтами. Тримаючи в руці довгі ціпки, на кінці яких жевріли смолоскипи. У такий спосіб вони випалювали метан під стелею, не дозволяючи його концентрації сягнути критичної межі.
-
 Чимало метану утворюється внаслідок анаеробного бродіння рослинних решток у болотах (тому його називають болотний газ), річковому мулі, під час перетравлювання їжі великою рогатою худобою. Біогаз – продукт переробки фекалій і сміття – також переважно складається з метану.
Чимало метану утворюється внаслідок анаеробного бродіння рослинних решток у болотах (тому його називають болотний газ), річковому мулі, під час перетравлювання їжі великою рогатою худобою. Біогаз – продукт переробки фекалій і сміття – також переважно складається з метану.
Цікаво! Болотний газ хімічними методами вперше дослідив у 1776р. італійський природодослідник Алессандро Вольта і встановив його відмінність від водню. Також це природне джерело метану вивчали Бертолле, Дальтон, Берцеліус тощо. Болотний газ у неглибокій замуленій водоймі збирали в такий спосіб. Товстостінну склянку або пляшку занурювали у воду, аби вона заповнилася рідиною, потім повертали її догори дном, вставляли лійку і збирали метан, розпушуючи дно за допомогою ціпка. Коли в склянці збирався газ, її закорковували під водою й після цього виймали на поверхню.
-
 Трапляється метан і у Всесвіті. Його виявлено в атмосфері планет Юпітер, Сатурн, Уран і Нептун. Величезні озера рідкого метану є на поверхні Титана, найбільшого з природних супутників Сатурна.
Трапляється метан і у Всесвіті. Його виявлено в атмосфері планет Юпітер, Сатурн, Уран і Нептун. Величезні озера рідкого метану є на поверхні Титана, найбільшого з природних супутників Сатурна.
- Величезні обсяги метану надходять в атмосферу з рисових полів, боліт, тваринних ферм тощо. Науковці стверджують, що це не лише сприяє глобальному потеплінню, а й виснажує озоновий шар планети.
ІV. Узагальнення й систематизація знань.
Розв’яжи задачі:
- Обчислити відносну густину метану за повітрям.
![]()
![]() Дано:
Дано:![]() СН4
СН4
Dпов (СН4)-? Відповідь: відносна густина метану за повітрям 0,55.
- Обчислити масу 5л метану.
![]() Дано:
Дано:
V (CH4) = 5л ![]() ;
; ![]() ;
; ![]()
![]() M (CH4) = 12 + 4 = 16 (г/моль)
M (CH4) = 12 + 4 = 16 (г/моль)
m (CH4) - ? ![]()
Відповідь: маса метану 3,57г
Домашнє завдання: §17 ст. 104 – 107 з. 163 ст. 111 (до хімічних властивостей. Підручник П.П. попель, Л.С. Крикля )
Використані джерела:
- Березан О.В. Органічна хімія: Посібник для вчителів хімії та учнів загальноосвітніх шкіл, ліцеїв, гімназій, слухачів і викладачів підготовчих відділень вузів/ Березан О.В. – К.: Абрис, 2000.
- Боєчко Ф.Ф. та ін. Органічна хімія: Проб. Підручник для 10 – 11 класів (шкіл) хімічних профідів та класів (шкіл) з поглибленим вивченням предмета/ Ф.Ф. Боєчко, В.М. Найдан, А.К. Грабовий. – К.: Вища школа, 2001.
- Попель П.П. Хімія: підручник для 9 кл. загальноосвітніх навчальних закладів/ П.П. Попель, Л.С. Крикля. – К.: ВЦ «Академія», 2009.
- Шаблон презентації [Електронний ресурс] – Режим доступу http://pedsovet.su/load/97


про публікацію авторської розробки
Додати розробку
