Урок на тему "Хімічні властивості метану та його гомологів."
Урок на тему "Хімічні властивості метану та його гомологів." має на меті
ознайомити учнів з хімічними властивостями метану та його гомологів; навчити складати відповідні рівняння реакцій; установити залежність між будовою алканів та їхніми хімічними властивостями; розвивати вміння аналізувати, встановлювати причинно-наслідкові зв'язки, робити висновки; розглянути правила техніки безпеки при поводженні з вибуховими речовинами в побуті.
УРОК 3
Тема. Хімічні властивості метану та його гомологів.
Мета: ознайомити учнів з хімічними властивостями метану та його гомологів; навчити складати відповідні рівняння реакцій; установити залежність між будовою алканів та їхніми хімічними властивостями; розвивати вміння аналізувати, встановлювати причинно-наслідкові зв’язки, робити висновки; розглянути правила техніки безпеки при поводженні з вибуховими речовинами в побуті.
Тип уроку: засвоєння нового матеріалу.
Обладнання й матеріали: комп'ютери або мультимедійна дошка, комп’ютерна презентація.
Очікувані результати: наприкінці уроку учні мають характеризувати хімічні властивості метану та його гомологів; ілюструвати властивості речовин рівняннями хімічних реакцій; визначати дослідним шляхом насичені вуглеводні; встановлювати причинно-наслідкові зв’язки між складом, будовою та властивостями речовин; знати та дотримуватися правил безпечного поводження з органічними речовинами.
Хід уроку
І. Організаційний етап
- Інструктаж до роботи з комп’ютерною презентацією.
- Оголошення теми уроку (слайд 1). Визначення мети уроку (слайд 2).


ІІ. Активізація опорних знань учнів
Експрес-контроль
- Учні самостійно закінчують подані на екрані речення (слайд 3), працюючи у зошитах.
-

 Взаємоперевірка - обмінюються зошитами та перевіряють роботи, порівнюючи їх з відповідями на екрані (слайд 4).
Взаємоперевірка - обмінюються зошитами та перевіряють роботи, порівнюючи їх з відповідями на екрані (слайд 4).
ІІІ. Засвоєння нового матеріалу
1. Хімічна інертність алканів.
 Учні самостійно вивчають текст слайду 5.
Учні самостійно вивчають текст слайду 5.
-
Аналіз тексту за запитаннями вчителя:
- Чи є алкани хімічно активними речовинами?
- Чому? ( пригадати будову молекули метану, типи та характер зв’язків )
- Яку ще назву мають алкани?
- З якими речовинами не взаємодіють?
Розповідь вчителя:
- У XIX ст. алкани навіть називали «хімічними мерцями», але виявилося, що з деякими речовинами вони все ж таки взаємодіють.
- На слайді 6 демонструється відношення насичених вуглеводнів до розчинів кислот (на прикладі сульфатної кислоти), лугів (на прикладі натрій гідроксиду), калій перманганату ( відео демонстрація).
2. Взаємодія з киснем.
 Учні самостійно вивчають текст слайду 7.
Учні самостійно вивчають текст слайду 7.
-
Аналіз тексту за запитаннями вчителя:
- Як алкани взаємодіють з киснем?
- Що утворюється при горінні метану?
- Де використовується реакція горіння метану?
Перегляд відео демонстрації «Горіння метану» ( слайд 8 )
- Небезпечна суміш
Розповідь вчителя. Суміш метану з повітрям ( 10% метану ) є вибухонебезпечною. При використанні газових плит та котлів необхідно постійно стежити за тим, щоб полум’я не згасло. З метою діагностування витоку газу, у нього додають невелику кількість одоранту – речовини з відчутним, характерним запахом.
3. Окиснення гомологів метану.
Учні самостійно вивчають текст слайду 9.
-
 Аналіз тексту за запитаннями вчителя:
Аналіз тексту за запитаннями вчителя:
- Які продукти реакції утворюються при повному окисненні гомологів метану?
- Які продукти реакції утворюються при окисненні гомологів метану у нестачі кисню?
- Учні самостійно записують рівняння взаємодії бутану з киснем, який є в надлишку: 2С4Н10 + 13О2 → 8СО2 + 10Н2О.
- Учні самостійно записують рівняння взаємодії бутану з киснем, який є в нестачі: 2С4Н10 + 9О2 → 8СО + 10Н2О.
- Учні порівнюють свої рівняння із рівняннями, що з'являються на екрані.
Перегляд відео демонстрації «Горіння рідких алканів» слайд 10
4. Взаємодія з галогенами.
 Пояснення вчителя. Алкани — досить інертні сполуки, що пояснюється високою міцністю зв'язків С-С і С-Н. Вони взаємодіють тільки з дуже активними речовинами, наприклад, за реакцією заміщення вони взаємодіють із галогенами.
Пояснення вчителя. Алкани — досить інертні сполуки, що пояснюється високою міцністю зв'язків С-С і С-Н. Вони взаємодіють тільки з дуже активними речовинами, наприклад, за реакцією заміщення вони взаємодіють із галогенами.
Учні самостійно вивчають текст слайду 12.
 Пояснення вчителя. При реакції галогалогенування один атом галогену заміщає атом Гідрогену і входить до складу органічної молекули, а інший з'єднується з атомом Гідрогену, що заміщується, й утворює молекулу галоген оводню. В залежності від кількості галогену, що бер участь у реакції може заміщуватися різна кількість атомів Гідрогену.
Пояснення вчителя. При реакції галогалогенування один атом галогену заміщає атом Гідрогену і входить до складу органічної молекули, а інший з'єднується з атомом Гідрогену, що заміщується, й утворює молекулу галоген оводню. В залежності від кількості галогену, що бер участь у реакції може заміщуватися різна кількість атомів Гідрогену.
Назви утворених продуктів реакції походять від назв алканів і утворюються так само, як і назви розгалуджених алканів: до карбонового ланцюга алкану приєднані замісники – атоми галогену.
5. Термічний розклад.
 Пояснення вчителя. Як і для всіх органічних сполук, для алканів характерні реакції термічного розкладу.
Пояснення вчителя. Як і для всіх органічних сполук, для алканів характерні реакції термічного розкладу.
Учні самостійно вивчають текст слайду 13.
- Учні самостійно записують рівняння термічного розкладу метану і етану: СН4 → С + 2Н2, С2Н6 → 2С + 3Н2.
- Учні порівнюють свої рівняння із рівняннями, що з'являються на екрані.
Пояснення учителем процесу крекінгу.
6. Демонстрація розкладу парафіну.
Учні переглядають дослід на слайді 14.
- Аналіз досліду за запитаннями вчителя:
- Які продукти реакції розкладу парафіну?
- Газ, що утворюється в процесі горіння алкану, пропускають через розчин кальцій гідроксиду. Для визначення якого газу це робиться?
- Яка речовина збирається в пробірці?
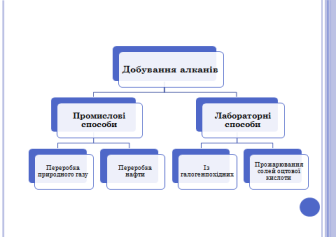
7. Джерела алканів та способи їх добування ( слайд 15 )
8. Добування алканів в лабораторії І спосіб.
 Учні самостійно вивчають текст слайду 16.
Учні самостійно вивчають текст слайду 16.
Пояснення вчителя. У цій реакції атоми Натрію завдяки великій хімічній активності відщеплюють атоми Хлору від молекули хлорметану й утворюють стійку сполуку - натрій хлорид. Метильні радикали, що при цьому залишаються, об'єднуються один з одним з утворенням алканів. Зверніть увагу, що в цій
реакції відбувається збільшення довжини карбонового скелета: в молекулі продукту реакції атомів Карбону більше, ніж у молекулах реагентів.
Уперше цю реакцію вивчив французький учений Шарль Вюрц, тому зараз взаємодію галогенопохідних алканів з натрієм називають реакцією Вюрца.
Якщо взяти сполуку іншого алкану з іншим галогеном, то реакції відбуватиметься аналогічно.
9. Добування алканів в лабораторії ІІ спосіб.
Перегляд відео демонстрації «Добування метану в лабораторії» ( слайд 17 )
 Пояснення вчителя. Іншою відомою реакцією є метод Дюма. Він полягає в тому, що сіль органічних (карбонових) кислот прожарюють у присутності лугів. Наприклад, при прожарюванні натрій ацетату (солі оцтової кислоти) з натрій гідроксидом утворюється метан:
Пояснення вчителя. Іншою відомою реакцією є метод Дюма. Він полягає в тому, що сіль органічних (карбонових) кислот прожарюють у присутності лугів. Наприклад, при прожарюванні натрій ацетату (солі оцтової кислоти) з натрій гідроксидом утворюється метан:
Зверніть увагу, що в цій реакції відбувається зменшення довжини карбонового скелета: в ланцюгу оцтової кислоти два атоми Карбону, а в продукті реакції — метані — на один атом Карбону менше
ІV. Перевірка розуміння і корекція засвоєння учнями нового матеріалу
- Учні самостійно виконують завдання подані на екрані (слайд 19), працюючи у зошитах.
- Самоперевірка –порівняння результатів з відповідями на екрані (слайд 20).
-

 У випадку неправильних відповідей, учні задають уточнюючі питання вчителю.
У випадку неправильних відповідей, учні задають уточнюючі питання вчителю.
V. Підведення підсумків уроку
Домашнє завдання: Опрацювати § 19 ( Хімія 9 кл. П.П.Попель ). Виконати завдання № 178, 180
Використані джерела:
- Березан О.В. Органічна хімія: Посібник для вчителів хімії та учнів загальноосвітніх шкіл, ліцеїв, гімназій, слухачів і викладачів підготовчих відділень вузів/ Березан О.В. – К.: Абрис, 2000.
- Боєчко Ф.Ф. та ін. Органічна хімія: Проб. Підручник для 10 – 11 класів (шкіл) хімічних профідів та класів (шкіл) з поглибленим вивченням предмета/ Ф.Ф. Боєчко, В.М. Найдан, А.К. Грабовий. – К.: Вища школа, 2001.
- Попель П.П. Хімія: підручник для 9 кл. загальноосвітніх навчальних закладів/ П.П. Попель, Л.С. Крикля. – К.: ВЦ «Академія», 2009.
- Видеоуроки по органической химии [Електронний ресурс] – Режим доступу http://www.himikatus.ru/org_video.php

про публікацію авторської розробки
Додати розробку
