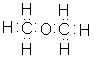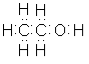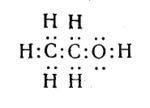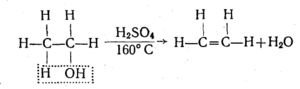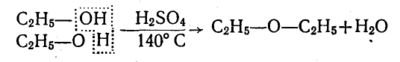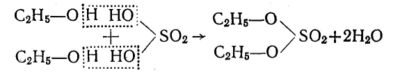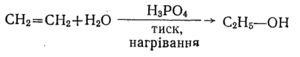Урок на тему "Насичені одноатомні спирти. Властивості, застосування"
Методична розробка відкритого заняття з дисципліни "Хімія". На основі теоретичних знань з використання інноваційних технологій навчання, надані практичні рекомендації щодо їх використання при вивченні теми "Спирти". Рекомендовано для викладачів хімії вищих навчальних закладів І-ІІ рівнів акредитації, вчителів хімії.
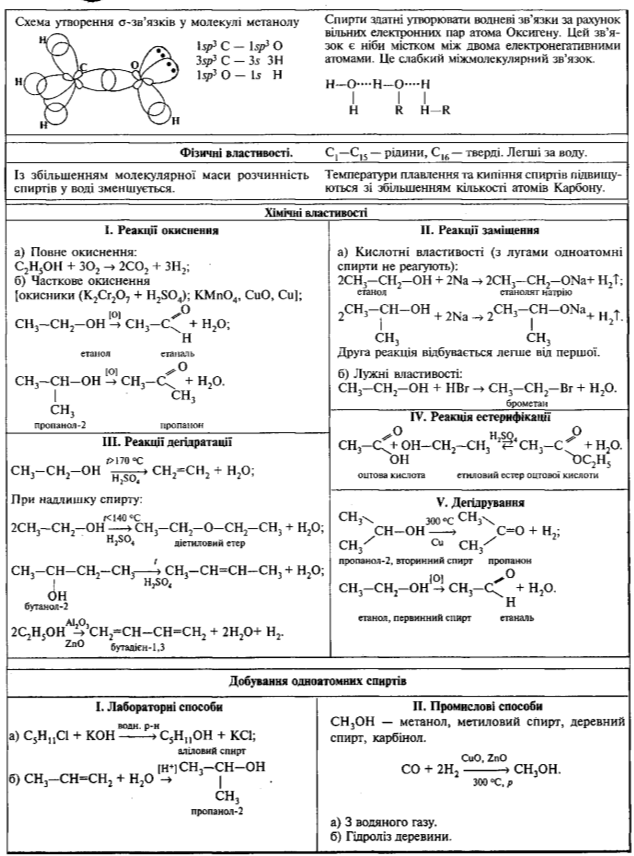
І Тема: Насичені одноатомні спирти, склад та будова молекул. Фізичні та хімічні властивості. Вплив спиртів на організм людини.
II Мотивація теми:
Одним з найпоширеніших класів оксигеновмісних органічних сполук є спирти. Саме з цього класу сполук починається вивчення гетероелементних органічних речовин.Вивчення реакційної здатності спиртів, дасть можливість прогнозувати перетворення цих сполук в організмі людини, а також синтезувати лікарські сполуки із заданими властивостями.
III Навчальні цілі:
Студент повинен знати:
- Класифікацію спиртів;
- поширення в природі;
- фізичні властивості;
- склад і будову молекул;
- найвжливіші хімічні властивості метанолу, етанолу, зумовлені наявністю гідроксильної групи;
Студент повинен уміти:
- розрізняти одно- і багатоатомні спирти»;
- формулювати означення функціональної групи;
- складати структурні формули спиртів;
- виявляти залежність властивостей спиртів від їх будови, уміти наводити приклади і пояснювати їх;
- характеризувати водневі зв`язки та їхній вплив на фізичні властивості спиртів.
IV Виховна мета:
Сприяти формуванню логічного мислення при вивченні будови, властивостей органічних речовин та вмінню використовувати здобуті знання в подальшій практичній діяльності.
V Міжпредметні зв’язки:
Фамакологія – загальна рецептура(рідкі лікарські форми)
Фізіологія – фізіологічні властивості організму.
Анатомія – загальна будова нервової системи, системи травлення.
Хірургія – як один із варіантів антисептиків.
VI Вид заняття: Комбінований.
VII Тривалість заняття – 80 хвилин.
VIII Забезпечення заняття:
- Наочні посібники - таблиці, графологічні схеми.
- Роздатковий матеріал – тести.
- Технічні засоби навчання – мультимедійна лекція.
IX План і організаційна структура заняття.
|
№ п/п |
Основні етапи і навчальні питання |
Методи контролю та навчання |
Матеріали контролю, наочні посібники |
|
1.
2.
3.
|
I Підготовчий етап Організація заняття
Постановка навчальних цілей, мотивація.
Контроль знань з теми: «Вуглеводні» 1. Знати будову, фізичні та хімічні властивості, методи добування і застосування вуглеводнів; 2. Класифікацію вуглеводнів, давати їм назву за систематичною номенклатурою; 3.Складати рівняння реакцій, які характеризують властивості вуглеводнів.
|
Усне фронтальне опитування. Письмове опитування. Індивідуальне опитування.
|
Питання для фронтального опитування та усної відповіді. Картки для самостійної роботи.
|
X Матеріали для проведення заняття.
А. Матеріали контролю для проведення підготовчого етапу.
1. Усне опитування.
|
№ п/п |
Завдання
|
Правильна відповідь |
|
1.
2.
3.
4.
5.
6.
|
Які речовини називають вуглеводнями?
Залежно від хімічної будови і властивостей на які групи поділяють вуглеводні? Записати загальні формули відомих вам гомологічних рядів.
Які хімічні зв`язки характерні для насичених і ненасичених вуглеводнів?
Які сполуки називаються гомологами, а які ізомерами. Привести приклади
Які види ізомерії вам відомі?
Чому ненасичені вуглеводні здатні до реакцій приєднання, а насичені – ні?
Завдання.
|
Назва «вуглеводні» означає, що ці органічні сполуки складаються з двох елементів: вуглецю та водню.
СnH2n+2 – насичені вуглеводні(алкани, парафіни) СnH2n – ненасичені вуглеводні(етиленові) СnH2n-2 – ненасичені вуглеводні(ацетиленові) С6H2n-6 - ароматичні
Для насичених – одинарні, для ненасичених – подвійні, потрійні, ароматичні
Сполуки, подібні за будовою і хімічними властивостями, склад яких різниться між собою на групу СН2, називаються гомологами. СН4 С2Н6 С3Н8 Речовини, які мають однакові якісний, кількісний склад і молекулярну масу, але різну будову молекул, що спричиняє різні властивості, називаються ізомерами. СН3 – СН2 – СН2 – СН3 СН3 – СН2 – СН3
СН2 бутан ізобутан
Вид ізомерії, коли речовини відрізняються послідовністю зв`язків в молекулах, називається структурною ізомерією. Міжгрупова (міжкласова) – циклогексан і гексен Просторова – геометрична цис- і трансізомерія спричинена неоднаковим просторовим положенням різних замісників щодо подвійного звязку (цис- і транс-бутен-2). Ненасичені вуглеводні мають в складі молекули кратні звязки(подвійні і потрійні), наявністю π- зв`язку внаслідок перекривання електронних хмар поза площиною молекули. Тому для алкенів, алкінів характерні реакції приєднання, що відбуваються за йонним механізмом. Слово: Спирти
|
2. Сьогодні ми будемо вивчати клас органічних речовин, назву якого ви дізнаєтесь за допомогою інструктивної картки.
Завдання. Визначте до якого класу органічних сполук відноситься кожна речовина. Із букв вірної відповіді ви отримаєте нову для вас назву класу органічних сполук.
|
Речовина |
Вуглеводні |
|||
|
насичені |
етиленові |
ацетиленові |
ароматичні |
|
|
С5Н12 |
с |
е |
р |
ш |
|
С4Н10 |
п |
б |
т |
л |
|
С4Н8 |
ю |
и |
і |
с |
|
С2Н2 |
л |
о |
р |
ю |
|
С6Н6 |
г |
н |
т |
т |
|
С3Н4 |
а |
б |
и |
у |
V. Зміст теми заняття
Структурно-логічна схема
- Клас
|
Спирти |
- Властивості
|
Фізичні властивості
|
|
Хімічні властивості |
![]()
![]()
![]()
Взаємодія з Взаємодія з Реакції
металами галогеноводневими дегідратації
Окиснення
![]() 3. Склад і будова молекул
3. Склад і будова молекул




-
 Застосування
Застосування
![]()
![]()
VI. План та організаційна структура теоретичного заняття
|
№ п/п |
Основні етапи заняття, їх функції та зміст |
Навчальні цілі в рівнях засвоєння |
Методи контролю і навчання |
Матеріали контролю, наоч. ТЗН, інструкції, обладнання |
Час у хвилинах |
|
1 |
2 |
3 |
4 |
5 |
6 |
|
І |
Підготовчий етап |
|
|
|
|
|
1. |
Організація заняття |
|
|
|
2-3 хв |
|
2. |
Вивчення вихідного рівня знань, вмінь, навичок |
|
див. пункт 1,2 |
|
2-3 хв |
|
3. |
Контроль вихідного рівня знань, вмінь, навичок: а) характеристика класу вуглеводнів, будова їх молекул, властивості, значення |
|
Запитання, творче завдання |
Питання ІІ рівня |
10 – 15% 10-13хв. |
|
ІІ. |
Основний етап |
|
|
|
|
|
4. |
Вивчення нової теми: 1.План викладення лекційного матеріалу:
|
|
Практичний тренінг
Структурні формули
рівняння реакцій
рівняння реакцій
|
Типові формули задачі рівняння
Таблиці, схеми
|
60 -80% 55-70хв. |
|
ІІІ |
Заключний етап |
|
|
|
|
|
|
1.Закріплення та контроль засвоєння нової теми. 2. Підведення підсумків теоретичного заняття 3. Домашнє завдання |
Усне опитування |
Питання |
|
10% 9хв.
2 хв.
1хв. |
Література:
1. Домбровський А. В., Лукашова Н. І., Лукашов С. М. Хімія 10-11: Органічна хімія: підручн. для 10-11 кл.серед.загальноосв.шк. – К.: Освіта, 1998. – 192 с.
2. Писаренко А. П., Хавин З. Я. Курс органической химии. Учебник для вузов. Изд.3-е, перераб. и дополн.М., «Высш. школа», 1975.
3. Данильченко В. Є., Фрадіна Н. В. Хімія.10-11 класи: Навч. посібник. – Х.: Країна мрій, 2002. – 216с.
4. Ярошенко О. Г., Новицька В. І. Збірник задач і вправ по хімії: Навчальний посібник. К Ш.: Станіца, 1996. – 144 с.
Лекція
Одноатомні насичені спирти. Класифікація спиртів, властивості, застосування.
Мета: Дати поняття насичених одноатомних спиртів, їх склад, електронні та структурні формули, поняття функціональної групи,ознайомити з фізичними та хімічними властивостями, способами добування та застосуванням насичених одноатомних спиртів.
Обладнання матеріали: Періодична система хімічних елементів Д. І. Менделєєва, обладнання та набір реактивів для проведення лабораторних дослідів, мультимедійний проектор.
Базові поняття: функціональна група, одноатомні спирти, гвдроксильна група, гомологічний ряд, ізомерія, метенол, етанол, водневий зв'язок.
Тип заняття: Вивчення нового матеріалу.
Структура лекційного заняття
I. Організаційний етап
II. Перевірка домашнього завдання
Тести
III. Актуалізація опорних знань студентів
На екрані записані поняття:
а) перше і друге положення теорії будови органічних сполук;
б) хімічна будова;
в) функціональна група;
г) структурна формула;
д) ізомерія.
Іде фронтальна робота з поняттями.
Активізується увага на 2-ому положенні ТХБОС, особливо: будова речовини, взаємний вплив атомів в молекулі визначає властивості речовини.
IV. Вивчення нового матеріалу.
План
- Будова молекули етанолу.
- Гомологічний ряд насичених одноатомних спиртів.
- Фізичні властивості.
- Хімічні властивості.
- Добування та застосування насичених одноатомних спиртів.
- Історія виникнення етанолу.
- Фізіологічна дія спиртів на організм людини.
Зміст лекції
І. Організаційна частина.
ІІ. Повідомлення теми та мети заняття.
ІІІ. Актуалізація опорних знань. Повторення вивченого матеріалу.
1.Речовини яких гомологічних рядів при однаковій кількості атомів у молекулах ізомерні одна одній?
2. Які види структурної ізомерії для насичених, ненасичених і ароматичних вуглеводнів вам відомі?
3. Які ви знаєте види гібридизації валентних орбіталей? Наведіть приклади відповідних сполук.
4. Які хімічні властивості характерні для вуглеводнів, у молекулах яких є: а) прості; б) кратні; в) ароматичні зв`язки?
ІV. Вивчення нового матеріалу.
Кожен клас речовин відрізняється наявністю якихось атомів або груп атомів. Наприклад, в неорганічній хімії: кислоти – наявністю йона Гідрогену Н+, а основи – наявністю гідроксогрупи ОН-. Так і в органічній хімії похідні вуглеводнів відрізняються один від одного різними атомами – функціональною групою.
Функіональна група – це група атомів, яка зумовлює хімічні властивості речовини.
Якщо замінити в вуглеводневому ланцюзі один атом гідрогену на яку-небудь функціональну групу, одержимо похідні вуглеводнів. А наявність функціональної групи визначає принадлежність сполук до певного класу органічних сполук.
Сьогодні ми повинні познайомитися зі сполуками, в яких один атом гідрогену заміщений на гідроксильну групу – ОН. Ці сполуки носять назву – одноатомні спирти.
І. Будова молекули етанолу.
Завдання: Напишіть структурну формулу етану і один атом водню замініть на ОН групу.
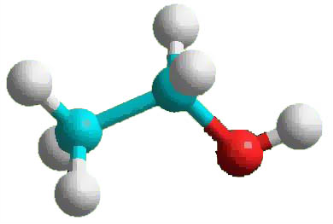
Запитання: 1. Яку речовину одержали? (СН3 – СН2 – ОН)
2. Як назвати цю речовину? (спирт)
3. Як можна відрізнити спирти від інших класів органічних сполук? (по ОН- групі)
4.Яке визначення спиртів ви можете передбачити?
Класифікація спиртів
1. За числом гідроксильних груп:
- одноатомні (одна група –ОН),
- багатоатомні (дві і більше груп –ОН)
2. За будовою радикалів:
- насичені ( наприклад, СН3-СН2-ОН)
- ненасичені, (СН2=СН – СН2 – ОН)
- ароматичні (С6Н5 – СН2 – ОН)
3. В залежності від того, з яким атомом Карбону (первинним, вторинним чи третинним зв’язана гідроксогрупа:
- первинні R – СН2 – ОН , СН3 – СН2 – ОН
-
 вторинні R2 – СН – ОН, СН3 – СН2 – СН– СН3
вторинні R2 – СН – ОН, СН3 – СН2 – СН– СН3
![]() ОН СН3
ОН СН3
-

 третинні R3 – С – ОН, СН3 С СН3
третинні R3 – С – ОН, СН3 С СН3
ОН
![]()
![]()
![]() Сьогодні ми познайомимося з насиченими одноатомними спиртами.
Сьогодні ми познайомимося з насиченими одноатомними спиртами.
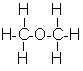
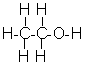
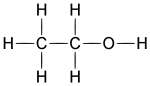 Молекулярна формула етилового спирту C2H6O, або C2H5—OH. Структурна формула:
Молекулярна формула етилового спирту C2H6O, або C2H5—OH. Структурна формула:
ІІ. Спирти, як і вуглеводні, утворюють гомологічні ряди. Кожний наступний член цього ряду відрізняється від попереднього на гомологічну різницю CH2.
Загальна формула одноатомних насичених спиртів CnH2n+1OH або R—OH, де R — вуглеводневий радикал. В таблиці наведений гомологічний ряд насичених одноатомних спиртів.
Нижчі спирти при звичайній температурі являють собою леткі рідини, а вищі, починаючи з C15H31—OH, — тверді речовини. Нижчі спирти з водою зміщуються у всіх співвідношеннях. З підвищенням молекулярної маси розчинність спиртів зменшується. Усі спирти легші від води. В міру збільшення молекулярної маси температура кипіння спиртів підвищується.
|
Гомологічний ряд насичених одноатомних спиртів |
|||
|
Вуглеводень, від якого походить спирт |
Формула |
Назва спирту |
Формула |
|
Метан |
СН4 |
Метиловий (метанол) |
СН3—ОН |
|
Етан |
С2Н6 |
Етиловий (етанол) |
С2Н5—ОН |
|
Пропан |
С3Н8 |
Пропіловий (пропанол) |
С3Н7—ОН |
|
Бутан |
С4Н10 |
Бутиловий (бутанол) |
С4Н9—ОН |
|
Пентан |
С5Н12 |
Аміловий (пентанол) |
С5Н11—ОН |
|
Гексан |
С6Н14 |
Гексиловий (гексанол) |
С6Н13—ОН |
|
Гептан |
С7Н16 |
Гептиловий (гептанол) |
С7Н15—ОН |
|
Октан |
С8Н18 |
Октиловий (октанол) |
С8Н17—ОН |
|
Нонан |
С9Н20 |
Ноніловий (нонінол) |
С9Н19—ОН |
|
Декан |
С10Н22 |
Дециловий (децинол) |
С10Н21—ОН |
Назви насичених одноатомних спиртів
За номенклатурою, що склалася історично, назва одноатомного спирту походить від назви радикала, з яким сполучена гідроксильна група.
СН3ОН – метиловий спирт, С3Н7ОН – пропіловий.
За систематичною номенклатурою назву спирту утворюють від назви відповідного насиченого вуглеводню, додаючи до неї суфікс –ол. Положення гідроксильної групи позначають номером атома карбону, біля якого вона розміщена. Нумерацію вуглецевих атомів починають з того кінця, до якого ближча функціональна група, наприклад:
![]() Н3С – СН2 – СН2 – СН2–ОН Н3С – СН – СН2 – ОН
Н3С – СН2 – СН2 – СН2–ОН Н3С – СН – СН2 – ОН
СН3
1- бутанол 2-метил-1- пропанол
Завдання.
Напишіть структурні формули і назвіть спирти із:
|
І варіант 4-ма атомами Карбону
|
ІІ варіант 5-ма атомами Карбону |
Перевірка через мультимедійний проектор
Назви спиртів – похідних розгалужених вуглеводнів – складають таким чином.Вибирають головний вуглеводневий ланцюг, який повинен включати атом С, сполучений з групою ОН. Нумерують атоми С головного ланцюга таким чином, щоб карбон з групою ОН одержав менший номер:
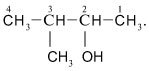
Назви складають, починаючи з цифри, що вказує положення замісника в головному вуглеводневому ланцюзі: «3-метил…» Потім називають головний ланцюг: «3-метилбутан...» Накінець додають суффікс -ол-(назва групи ОН) і цифрою вказувають атом Карбону, з яким зв`язана група ОН:
«3-метилбутанол-2».
Якщо замісників при головному ланцюзі декілька, їх перераховують послідовно, вказуючи цифрою положення кожного. Замісники, що повторюються в назві записують за допомогою префіксів «ди-», «три-», «тетра-» и т.д. Наприклад:
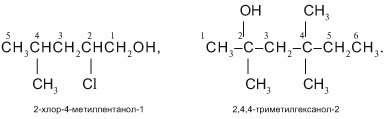
Ізомерія спиртів зумовлена розгалуженням карбонового ланцюга їх молекули, а також положенням функціональної(гідроксильної) групи, міжкласова ізомерія.
При складанні назви ізомеру нумерація атомів Карбону починається з того кінця карбон-карбонового ланцюга, до якого ближче функціональна група. Номер атома Карбону, при якому знаходиться гідроксогрупа, вказується в кінці назви спирту, положення вуглеводневого радикала вказується на початку назви. Наприклад:![]()
4-метилпентанол-2 (але не 2-метилпентанол-4)
Завдання.Складіть по одному ізомеру спиртів молекулярної формули С6Н13ОН з головним карбоновим ланцюгом:
а) С6, б) С5, в) С4, г) С3
і назвіть їх.
Розв`язок
1) записуємо головні вуглеводневі ланцюги з заданим числом атомів С, залишаючи місце для атомів Н (їх укажемо пізніше):
а) С–С–С–С–С–С; б) С–С–С–С–С; в) С–С–С–С; г) С–С–С.
2) Довільно вибираємо місце приєднання групи ОН до головного ланцюга і при внутрішніх атомах С указуємокарбонові замісники:
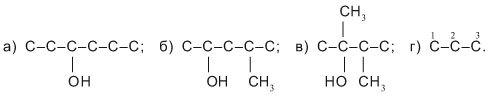
В прикладі г) немає можливості розмістити три замісники СН3– при атомі
С-2 головного ланцюга. У спирту С6Н13ОН немає ізомерів із трьохкарбоновим головним ланцюгом.
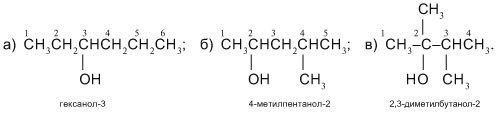
3) Розставляємо атоми Н при атомах Карбону в головному ланцюзі ізомерів а)–в), керуючись валентністю карбону С(IV), і називаємо сполуки:
- міжкласова ізомерія: спирти і етери(прості ефіри) – ізомери.
![]()
![]()
![]()
![]()
![]()
![]()
![]() Н Н Н Н
Н Н Н Н
Н - С - С - О -Н Н -С-О-С Н
![]() Н Н Н Н
Н Н Н Н
ІІІ. Фізичні властивості спиртів.
Спирти з числом атомів Карбону до 15 — рідини, інші — тверді речовини. Метанол і етанол — безбарвні рідини, з характерним запахом, добре розчинні у воді. Температура кипіння метанолу — 65oС, етанолу — 78oС, пропанолу 97oС, бутанолу – 117oС.
З водою етанол змішується в будь-яких пропорціях. Етиловий спирт є добрим розчинником для багатьох органічних, а також неорганічних речовин. Будова спиртів пояснює їхні деякі фізичні властивості. Нижчі спирти – це рідини, вищі – з кількістю вуглецевих атомів понад 12 – тверді речовини. Темперетури кипіння набагато вищі від температур кипіння алканів з такою ж молекулярною масою.
tкип С2Н5ОН= +78oС, а пропану С3Н8= - 42 oС
Чому спирти мають високі температури кипіння?
Причиною цього є легкість утворення так званих водневих зв`язків між молекулами спирту, які у формулах позначаються крапками:
… О – Н … О – Н … О – Н …
׀ ׀ ׀
R R R
Водневі зв`язки не міцні (17 – 22 кДж/моль), але вони впливають на фізичні та хімічні властивості спиртів, спричиняючи асоціацію їхніх молекул, які ніби прилипають одна до одної. При випарюванні спиртів водневі зв`язки розриваються, що викликає додаткові витрати енергії. Саме цим пояснюється висока температура кипіння спиртів. Збільшення молекулярної маси звичайно призводить до підвищення температури кипіння. Утворенням водневих зв`язків між молекулами спирту і води пояснюється їх легка розчинність у воді.
Задача.
При повному згорянні 2,3 г органічної речовини утворилось 4,4 г Карбон (IV) оксиду, 2,7 г води. Відносна густина парів цієї речовини за повітрям дорівнює 1,59. Визначте молекулярну формулу речовини.
(Студенти розв'язують задачу самостійно, а один з них виконує завдання на зворотній стороні дошки.)
|
Знайти:
|
Розв`язок:
2 : 6 : 1 |
1. Написати можливі структурні та електронні формули речовин, емпірична формула яких С2Н6О.
(Студенти самостійно роблять спроби виконати завдання; пізніше ці результати записують на дошці.)
Варіанти можливих записів:
|
|
|
|
|
|
|
Аналіз: всі атоми Н рівноцінні, зв'язані σ зв'язком з атомами Карбону |
Один атом Н сполучений з атомом Карбону через атом Оксигену, тобто знаходиться в особливому положенні. |
- міжкласова ізомерія: спирти і етери(прості ефіри) – ізомери.
Висновок: атоми Гідрогену повинні характеризуватися різними властивостями.
ІV. Хімічні властивості
Спирти проявляють високу реакційну здатніссть завдяки наявності в їхніх молекулах функціональної групи ОН.
1. Кислотно-основні властивості
У спиртах гідроксильна група надає етанолу слабкі лужні властивості, хоча він майже нейтральний, як вода. pH 100% етанолу 7,33, порівняно з 7 для води. Однак етанол реагує з лужними металами, такими як натрій, проявляючи свої кислотні властивості:
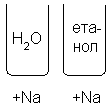
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2↑
|
Однак до класу кислот спирти не відносяться, так як ступінь дисоціації їх незначна – менше, чим у води, їх розчини не змінюють кольору індикаторів.
Проблема1 (відеофрагмент)
Проблема 2. Як впливає радикал на гідроксильну групу?
Висновок: Атоми Гідрогену у воді більш рухливі, ніж у спирті. |

 Н Н
Н Н
![]()
![]() Н – С – Сδ+ Оδ- Нδ+
Н – С – Сδ+ Оδ- Нδ+
![]()
![]()
Н Н
Інші атоми водню, що зв'язані безпосередньо з вуглецем, в реакцію не вступають. На прикладі цих реакцій ми вперше зустрічаємось з явищем впливу одних атомів на інші в молекулі. Суть цього впливу розглянемо на прикладі молекули етилового спирту, електронну будову якої можна зобразити в такому вигляді:
Як видно з цієї формули, гідроксильний атом водню займає в молекулі особливе положення. На відміну від інших атомів водню, він не безпосередньо зв'язаний з атомом Карбону, а через Оксиген. Атом Оксигену як більш активний елемент у більшій мірі, ніж Карбон, відтягує до себе спільну електронну пару. Внаслідок цього гідроксильний атом Гідрогену слабше зв'язаний в молекулі, ніж інші атоми Гідрогену, і є більш «рухливим», тому порівняно легко витісняється металом. Реакції спиртів з металами в дечому нагадують реакції кислот з металами. В молекулах спиртів гідроксильні атоми Гідрогену значно тісніше зв'язані з Оксигеном, ніж у молекулах кислот. Тому спирти на відміну від кислот не дисоціюють і йонів Гідрогену не утворюють.
У спиртах можуть заміщатися не лише гідроксильні атоми Гідрогену, а і вся гідроксильна група. Наприклад, при нагріванні етилового спирту з бромоводнем утворюється брометан:
(відеодослід)
2. Дегідратація
Для спиртів характерним є також реакції дегідратації (відщеплення води). Так, при нагріванні вище 160°С етилового спирту з надлишком концентрованої сульфатної кислоти як водовіднімаючого засобу від одної молекули спирту відщеплюється одна молекула води і етиловий спирт перетворюється в етилен:
При слабішому нагріванні (близько 140°С) суміші етилового спирту з сульфатною кислотою при надлишку спирту молекула води відщеплюється не від однієї, а від двох молекул спирту, внаслідок чого утворюється не етилен, а діетиловий ефір:
3. Реакція естерифікації
Крім того, для спиртів характерні також реакції взаємодії з кислотами, внаслідок чого утворюються складні ефіри. При цьому за рахунок гідроксильної групи кислоти і гідроксильного атома водню спирту утворюється молекула води, а за рахунок залишків молекул кислоти і спирту — молекули складного ефіру. Наприклад, при легкому нагріванні (не вище 100°С) етилового спирту з сульфатною кислотою утворюється сульфатноетиловий ефір або діетилсульфат:
![]()
![]()
![]() СН3СООН + НОС2Н5 ↔ СН3СООС2Н5 + Н2О
СН3СООН + НОС2Н5 ↔ СН3СООС2Н5 + Н2О
Етиловий естер
оцтової кислоти
4. Реакції окиснення (горіння)
C2H5OH + 3O2 → 2CO2 + 3H2O
(відеодослід)
5. Каталітичне окиснення етанолу.
Окиснення етилового спирту киснем повітря відбувається дуже легко в присутності хром (ІІІ) оксиду. Продукт реакції окиснення – оцтовий альдегід.
2 СН3-СН2-ОН + О2 → 2СН3-СОН + 2Н2О
Окиснення етанолу (тест на алкоголь)
Реакцію окиснення спиртів сильними окисниками використовують для встановлення факту алкогольного сп`яніння.
K2Cr2O7 + 3C2H5OH +4H2SO4 = 3CH3COH + Cr2(SO4)3 + K2SO4 +7H2O
зелений
6. Якісна реакція на етанол
Розрізнити етиловий і метиловий спирт можна за допомогою йодоформної проби. Йодоформ СНI3 виділяється у вигляді яскраво-жовтого осаду при дії на С2Н5ОН йоду в присутності лугу. ( 1 мл С2Н5ОН + 1-2 кр. йодної настойки, а потім розчин лугу, випадає осад жовтого кольору )
CH3CH2OH + I2 → CH3CHO + 2 HI
CH3CHO + 3 I2 → CI3CHO + 3 HI
CI3CHO + NaOH → CHI3↓ + HCOONa
Вищі спирти та більшість кетонів також дають цю реакцію, однак метиловий спирт йодоформ не утворює.
(відеодослід)
V. Способи одержання
Етиловий спирт добувають трьома способами: спиртовим бродінням цукристих речовин, гідролізом целюлози і синтетичним способом.
Бродіння цукристих речовин
Спосіб бродіння цукристих речовин є найстарішим. Вихідною речовиною для цього способу служать природні продукти, багаті на крохмаль: картопля, зерна пшениці, жита, кукурудзи тощо, а також целюлоза.
Для перетворення крохмалю в цукристі речовини його спочатку піддають гідролізу. З цією метою розтерту картоплю або борошно заварюють гарячою водою, щоб прискорити набухання крохмалю, а потім додають солод, тобто розтерті з водою пророслі зерна ячменю. В солоді міститься особливий фермент (органічна речовина, що відіграє роль каталізатора), під впливом якого відбувається оцукровування (гідроліз) крохмалю, тобто перетворення його в глюкозу. Цей процес сумарно зображають таким рівнянням:
- nC6Н10О5 + nН2O = nC6Н12O6
Після закінчення процесу гідролізу до суміші додають дріжджі, під впливом яких глюкоза піддається бродінню, тобто перетворюється на спирт і діоксид вуглецю:
- C6H12O6 = 2C2H5—OH + 2CO2 ↑
По закінченню бродіння рідину піддають перегонці і одержують спирт-сирець, який містить близько 90% етилового спирту і різні побічні продукти — пропіловий спирт C3H7—OH, ізобутиловий C4H9—OH і ізоаміловий C5H11—OH (так звані сивушні масла), які надають сирцю неприємного запаху і роблять його отруйним.
Спирт-сирець ректифікують (очищають) розгонкою на спеціальних ректифікаційних колонках і одержують спирт ректифікат (очищений), який містить близько 96% етилового спирту і 4% води. При такому співвідношенні спирт і вода утворюють нероздільно киплячу суміш (азеотроп). Тому методом перегонки не можна одержати 100%-ного спирту. Безводний, або так званий абсолютний, спирт одержують лише для спеціальних цілей обробкою спирту безводним сульфатом міді CuSO4, що поглинає залишки води і перетворюється в мідний купорос CuSO4 • 5H2O, який потім відділяють. У наш час використовують більш сучасні методи. Найпростіший - це осушка над активованими молекулярними ситами (3 чи 4 Анстрем). Найкращий - спочатку обробка металічним натрієм (переважно з ним реагує вода з утворенням NaOH та водню), потім ректифікація. Остаточно зберігають над молекулярними ситами.
Гідроліз целюлози
Картопля і зерно, на переробці яких базується виробництво етилового спирту за попереднім способом, — досить цінні харчові продукти. Тому їх намагаються замінити нехарчовою сировиною. В зв'язку з цим тепер уже знайшов широке застосування спосіб одержання спирту з целюлози, яка за своїм хімічним складом близька до крохмалю.
Цей спосіб ґрунтується на здатності целюлози (клітковини) піддаватися гідролізу під впливом кислот з утворенням глюкози, яку потім зброджують на спирт з допомогою дріжджів. З цією метою відходи дерева (ошурки, стружку тощо) нагрівають в автоклавах з 0,3—0,5%-ною сульфатною кислотою під тиском 7—10 атм. Целюлоза при цьому, подібно до крохмалю, гідролізує:
- (C6H10O5)n + nH2O = nC6H12O6
По закінченні процесу кислоту нейтралізують крейдою:
- H2SO4 + CaCO3 = CaSO4 ↓ + CO2 ↑
Малорозчинний сульфат кальцію відфільтровують, а розчин піддають бродінню, додавши дріжджі. Потім розчин направляють на ректифікаційні колонки для відгонки спирту.
Одержаний таким способом етиловий спирт називають гідролізним. Його застосовують лише для технічних цілей, бо в ньому міститься цілий ряд шкідливих домішок, зокрема метиловий спирт, ацетон тощо.
З одної тонни деревини можна одержати до 200 дм3 спирту. Це означає, що 1 т деревини може замінити 1 т картоплі або 300 кг зерна.
Добування синтетичного спирту
Цей спосіб базується на здатності етилену, при певних умовах, до реакції гідратації, тобто приєднання води з утворенням етилового спирту. Процес проводять у спеціальному контактному апараті під тиском понад 50 атм і температурі 280—300°С в присутності фосфатної кислоти як каталізатора.
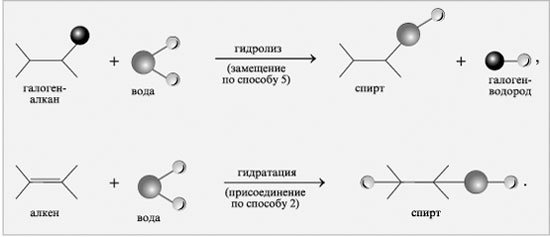
Гідроліз і гідратація – способи одержання спиртів
Застосування спиртів.
Застосування етанолу
Етанол як розчинник застосовується у харчовій промисловості, парфумерії, фармації, медицині (екстрагування, виготовлення настоянок тощо), у виробництві барвників, пластмас, лаків, політур, в якості антифризу, для синтезу оцтової кислоти, як пальне.
За способом С.В. Лєбєдєва з етанолу отримують бутадієн, що використовується у виробництві синтетичного каучуку.
Для технічних цілей в продаж поступає так званий денатурований спирт (денатурат). Для цього до етилового спирту додають денатуруючі речовини і забарвлюють його невеликою кількістю анілінового барвника.
Денатурат – дуже сильнодіюча отрута!
Вихідним продуктом для отримання етилового спирту слугують злаки, картопля, буряки, а також відходи паперового виробництва, і деревина. Сировий етиловий спирт містить у собі багато домішок, у тому числі отруйних масел.
Потім спирт очищують способом перегонки в особливих апаратах. Але і в отриманому таким шляхом спирті – ректифікаті, однак, все ж зберігається частина шкідливих для організму людини речовин.
Метанол
Метиловий спирт був уперше добутий у Х V ІІ ст., а вивчений у ХІХ ст. Його називають ще деревним спиртом за першим із відомих методів добування, а саме шляхом сухої перегонки деревини.
Метанол – розчинник. Цю властивість використовують в органічному синтезі та лабораторній практиці.
За допомогою хімічних перетворювань із метанолу добувають речовини, що є вихідними для виробництва пластмас, формальдегіду, складних ефірів антифризу.
Метанол додають в моторне топливо для підвищення октанового числа .
За тиждень до уроку група ділиться на чотири підггрупи, кожна з них отримує завдання підготувати інформацію про історію виникнення алкоголю, області використання етанолу та метанолу, способи добування насичених одноатомних спиртів, фізіологічна дія та шкідливий вплив алкоголю на організм людини.
Під час лекції члени підгруп обговорюють знайдену інформацію, використовують раздатковий матеріал і готуються до виступу. Викладач в кожній підгрупі визначає відповідального організатора, який керує роботою підгрупи, фіксуючи участь кожного студента.
Свій виступ підгрупа готує з застосуванням підготовлених слайдів презентації, (презентація додається).
6. Історія спирту
Етанол (інші назви: етиловий спирт, винний спирт, алкоголь; формула: С2Н5ОН) — наркотик, протоплазматична отрута; головна дієва складова алкогольних напоїв, які зазвичай виготовляються збродженням здатних до ферментації вуглеводів. Пиво вживали ще у прадавньому Вавілоні, а виготовлення вина відомо з сьомого тисячоліття до н. е. Можливе отримання вільного етанолу дистиляцією вперше було задокументовано арабськими алхіміками приблизно у Х-му сторіччі.
Етиловий спирт, вірніше рослинний хмільний напій, що його містить, був відомий людству з глибокої давнини. Вважається, що не менш ніж за 8000 років до нашої ери люди виготовляли легкі спиртні напої з фруктів і меду. Вперше спирт з вина отримали в 6-7 століттях арабські хіміки, а першу пляшку міцного алкоголю (прообразу сучасної горілки) виготовив перський алхімік Ар-Рази в 860 році.
У Європі етиловий спирт був отриманий із продуктів бродіння в 11-12 столітті, в Італії.
До Росії спирт вперше потрапив у 1386 році, коли генуезьке посольство привезло його з собою під назвою «аква віта» і презентувало царському двору.
У 1660 році англійський хімік і богослов Роберт Бойль вперше отримав зневоднений етиловий спирт, а також відкрив його деякі фізичні і хімічні властивості, зокрема виявивши здатність етанолу бути високотемпературним пальним для пальників . Абсолютний (безводний) етиловий спирт був отриманий у 1796 році російським хіміком Т.Є. Ловіцем.
У 1842 році німецький хімік Я.Г. Шіль відкрив, що спирти утворюють гомологічний ряд, відрізняючись на деяку постійну величину. Щоправда, він помилився, описавши її як C2H2. Через два роки, інший хімік Шарль Жерар встановив вірне гомологічної співвідношення CH2 і передбачив формулу і властивості невідомого в ті роки пропілового спирту .
У 1850 році англійський хімік Олександр Вільямсон, досліджуючи реакцію алкоголятів з етил йодидом, встановив, що етиловий спирт є похідним від води з одним заміщенням водню, експериментально підтвердив формулу C2H5OH .
Вперше синтез етанолу дією сірчаної кислоти на етилен здійснив у 1854 році французький хімік Марселен Бертло.
Перше дослідження метилового спирту було зроблено в 1834 році французькими хіміками Жаном-Батистом Дюма і Еженом Пеліго; вони назвали його "метиловим або деревним спиртом", так як він був виявлений в продуктах сухої перегонки деревини . Синтез метанолу з метилхлориду здійснив французький хімік Марселен Бертло в 1857 році . Ним же, вперше був відкритий в 1855 році ізопропіловий спирт, синтезований дією на пропен водної сульфатної кислоти .
Вперше третинний спирт (трет-бутанол, 2-метил-пропанол-2) синтезував в 1863 році відомий російський вчений А.М. Бутлеров, поклавши початок цілої серії експериментів у цьому напрямку .
Представник двоатомних спиртів - етиленгліколь - вперше був синтезований французьким хіміком А. Вюрцом в 1856 році Триатомний спирт - гліцерин - був виявлений у природних жирах ще в 1783 році шведським хіміком Карлом Шеєле, однак його склад був відкритий тільки в 1836 році, а синтез здійснено з ацетону в 1873 році Шарлем Фріделем.
Шановні друзі, вивчаючи фізичні та хімічні властивості спиртів, ми говорили про їх токсичність.
При попадании в організм 1-2 чайних ложки метанолу вражається зоровий нерв, що призводить до повної сліпоти, а споживання 30-100 мл призводить до смертельного випадку..
А яка ж дія на організм людини етанолу, який використовується для виготовлення алкогольних напоїв?
7. Біологічна дія спиртів.
Вплив етанолу та метанолу на організм людини.
Етиловий спирт діє на організм як наркотик. При вживанні, він, внаслідок високої розчинності, швидко всмоктується в кров і викликає поступове отруєння організму. Під впливом спиртного у людини послаблюється увага, загальмовується реакція, порушується координація рухів, з’являється розв’язність, погіршується робота серця, печінки, нирок, понижується зір.
Фізіологічна дія етанолу
Людина стає не лише неприємною, а й небезпечною. Наслідки вживання алкоголю ще згубніші, коли людина п’є постійно. Зловживання напоями, що містять етанол (інакше алкоголь), викликає страшне захворювання – алкоголізм.
Спирт при тривалій дії на організм людини викликає глибокі порушення нервової, серцево-судинної та травної системи.
Головна причина цирозу печінки – алкоголь, при зловживанні яким руйнуються клітини печінки, їх замінює фіброзна тканина.
Метанол та етанол – дуже подібні рідини, розрізнити їх можна тільки хімічним способом або за температурою кипіння.
Вживання метанолу призводить до трагічних наслідків. Адже метанол – дуже отруйна рідина.
Потрапляння в організм 10 мл метанолу спричинюють сліпоту, а 25 мл – смерть .
Важливо!
Метиловий спирт і етиленгліколь входять до складу антифризів.
Антифризи здатні викликати оп’яніння, та через 10-12 годин після їх приймання виявляються такі симптоми тяжкого отруєння: головний біль, нудота, слабкість, затемнення в очах і навіть повна втрата свідомості. Смерть наступає від мозкових розладів (через 1-2 доби) або враження нирок (через 1-2 тижня).
Метиловий спирт – нервово-судинна отрута, і його доза 100 г смертельна для людей. Навіть невелика кількість цього спирту вражають зоровий нерв та сітківку ока.
Особливо небезпечний алкоголь для молодих людей, бо в організмі, який росте, інтенсивно відбуваються процеси обміну речовин, і він особливо чутливий до його токсичної дії. Тому молоді швидше, ніж дорослі, можуть підірвати здоров’я, захворіти і деградувати як особливість.
V. Закріплення знань:
1. Які речовини називають спиртами?
2. Поясніть механізм утворення водневого зв`язку. Як він впливає на властивості спиртів?
3. Які види ізомерії характерні для спиртів?
4. Задача: Обчисліть об`єм водню (н.у.), який утворюється при взаємодії металічного натрію масою 3,45 г з надлишком етанолу.
Розв`язок.
|
m(Na) = 3,45 г C2H5OH
V(Н2)- ?
|
2С2Н5ОН + 2Na
ν(Na) =
ν(Na) : ν (H2) = 2 : 1
ν (H2) = ν(Na) /2= V(Н2) = 0,075 моль . 22,4 моль/л =1,68л
|
VI. Рефлексія.
Студенти виконують рефлексивний тест, який не підписують. У випадку згоди з твердженням ставлять знак «+» напроти нього.
Рефлексивний тест:
1. Мені це понадобиться в житті.
2. На уроці було над чим подумать.
3. На всі запитання, що у мене виникли, я одержав(ла) відповіді.
4. На уроці я попрацював(ла) добросовістно.
VІІ. Домашнє завдання.
Творче домашнє завдання(12 балів).
Студентам пропонується прийняти участь в змаганні на кращу шпаргалку. Відомо, що якщо добре попрацювати над виготовленням шпаргалки, то іспит можна легко скласти і без неї. Конспектувати навчальний матеріал пробують усі, але мало хто робить це грамотно. Ми проведемо змагання на кращу шпаргалку, але не просто шпаргалку, а витвір мистецтва. У центрі зобразимо декілька найголовніших ключових понять.. Виділимо їх шрифтом або кольором, обведемо або підкреслимо. Проведемо у різні боки стрілочки, зазначимо, яких понять стосуються ключові слова. Можна зробити малюнки-символи (піктограми). Можна творити, придумувати, пробувати різні варіанти. Умова лише одна: шпаргалка повинна бути зрозуміла будь-кому з присутніх.
Дидактичні матеріали до лекції з теми
«Насичені одноатомні спирти».
Алгоритм назв насичених одноатомних спиртів
- Назву спирту утворюють від назви відповідного насиченого вуглеводню, додаючи до неї суфікс –ол.
- Положення гідроксильної групи позначають номером атома Карбону біля якого вона розміщена.
- Нумерацію головного ланцюга необхідно починати з того кінця, до якого ближче функціональна група (- ОН)
- Указують положення і назви замісників.
Алгоритм запису формул спиртів
- Виділити назву вуглеводню на основі якого записати вуглецевий скелет в склад, якого входить гідроксильна группа.
- Пронумерувати атоми Карбону, починаючи з того кінця, до якого ближче функціональна група (- ОН)
- Дописати атоми Гідрогену скільки не вистачає.
- Перевірити правильність запису формули на основі валентності атома Карбону, що дорівнює чотирьом.
Завдання для контролю знань з теми:
«Насичені одноатомні спирти»
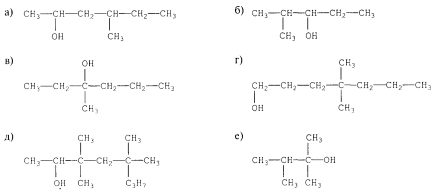
1.Назвіть за систематичною номенклатурою спирти, структурні формули яких наведено нижче:
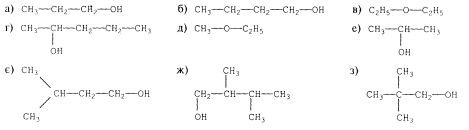
2.Знайдіть ізомери і гомологи серед речовин, формули яких мають вигляд:
3.Напишіть структурні формули таких спиртів:
а) 2-метил-2-гексанол; г) 1,2-бутандіол;
б) 3,4-диметил-2-пентанол; д) 2-метил-1,2-бутандіол;
в) 2,2-диметил-І-бутанол; е) 2-метил-1-пентанол.
4.Закінчіть запропоновані схеми хімічних реакцій:
а) пропанол + бромідна кислота →
б) окиснення 1-бутанолу →
в) гідроліз магній етаноляту→
г) окиснення 2-бутанолу→
д) пропанол ![]()
![]()
е) етанол ![]()
є) етанол + калій→
ж) горіння пропанолу→
з) внутрішньомолекулярна дегідратація 2-бутанолу→
и) міжмолекулярна дегідратація етанолу та пропанолу →
5.Які спирти можна добути гідратацією таких вуглеводнів:
а)1-бутену; б)2-бутену; в)2-пентену; г) 2-метилпропену.
6.Знайдіть кількість пропану, необхідну для добування 4 моль 1-пропанолу, якщо масова частка практичного виходу становить 50%.
Тестові завдання з теми:
«Ненасичені вуглеводні»
Варіант 1
|
1. |
Вкажіть загальну формулу представників гомологічного ряду алкенів. |
|
|
2. |
Як називають частинки з неспареними електронами: |
|
|
3. |
Вкажіть формулу найближчого гомолога ацетилену: |
|
|
4. |
Який тип реакцій характерний для ненасичених вуглеводнів: |
|
|
5. |
Назвіть сполуку: CH2 – СН – С = С - СН2- СН2- СНз │ │ СНз СНз |
|
|
6. |
При взаємодії пропену з бромною водою утвориться: |
|
|
7. |
Виберіть правильне твердження. У промисловості ацетилен добувають...
|
|
|
8. |
Скільки π -зв'язків містить молекула пропіну: |
|
|
9. |
Назви алкенів утворюються за допомогою суфікса: |
|
|
10.
|
Назвіть сполуку: CH2 = CH - СН – СН – СН – СНз │ │ │ СНз СНз СНз |
|
|
11. |
Виберіть правильне твердження. У молекулі етилену, на відміну від молекули ацетилену, є...
|
|
|
12. |
Ацетилен використовують : |
|
Тестові завдання з теми:
«Ненасичені вуглеводні»
Варіант 2
|
1. |
Яка формула другого члена гомологічного ряду алкінів: |
|
|
2. |
Вкажіть пару речовин, яку використовуюгь для добування ацетилену: |
|
|
3. |
Загальна формула ацетиленових вуглеводнів: |
|
|
4. |
Вкажіть групу речовин, які реагують з етеном: |
|
|
5. |
Вкажіть, до якого класу органічних речовин належить 2-пентин:
|
|
|
6. |
Назвати сполуку: СН2 = С – СН2 – СН3 │ СН3 – СН – СН2 – СН3 |
|
|
7. |
Вкажіть реактив для якісного виявлення ацетилену:
|
|
|
8. |
Які види ізомерії не характерні для алкенів: |
|
|
9. |
Назви алкінів утворюються за допомогою суфікса: |
|
|
10. |
Назвати сполуку: Сl │ CH ≡ C – С – СНз │ Сl |
|
|
11. |
Вкажіть, скільки спільних електронних пар є між атомами Карбону в молекулі етилену:
|
|
|
12. |
Вкажіть, яку масу хлору може приєднати етен кількістю речовини 0,1 моль:
|
|
Тестові завдання з теми:
«Ненасичені вуглеводні»
Варіант 3
|
1. |
Вкажіть, що спостерігається під час пропускання етену через бромну воду:
|
|
|
2. |
Вкажіть речовини, з яких добувають кальцій карбід: |
|
|
3. |
Вкажіть кількість спільних ковалентних пар між атомами Карбону в молекулі ацетилену:
|
|
|
4. |
Вкажіть речовину, яка утворюється на першій стадії приєднання водню до ацетилену:
|
|
|
5. |
Вкажіть речовини, які можуть приєднувати ненасичені вуглеводні:
|
|
|
6. |
Вкажіть кількість спільних електронних пар у молекулі ацетилену: |
|
|
7. |
Вкажіть назву речовини, яка утвориться під час неповного гідрування бутину -1:
|
|
|
8. |
Вкажіть вуглеводень, з якого у дві стадії можна одержати пропан: |
|
|
9. |
Визначте речовину А в реакції А + НВг → С3Н7Вг і вкажіть її формулу: |
|
|
10. |
Визначте речовини А і D в реакції А + 2D → С4Н6С14 і вкажіть їхні формули: |
|
|
11. |
Вкажіть назву речовини, яка утворюється під час взаємодії ацетилену із бромною водою у разі розриву всіх кратних зв'язків: |
|
|
12. |
Вкажіть, яку масу хлору може приєднати етен кількістю речовини 0,1 моль:
|
|
|
Сировиною для синтезу мурашиної ( метанової) кислоти є: |
|
Опорний конспект з теми: « Насичені одноатомні спирти»
Завдання №1
Визначте до якого класу органічних сполук відноситься кожна речовина. Із букв вірної відповіді ви отримаєте нову для вас назву класу органічних сполук.
|
Речовина |
Вуглеводні |
|||
|
насичені |
етиленові |
ацетиленові |
ароматичні |
|
|
С5Н12 |
с |
е |
р |
ш |
|
С4Н10 |
п |
б |
т |
л |
|
С4Н8 |
ю |
и |
і |
с |
|
С2Н2 |
л |
о |
р |
ю |
|
С6Н6 |
г |
н |
т |
т |
|
С3Н4 |
а |
б |
и |
у |
Завдання №2
Напишіть структурні формули і назвіть спирти із:
|
І варіант 4-ма атомами Карбону
|
ІІ варіант 5-ма атомами Карбону |
Завдання №3
Задача.
При повному згорянні 2,3 г органічної речовини утворилось 4,4 г Карбон (IV) оксиду, 2,7 г води. Відносна густина парів цієї речовини за повітрям дорівнює 1,59. Визначте молекулярну формулу речовини.
Закріплення знань.
Завдання №4
Задача: Обчисліть об`єм водню (н.у.), який утворюється при взаємодії металічного натрію масою 3,45 г з надлишком етанолу.
РОЛЬОВА ГРА "Суд над етанолом"
"Підсудний": Етанол (Алкоголь).
Дійові особи — студенти, які виступають у ролях: судді, секретаря, прокурора, адвоката, свідків, присяжних.
Оформлення "судового залу":
У центрі аудиторії попереду стоїть стіл суддів, справа — стіл адвоката, зліва — стіл прокурора. За столом адвоката — лава для підсудних. Навпроти суддів — лава для свідків. За окремим столом — присяжні.
Решта студентів — у "судовому залі", за зсунутими партами.
Секретар. Встати! Суд іде!
Суддя. Прошу сідати! Слухається справа по звинуваченню етанолу у злочинних діях проти людини і людства вцілому. Надається слово прокурору.
Прокурор.Шановний суддя.
Подана сьогодні на розгляд справа є непростою і досить важливою.
Етиловий спирт, речовина класу спиртів. У матеріалах, поданих на розгляд суду, наводяться незаперечні факти, які підтверджують: обвинувачений етанол, а він же алкоголь є першопричиною багатьох хвороб, він набагато вкорочує вік людини, спонукає до тяжких злочинів, є причиною моральної деградації, руйнує сім'ї, підриває економіку і добробут, під його дією скоюються аварії, внаслідок яких травмуються і гинуть люди, знищуються транспортні засоби та інші матеріальні цінності.
Поважний Суд! На основі оголошених фактів, я наполягаю на визнанні провини звинуваченого Алкоголю і винесенні йому самого суворого покарання. Даровані людині розум і совість вимагають від нас цього. У мене все.
Ваша честь, панове присяжні! Я закликаю вас уважно й неупереджено вислухати обидві сторони: обвинувачення і захисту, допитати свідків і всіх, хто захоче висловитися (Сідає.)
Суддя. Ввести підсудного!
("Підсудний" займає лаву справа за адвокатом.)
Суддя.Підсудний етиловий спирт, чи визнаєте ви себе винним у злочинних діях проти людини, ворогом її здоров'я та причиною названих нещасть?
Підсудний. Ні, ваша честь. Ворогом здоров'я людини та причиною її нещасть є сама людина, яка використовує мене, не враховуючи моїх властивостей.
Прокурор. Ваша честь! Прошу вислухати свідків зі сторони звинувачення.
Суддя. Викликається для свідчень експерт-хімік. Чи готові ви говорити правду і тільки правду?
Свідок Експерт-хімік. Так, ваша честь.
Суддя. Які факти злочинної дії Етанолу ви можете навести?
Я хочу повторити вам ще раз особливості будови молекул спиртів, а саме: Атоми Карбону в спиртах знаходяться в стані sp3-гібридизації. Зв`язки С-О і О-Н полярні. Тому на атомі Оксигену є частковий негативний, а на атомах С і Н – частковий позитивний заряди. Між позитивно поляризованим Гідрогеном однієї молекули і негативно поляризованим Оксигеном іншої молекули виникає електростатичне притягання – водневий зв'язок. Це призводить до підвищення температур кипіння спиртів в порівнянні з відповідними вуглеводнями і добрій розчинності нищих спиртів в воді.Етиловий спирт один з найбільш відомих представників цієї групи спиртів. Має всі типові для спиртів властивості. Одержати спирт можна :
Гідратацією етилену. Добутий у такий спосіб спирт застосовують для технічних потреб.
С2Н4 + Н2О → С2Н5ОН (на каталізаторі)
Гідролізом галогеналканів
С2Н5Cl + Н2О → С2Н5ОН + HCl ( в присутності лугу)
Відновленням альдегіду
СН3СНО + Н2 → С2Н5ОН (на каталізаторі)
або спиртовим бродінням вуглеводів (глюкози, сахарози, крохмалю)
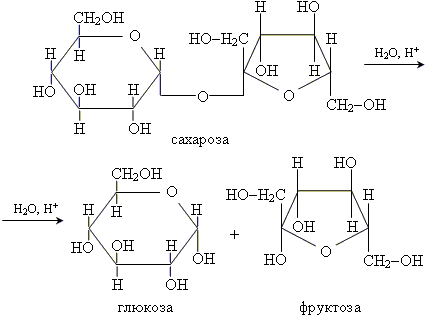 У результаті гідролізу сахарози утворюються моносахариди
У результаті гідролізу сахарози утворюються моносахариди
Глюкоза і фруктоза піддаються спиртовому бродінню.Це найдавніший метод добування етанолу.
Процес відбувається під впливом природних каталізаторів – ензимів, що виробляються деякими видами дріжджів. У загальному вигляді процес спиртового бродіння можна подати рівнянням:
С6Н12О6 → 2 С2Н5ОН + 2 СО2 (у присутності дріжджів)
Насправді утворюється суміш спиртів, у якій всього 12% етанолу. Для його виділення використовують метод дистиляції, або перегонки. У результаті утворюється так званий ректифікат, що містить 96% етанолу і 4% води.
Для цього процесу використовуються цінні харчові продукти цукор, картопля, злаки. Так отримують харчовий спирт, який іде в основному для виробництва алкогольних напоїв.
Суддя. Викликається для свідчень лікар-нарколог.
Чи готові ви говорити правду і тільки правду?
Свідок. Лікар-нарколог. Вживання алкоголю веде за собою гостру алкогольну інтоксикацію, яка називається у народі сп'янінням. Вражаючи центральну нервову систему, алкоголь порушує функції організму: послаблюється зір і слух, затьмарюється мислення і мовлення, притуплюється загальна чутливість і здатність реагувати, хода стає невпевненою і хисткою. Саме сп'янілі є суб'єктами і жертвами дорожньо-транспортних аварій. У стані сп'яніння людина може швидко переходити від веселого настрою до приступів люті, вона дезорієнтована у часі і просторі. Такі психічні порушення нерідко супроводжуються агресивною поведінкою, що призводить до сварок, бійки, наслідками яких є каліцтва і навіть смерть. Небезпека алкоголю в тому, що часте вживання його викликає потяг до випивання, або алкогольну залежність, з якою дуже важко боротися. Алкоголік — людина, яка не може протистояти цій залежності. Його організм уже вимагає поповнення алкоголем, причому у збільшених дозах. Чим дальше затягується цей процес, тим тяжчі його наслідки як фізичні, так і психічні, що врешті-решт ведуть до тяжких хвороб і передчасної смерті. Алкоголь спричиняє величезні матеріальні збитки, завдає фізичних і моральних травм своїй сім'ї.
Отже, алкоголізм — велике соціальне зло, джерелом якого є алкогольні напої.
Адвокат. Ваша честь, дозвольте репліку.
Суддя. Дозволяю.
Адвокат. Дякую. Дозволю собі зауважити, що свідок говорив про наслідки зловживання алкогольними напоями. Але ж ними можна і не зловживати...
Лікар-нарколог. Якби алкогольні напої не були шкідливими, не були засобом одурманювання, то й не було б такої проблеми, як алкоголізм з його згубними наслідками.
Суддя. Сідайте.
Викликається для свідчень лікар-терапевт. Чи готові ви говорити правду і тільки правду?
С в і д ок. Лікар-терапевт.Так, ваша честь.
В організм людини попав спирт. Що відбувається з цією речовиною? Приблизно 90% його затримується в печінці, де за допомогою ферментів він перетворюється в більш токсичний оцтовий альдегід( хімічно досить активну і дуже токсичну речовину) і оцтову кислоту.
Дослід. Опускаємо кусочок курячої печінки в спирт. Спостерігаємо за змінами на протязі 3-4 хвилин. (Ідентичні процеси відбуваються з печінкою людини).
Дія ацетальдегіду на організм – приголомшлива. Супроводжується блювотою, запамороченням. Ранковий перегар – це і є запах ацетальдегіду. Приблизно 90-95% вжитого алкоголю окиснюється і лише незначна частина виводиться з сечею (2-4%) і через легені з видихуваним повітрям (3-7%). Хоч ацетальдегід в невеликих кількостях організму необхідний. Він важливий для клітинного дихання. В крові здорової людини є невелика кількість спирту – 0,002%. Тому потрапляння додатково невеликої кількості алкоголю призводить до стану підйому, ейфорії. Полегшується засвоєння кисню, клітині легко і добре дихається. А ось алкоголю попало більше, клітина втрачає контроль настає наркоз, людина п`яніє.Клітини починають несамовито боротися з надлишком ацетальдегіду, окиснюючи його до оцтової кислоти.Свій альдегід при цьому, звичайно, не синтезується. Клітина виводить весь альдегід,але при цьому клітинне дихання утруднюється.Ось чому людина просинається з головним болем, замореною і розбитою. Цей стан називається похміллям. Вийти із нього можна за допомогою малої дози спирту – вернути природній рівень ацетальдегіду. Таким чином , сп’яніння – порівняно невелике перевищення нормальної концентраціє ацетальдегіду, стан «перепою» - його надмірний надлишок, а абсистентний синдром – недостатність. Падіння рівня ацетальдегіду лежить в основі патологічного потягу до алкоголю.
Уявимо людину, яка постійно вживає алкоголь. Клітина перестає синтезувати свій ацетальдегід. Тепер людина залежить від постачання алкоголю ззовні. Немає спирту – кожна клітина починає задихатися. Ця хвороба називається алкоголізмом.
Алкоголь крім того – наркотик, він входить в обмін речовин і стає життєво необхідним людині. Пацюка, наприклад, перетворювали в алкоголіка за 6 тижнів. Йому в клітку замість поїлки з питною водою ставили поїлку з 5% розчином етилового спирту. За 6 тижніву клітку ставили поїлку з чистою водою. Пацюк на воду уже не дивився.
Суддя. Сідайте.
Викликається для свідчень лікар-травматолог.
Чи готові ви говорити правду і тільки правду?
Свідок. Лікар-травматолог.Так, ваша честь.
Шановний суд! Пан терапевт досить точно охарактеризував цього негідника , який називається Алкоголем. Я повністю згоден з ним. Смію вас завірити, що нічого доброго в ньому немає. Насмілюся доповнити, що Алкоголь погіршує координацію рухів і точність виконання різноманітних дій, що нерідко призводить до дорожно-транспортних подій , тяжких травм і нещасних випадків . Дві треті ДТП відбуваються по вині водіїв, що знаходяться за кермом в стадії алкогольного сп`яніння. . Ще в давнину сп`яніння називали «добровільним безумством».
Суддя. Сідайте.
Викликається для свідчень лікар-кардіолог. Чи готові ви говорити правду і тільки правду?
Свідок. Лікар-кардіолог.Так, ваша честь.
Починають вживати спиртне звичайно в зв`язку з якою - небудь подією – днем народження, святом. Якщо людина слабовільна, вона шукає любий привід випити спиртне. П`яниця починає вживати Алкоголь і «з горя» і «з радості». «Для випивки є любі приводи» - одним словом.І того не знає людина , що горілка шкідлива і для серця, судин, крові. Алкоголь викликає ожиріння сердця, порушує кровонаповнення внутрішніх органів, знижує кількість гемоглобіну в крові, руйнує еритроцити.
Спирт швидко всмоктується в кров, добре розчиняється в міжклітинній рідині, потрапляє до всіх клітин організму, стикаючись з еритроцитами, призводить до звертання кров`яних пластинок. Вченими встановлено, що порушуючи функцію клітин, спирт викликає їх загибель:
100 грамів пива – гине 3 тисячі клітин мозку;
100 грамів вина – 500 клітин;
100 грамів горілки – 7500 клітин.
Токсична дія алкоголю на організм підлітка в декілька раз сильніша, чим на організм дорослої людини. Пояснюється це тим, що організм, який швидко росте має інтенсивний обмін речовин, велику швидкість кровотоку і більші зазори судин. Крім того, тканини організму підлітка багатші водою, що підсилює згубну дію алкоголю, так як характеризується здатністю в необмежених кількостях розчинятися в воді, відбираючи її у тканин організму.
Прошу врахувати , панове, в Стародавньому Римі і Стародавній Греції чоловікам заборонялося пити міцні напої до 25 років. Нам є над чим задуматися. У меня все, панове!
Суддя. Сідайте.
Викликається для свідчень лікар-гінеколог. Чи готові ви говорити правду і тільки правду?
Свідок. Лікар акушер-гінеколог.Так, ваша честь.
Панове! За виразом швейцарського вченого – невропатолога О.Фореля, «алкоголь – самый заклятый враг будущности человеческого рода». Давайте попробуємо розібратися в цьому. Зелений змій накладає свою погану лапу і отруює зловонним диханням ще не народжене покоління. Подумайте, панове! Ще не народились, а уже принесені в жертву!
Як же впливає алкоголь на ендокринну систему, а через неї на статеву?
Дослід. Протоплазма статевих клітин містить білок. Добавимо до розчину альбуміну (курячого білка) етанолу. Що спостерігаєте?
Ми зараз з вами ще раз впевнилися, що під впливом етанолу, навіть незнаяних його доз, кожна клітина, кожний орган, стикаючись з його молекулами, відчуває на собі токсичну дію.
Систематичне вживання алкоголю викликає пошкодження статевих клітин – сперматозоїдів и яйцеклітин, що може викликати хвороби плоду і дитини. Може народитися дитина з відставанням в рості і масі тіла, погано розвиватися фізично, схильна до різних захворювань з низьким рівнем імунітету. Центральна нервова система у дитини,народженої від алкоголіка, особливо тяжко вражена, стає помітною розумова відсталість – від порівняно легкої дебільності до повної ідіотії. Стан таких дітей не зворотній, і ніхто допомогти їм не зможе: такий дефект залишається на все життя. В сім`ях, де батьки зловживають алкоголем, 8,6% дітей являються недорозвиненими і хворими. В таких сім`ях в 2 рази частіше діти народжуються мертвими, а їх смертність в ранньому віці в 3 рази вище, ніж у сім`ях, де батьки не зловживають алкоголем..
Прошу звернути увагу, панове,що вчені Балаян и Кузьмін установили, що 90% розумово відсталих дітей, які займаються у допоміжних школах и інтернатах, - це діти або тих батьків, що п`ють, або алкоголіків.
Наслідки вживання алкоголю для новонародженого:
1) порушення харчування і обміну речовин у плоду (діти народжуютьсяз недостатньою масою тіла і потім дуже повільно набирають її ще довгий час після народження);
2) порушення будови черепа (голова до 1/3 разміру від нормальної, лоб низький і вузький, “вовча паща”, “заяча губа”);
3) зміни будови кінцівок (неповне разгинання в локтевих суглобах, деформація або вкорочення кісток, пальці одинакової довжини, можуть зростатися по всій довжині або мають високу перетинку (“жаб`яча лапа”);
4) зміна будови внутрішніх органів (3-х камерне “жаб`яче” серце, функціональні і потенційні розлади нервової системи).
Справедливо писав Л.М.Толстой, що « вино губит телесное здоровье и умственные способности; губит благосостояние семей и, что ужаснее всего, губит душу людей и их потомство».
У мене все, панове!
Суддя.Якщо етанол такий шкідливий, то для чого ж його виробляє хімічна промисловість в таких великих кількостях? Викликається для свідчень зі сторони захисту хімік – технолог.
Етанол використовують не тільки для виробництва алкогольних напоїв, його застосовують значно ширше. Етанол – один із найбільш поширених хімічних реактивів. Він незамінний як складова частина лікарських препаратів, як розчинник, є сировиною для виготовлення різноманітних речовин, а саме:
- вибухових речовин;
- нітроцелюлози та напівфабрикатів-спиртованих соків;
- морсів
- настоїв
- пектину
- оцту спиртового
- лікарських засобів
- виноградних, плодових та інших виноматеріалов
- синтетичного каучука
- барвників
- есенцій
- фотоплівок
- пороху
- пластмаси
- Для ракетних двигунів, двигунів внутрішнього згоряння в чистому вигляді.
- Застосовується для вироблення високоякісного палива та компоненту бензинів - етил-трет-бутилового ефіру, більш незалежного від викопної органіки.
Хімічна промисловість
- Служить сировиною для одержання багатьох хімічних речовин, таких, як ацетальдегід, діетиловий ефір, тетраетилсвинець, оцтова кислота, хлороформ, етилацетат, етилен та ін
- Широко застосовується як розчинник
- Є компонентом антифризу і склоомивачів.
- У побутовій хімії етанол застосовується в чистячих і миючих засобах
У парфюмерії
- Є універсальним розчинником різних речовин і основним компонентом духів, одеколонів, аерозолів і т. п.
У харчовій промисловості
Розчинник для харчових ароматизаторів. Застосовується як консервант для хлібобулочних виробів, а також у кондитерській промисловості
У зв`язку з важливістю етилового спирту при виробництві всіх перерахованих речовин, та діяльності хімічної, харчової промисловості та органічного синтезу прошу визнати етанол не винним та залишити в списку органічних речовин.
Суддя. Сідайте.
Викликається свідок фармацевт (Встає.)
Чи відома вам відповідальність за давання неправдивих свідчень?
Фармацевт. Так, ваша честь.
Суддя. Що вам відомо у справі підсудного.
Фармацевт
Етиловий спирт, складник усіх міцних напоїв, — цінний продукт, який використовується в медицині, без нього не обходиться фармацевтична промисловість, яка стоїть на сторожі здоров'я людини. Спирт — це засіб дезинфекції при ін'єкціях та операціях, складова частина багатьох лікарських препаратів (кардіовален і корвалол містять 96 – відсотковий спирт).
Етанол просто не замінний в медицині. Тому що він використовується
- як антисептик
- як знезаражувач
- при обробці операційного поля або в деяких методиках обробки рук хірурга; розчинник для лікарських засобів, для приготування настоянок, екстрактів з рослинної сировини та ін
- консервант настоянок і екстрактів
- піногасник при подачі кисню, штучної вентиляції легень
- у зігріваючому компресі
- для фізичного охолодження при лихоманці (для розтирання)
- антидот при отруєнні етиленгліколем і метиловим спиртом;
- можливе застосування як компонента парентерального харчування (у вигляді 5% розчину) в ослаблених хворих з урахуванням високої енергетичної цінності речовини
- компонент загальної анестезії в ситуації дефіциту медикаментозних засобів
Суддя. Чи є ще бажаючі виступити зі сторони захисту?
Адвокат. Шановний суддя, усі присутні в цьому залі!
Може, мій виступ видається декому незвичайним як для захисника підсудних. Незвичайність полягає в тому, що я не заперечуватиму властивості алкоголю про які говорили свідки звинувачення. Справді, вживання його негативно впливає на здоров'я людини, є причиною багатьох бід. Небезпечний він найбільше для юнацтва! І, здається, логічно було б просто заборонити виробництво спиртних напоїв — і проблема розв'язана. Та чи зніме проблему заборона? В історії різних держав уже були випадки запровадження "сухого закону", але бажаних наслідків це не дало. Та й не можна не погодитись із фактами, наведеними свідками захисту.
Не суперечу, надмірність в любій справі призводить до негативних, а нерідко і катастрофічних результатів. І в цьому випадку захоплення алкоголем очевидно може дати той ефект, на який нам указав пан Прокурор. Ну винуватцем в цьому , я вважаю , не сам Алкоголь, а ті конкретні люди, які піддаються його підступній чарівності. Саме вони, втративши почуття міри, пильність і волю, перш за все винуваті в своїй долі, а не той напій, до якого вини пристрастились. Ну і, звичайно, ті конкретні надзвичайні обставини, в які попадають люди. І все ж я повторюю, людина – міра всього, і, перш за все, треба питати з неї за її вчинки.
Все хорошо, друзья, что в меру.
Возьмем вино мы для примеру.
Вина избыток – как отрава,
А в меру выпьешь – так отрада!
Не наливай вина глупцу,
Полезно пить лишь мудрецу!
До речі, всі добре знають, що будь-якими ліками можна отруїтися, якщо вживати завелику дозу. «Усе є отрута й усе – ліки, відмінність лише в дозі» (Парацельс). А згадайте, скільки всього отруйного виробляє наша промисловість — від гербіцидів і до ядерної енергетики. Чи можемо ми все це заборонити, чи обійдемось без цього? То ж навіть після Чорнобильської трагедії, наслідком якої було отруєння не лише людей, а й усього живого, самої землі, — не заборонили виробництва ядерної енергії, а навпаки: добудували нові реактори на Рівненській та Хмельницькій АЕС. Отже, не про заборону потрібно говорити, а про поінформованість та культуру населення.
Сьогодні чомусь навіть державні керманичі, схоже, цього не розуміють, наскільки вразливий до дій алкоголю дитячий та юнацький організм, який росте, розвивається, зміцнюється або ж вони зовсім байдужі до свого народу. Чим можна пояснити представлення багаточисленних реклам алкогольних напоїв і майже повну відсутність інформації про їх шкідливість навіть у державних засобах масової інформації? Де ті телепередачі, ті фільми, які б заставили підлітка задуматись над загрозою алкоголізму чи наркоманії? Тож ми звернулися до рекламного агенства з проханням звернути особливу увагу на шкідливий вплив алкоголю на здоров'я підлітків і нації вцілому. То ж слово його представнику.
Рекламний агент. Алкоголь— це речовина, яка, як доведено, приносить і користь, і шкоду. А для чого Бог дав людині, своєму найвищому, найдосконалішому творінню, розум і волю? Ми повинні завше пам'ятати, що за порушення законів природи рано чи пізно настає суд і кара. Кара Божа, кара судова, кара хворобою, стражданнями. Тож звертаючись до молодих, юних, я хочу нагадати: перше ніж піднести до рота чарку, хто б до цього не спонукав, запитайте у свого розуму, чи потрібне йому затуманення, чи варто ризикувати здоров'ям заради короткочасного "кайфу".Ми розробили буклет, який є антирекламою алкогольних напоїв і пропонуємо його вашій увазі.
Якщо у вас є сила волі, якщо маєте людську гідність, то відстоюйте її і, як казав наш великий пророк Т. Шевченко, "образ Божий багном не скверніте!"
Адвокат. Дозвольте репліку!
Стриманість, самоконтроль і малі дози, Панове, – достатньо серйозні міри боротьби проти негативної дії Алкоголю. В відповідності зі сказаним, я прошу Суд признати звинуваченого не винним. (Сідає.)
Суддя.Заключне слово сторони звинувачення.
Прокурор.
“Шановні пані та панове! В ході судового розгляду Вам були представлені настільки аргументовані і переконливі докази вини підсудного , що я не хочу обтяжувати Вашу увагу новими фактами і доводами . У мене все”.
Суддя. “Заключне слово надається зі сторони захисту !”
Адвокат.
“Шановний Суд! Я повністю погоджуюся з моїм колегою в відношенні достатності пролунавших тут доказів однак, впевнений, що багато з них служать як раз виправданням моєму підзахисному. Прошу Вас, прийняти це до уваги при прийнятті рішення у даній справі”.
Суддя. Заключне слово надається підсудному.
Алкоголь
Поважний суд! Тільки що мене тут звинуватили в даремності і шкідливості існування. Гірко и образливо чути мені ці слова. Ви погляньте навколо і побачите мене. У вас немає апетититу – попробуйте випити трішки мене і апетит забезпечений. У вас виникли неприємності на работі або в сім`ї – я вас заспокою. А якщо ви застудилися або промерзли - я вас зігрію. Ну а якщо ти боязкий – скуштуй мене, і ти із несміливого станеш сміливим.
Адже довгі сотні тисяч років назад людина не знала алкоголю. Горілка появилася в нас в XVI столітті, коли алхіміками бул освоєний спосіб перегонки алькоголевмісних рідин. Уже тоді було висунуто припущення про особливі , цілющі властивості спирту, і розчини його спочатку продавались в аптеках під назвою «вода життя» або «вогняна вода».
Ще в 1552році цар Іван Грозний влаштовує в Россії великий кабак, тільки для опричніків. Пити цареву горілку – велика честь. Цареві кабаки, приносили великий прибуток, швидко поширювалися і з кінця XVI століття уже існували в великих містах.
Так що в некорисності мене докоряти ніяк не можна. У мене все, панове.
Суд для винесення вироку виходить в нарадчу кімнату.
Секретар. Перед оголошенням вироку прошу всіх встати!
Судья (оголошує вирок).
Суддя. Іменем Української держави, Іменем Вищої Ради медичної науки Великий суд постановляє:
Засудити етанол за те, що він :
1) призводить до отруєння організму;
негативно впливає на нащадків.
2) враховуючи значення етанолу в органічному синтезі, незамінність при виготовленні лікарських препаратів, залишити етанол в списку органічних речовин.
Однак, Суд хоче зробити особливе зауваження:
1) Необхідна широка і серйозна роз`яснювальна робота в суспільстві про згубну дію алкоголю на організм алкоголю.
2) Боротьба з п`янством повинна здійснюватися як засобами громадськості , так і особистими зусиллями і самовихованням кожної людини.
3) Вважати , що п`янство – страшний порок, який ганьбить честь людини.
4) Оголосити п`янству постійну і завзяту боротьбу.
5) Вирок остаточний і оскарженню не підлягає.
Л.Н.Толстой « Вино губит телесное здоровье и умственные способности; губит благосостояние семей и, что ужаснее всего, губит душу людей и их потомство»
Пифагор «Пьянство есть упражнение в безумии»
Тестові завдання з теми:
«Ненасичені вуглеводні»
Варіант 1
|
1. |
Вкажіть загальну формулу представників гомологічного ряду алкенів. |
|
|
2. |
Як називають частинки з неспареними електронами: |
|
|
3. |
Вкажіть формулу найближчого гомолога ацетилену: |
|
|
4. |
Який тип реакцій характерний для ненасичених вуглеводнів: |
|
|
5. |
Назвіть сполуку: CH2 – СН – С = С - СН2- СН2- СНз │ │ СНз СНз |
|
|
6. |
При взаємодії пропену з бромною водою утвориться: |
|
|
7. |
Виберіть правильне твердження. У промисловості ацетилен добувають...
|
|
|
8. |
Скільки π -зв'язків містить молекула пропіну: |
|
|
9. |
Назви алкенів утворюються за допомогою суфікса: |
|
|
10.
|
Назвіть сполуку: CH2 = CH - СН – СН – СН – СНз │ │ │ СНз СНз СНз |
|
|
11. |
Виберіть правильне твердження. У молекулі етилену, на відміну від молекули ацетилену, є...
|
|
|
12. |
Ацетилен використовують : |
|
Тестові завдання з теми:
«Ненасичені вуглеводні»
Варіант 2
|
1. |
Яка формула другого члена гомологічного ряду алкінів: |
|
|
2. |
Вкажіть пару речовин, яку використовуюгь для добування ацетилену: |
|
|
3. |
Загальна формула ацетиленових вуглеводнів: |
|
|
4. |
Вкажіть групу речовин, які реагують з етеном: |
|
|
5. |
Вкажіть, до якого класу органічних речовин належить 2-пентин:
|
|
|
6. |
Назвати сполуку: СН2 = С – СН2 – СН3 │ СН3 – СН – СН2 – СН3
|
|
|
7. |
Вкажіть реактив для якісного виявлення ацетилену:
|
|
|
8. |
Які види ізомерії не характерні для алкенів: |
|
|
9. |
Назви алкінів утворюються за допомогою суфікса: |
|
|
10. |
Назвати сполуку: Сl │ CH ≡ C – С – СНз │ Сl |
|
|
11. |
Вкажіть, скільки спільних електронних пар є між атомами Карбону в молекулі етилену:
|
|
|
12. |
Вкажіть, яку масу хлору може приєднати етен кількістю речовини 0,1 моль:
|
|
Хімічні властивості спиртів
Спирти проявляють високу реакційну здатність завдяки наявності в їхніх молекулах функціональної групи ОН.
1. Реакції заміщення:
а) Кислотно-основні властивості
Взаємодія з активними металами:
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2,
Спирти проявляють кислотні властивості – відщеплюється атом Гідрогену в вигляді протона.
б) У спиртах можуть заміщуватися не лише гідроксильні атоми Гідрогену, а і вся гідроксильна група. Наприклад, при нагріванні етилового спирту з бромоводнем утворюється брометан:
2. Дегідратація
а) внутрішньомолекулярна:
б) міжмолекулярна:
при нагріванні (близько 140°С) суміші етилового спирту з сульфатною кислотою при надлишку спирту молекула води відщеплюється не від однієї, а від двох молекул спирту, внаслідок чого утворюється не етилен, а діетиловий ефір:
3. Естерифікація
а) При легкому нагріванні (не вище 100°С) етилового спирту з сульфатною кислотою утворюється сульфатноетиловий ефір або діетилсульфат:
![]()
![]()
![]() б) при взаємодії етанолу з оцтовою кислотою утворюється оцтовоетиловий естер
б) при взаємодії етанолу з оцтовою кислотою утворюється оцтовоетиловий естер
СН3СООН + НОС2Н5 ↔ СН3СООС2Н5 + Н2О
Етиловий естер
оцтової кислоти
4. Реакції окиснення (горіння)
C2H5OH + 3O2 → 2CO2 + 3H2O
5. Каталітичне окиснення етанолу.
Окиснення етилового спирту киснем повітря відбувається дуже легко в присутності хром (ІІІ) оксиду. Продукт реакції окиснення – оцтовий альдегід.
2 СН3-СН2-ОН + О2 → 2СН3-СОН + 2Н2О
Окиснення етанолу (тест на алкоголь)
Реакцію окиснення спиртів сильними окисниками використовують для встановлення факту алкогольного сп`яніння.
K2Cr2O7 + 3C2H5OH +4H2SO4 = 3CH3COH + Cr2(SO4)3 + K2SO4 +7H2O
зелений
6. Якісна реакція на етанол
Розрізнити етиловий і метиловий спирт можна за допомогою йодоформної проби.
CH3CH2OH + I2 → CH3CHO + 2 HI
CH3CHO + 3 I2 → CI3CHO + 3 HI
CI3CHO + NaOH → CHI3↓ + HCOONa
жовтий
Вищі спирти та більшість кетонів також дають цю реакцію, однак метиловий спирт йодоформ не утворює.


про публікацію авторської розробки
Додати розробку