Урок на тему: "Спирти. Поняття про функцыональну групу."
Мета уроку - сформувати уявлення про спирти; дати поняття спирти, функціональна група; ознайомити учнів з представниками спиртів — метанолом, етанолом, навчити записувати їхні молекулярні, електронні та структурні формули; розглянути номенклатуру спиртів, їх хімічні та фізичні властивості.
Тема: Спирти. Поняття про функцыональну групу.
Мета: сформувати уявлення про спирти; дати поняття спирти, функціональна група; ознайомити учнів з представниками спиртів — метанолом, етанолом, навчити записувати їхні молекулярні, електронні та структурні формули; розглянути номенклатуру спиртів, їх хімічні та фізичні властивості.
Тип уроку: урок засвоєння нових знань.
Хід уроку
І. Актуалізація опорних знань
ІІ. Мотивація навчальної діяльності
ІІІ. Вивчення нового матеріалу
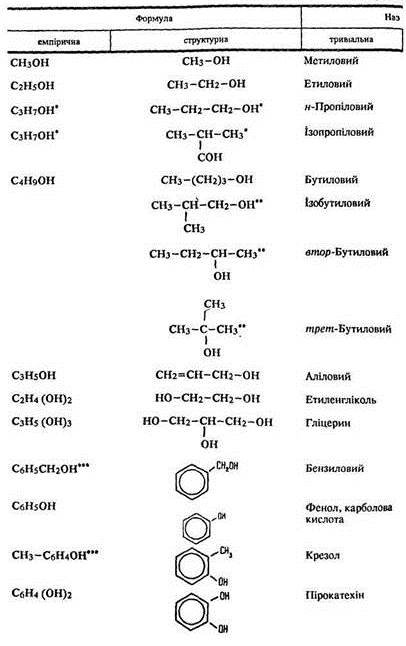
Серед речовин, до складу яких, крім вуглецю та водню, входить також кисень, виділяють такі: спирти, феноли, альдегіди, кетони, кислоти, етери (прості ефіри), естери (складні ефіри) і вуглеводи.
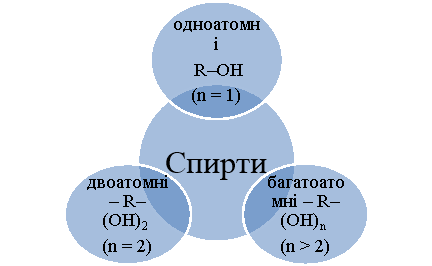
Спирти – це похідні вуглеводнів, у яких один або кілька атомів водню заміщені функціональною групою – гідроксигрупою –ОН. Загальна формула спиртів – R–(ОН)n, де R – вуглеводневий радикал.
Залежно від числа гідроксигруп спирти поділяють:
За характером вуглеводневого радикалу розрізняють аліфатичні спирти (насичені та ненасичені) і ароматичні.
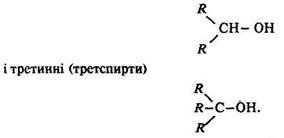
Залежно від положення гідроксигрупи (ії розташування біля первинного, вторинного чи третинного вуглецевого атома) розрізняють такі спирти: первинні – з загальною формулою R–СН2–ОН; вторинні (вторспирти)
Первинним є вуглецевий атом, який зв’язаний з іншим атомом вуглецю однією валентністю СН3–СН3, вторинним – з’єднаний з двома атомами вуглецю двома валентностями СН3–СН2–СН3, третинним – зв’язаний з трьома атомами вуглецю трьома валентностями 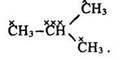
Поширення в природі. Спирти у вільному стані трапляються в рослинах (продукт бродіння глюкози) або в тваринних організмах (продукт метаболізму – етанол). У зв’язаному стані вони у вигляді ефірів входять до складу рослинних ефірних масел, восків, рослинних та тваринних жирів.
Фізичні властивості. Спирти, в молекулах яких міститься до 15 атомів вуглецю, – рідини, інші – тверді речовини. Всі вони легші за воду. Метанол, етанол та пропанол змішуються з водою в будь-яких співвідношеннях. Зі зростанням молекулярної маси розчинність спиртів у воді знижується. Вищі спирти практично не розчиняються у воді. Температури плавлення та кипіння і розчинність спиртів вищі, ніж вуглеводнів.
Хімічні властивості.
Реакції за участю гідроксигруп. Ці реакції можна поділити на дві групи: такі, що відбуваються з розривом зв’язку О–Н і з розривом зв’язку С–О.
1. Реакції, які відбуваються з розривом зв’язку О–Н. Спирти виявляють слабкі кислотні властивості, що слабшають із подовженням аліфатичного радикалу. Як відомо, аліфатичні вуглеводневі радикали мають позитивний індукційний ефект щодо атома водню, індукційний ефект якого приймається за нуль. Зі збільшенням довжини радикалу внаслідок посилення цього ефекту зменшується полярність зв’язку О–Н. Метанол має найсильніші кислотні властивості в ряду алканолів. Його ступінь дисоціації дуже малий (3х10–6%), тому водні розчини метанолу не змінюють колір індикаторів і в них не виявляються іони водню.
Алкоголяти – тверді речовини. Як солі слабких кислот вони гідролізуються у розчині, створюючи лужне середовище:
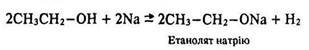
Взаємодія з металами. Спирти активно реагують з лужними металами, менш активно – з лужноземельними, магнієм і алюмінієм. Ці реакції належать до реакцій заміщення – виділяється водень і утворюються солі – алкоголяти (метаноляти, етаноляти, пропаноляти тощо):
![]()
Ця реакція є оборотною.
Взаємодія з лугами. Спирти за звичайних умов з лугами не взаємодіють, оскільки алкоголяти повністю гідролізуються. Проте підвищення температури і видалення води зміщує хімічну рівновагу в бік утворення алкоголяту:
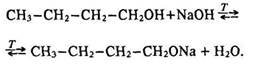
Взаємодія з кислотами. Спирти взаємодіють з органічними та мінеральними кисневмісними кислотами з утворенням естерів. Ці реакції називаються реакціями етерифікації. їх назва походить від слова ether, що означає ефір.
Під час взаємодії спиртів з органічними та мінеральними кисневмісними кислотами за наявності водопоглинальних засобів утворюються естери:
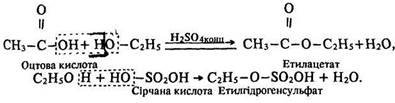
Внаслідок взаємодії надлишку спирту з сірчаною кислотою за температури 250 °С відбувається дегідратація спирту і утворюється диетиловий етер. Реакція протікає в дві стадії (порівняйте з попередньою реакцією):
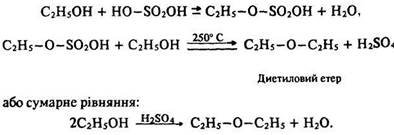
2.Реакції, що відбуваються з розривом зв’язку С–О. Під час пропускання сухогобромоводню крізь гарячий спирт за наявності речовини, що забирає воду, відбувається заміщення гідроксигрупи з утворенням алкілгалогеніду.
За рахунок негативного індукційного ефекту гідроксигрупи зв’язок С–О є поляризованим: СН3–СН2–>ОН. Взаємодія з полярною молекулою бромоводнюН–Вr відбувається за такою схемою:
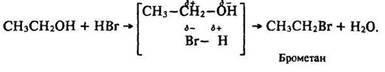
Реакції за участю гідроксигруп та вуглеводневих радикалів. Реакція дегідратації. Під час нагрівання спирту з концентрованою сірчаною кислотою до температури 350 °С (порівняйте з реакцією добування простих ефірів за Т = 250 °С) реакція дегідратації відбувається за іншим механізмом: відщеплюються водень вуглеводневого радикалу і гідроксигрупа, утворюється ненасичений вуглеводень – алкен; за 500 °С– алкадієн:
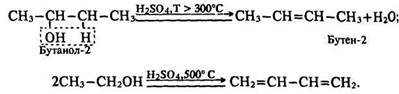
За правилом Зайцева водень відщеплюється від менш гідрогенізованого атома вуглецю, що стоїть у ланцюгу поруч з атомом вуглецю, зв’язаним згідроксигрупою. Таким чином, залежно від умов реакція дегідратації спиртів відбувається за різними механізмами з утворенням різних продуктів: за нижчих температур – етерів, за вищих – ненасичених вуглеводнів. Це явище використовують у промисловості – пропускаючи пару етанолу над каталізатором Аl2О3 (Т = 250 °С), добувають діетиловий ефір, а за температури 350° С– етилен, 500 °С – бутадієн. Окислення. Якщо спирт підпалити, він горить:
![]()
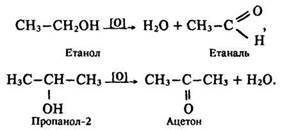
Під дією інших окисників (Н2СrO4, К2Сr2O7 + Н2SO4, КМnO4, Сu) утворюються альдегіди та кетони – спочатку окислюється атом вуглецю, зв’язаний згідроксигрупою, а потім відщеплюється вода. В результаті окислення первинних спиртів утворюються альдегіди, вторинних – кетони:
Під час нагрівання з металічною міддю відбувається реакція дегідрування:
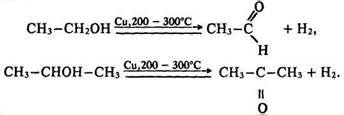
Альдегіди легко окислюються до кислот, тому за реакцією окислення первинних спиртів одержують відповідні кислоти:
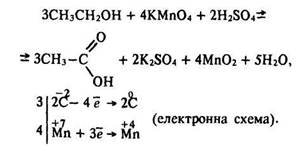
Ступінь окислення вуглецю розраховують за брутто-формулою етанолу С2Н6О та оцтової кислоти С2Н4О2.
Ароматичні спирти мають такі ж хімічні властивості, як аліфатичні.
ІV. Закріплення набутих знань
Тренувальні вправи
1. Напишіть структурні формули речовин (по ланцюжку біля дошки):
а) етиловий спирт; б) метанол;
в) гліцерин;
V. Підведення підсумків уроку.
VІ. Домашнє завдання


про публікацію авторської розробки
Додати розробку
