Урок "Окисно- відновні реакції"
Хімія
9 клас Дата:_______
Урок №___
Тема уроку: Окисно-відновні реакції . Процеси окиснення та відновлення
Мета: сформувати поняття: «окисно-відновна реакція», «процес окиснення», «процес відновлення», «окисник», «відновник»; навчити визначати окисно-відновні реакції за рівняннями; сформувати вміння визначати процеси окиснення та відновлення, окисник та відновник за електронними рівняннями; формувати навички складання електронного балансу окисно-відновних реакцій; розвивати логічне мислення, вміння порівнювати, аналізувати, робити висновки. Виховувати інтерес до предмету , бережливе ставлення до природи.
Ключові компетентності: спілкування державною мовою , уміння вчитися впродовж життя , екологічна грамотність і здоровий спосіб життя, математична компетентність.
Тип уроку: комбінований.
Базові поняття: окисно-відновна реакція, процес окиснення, процес відновлення, окисник, відновник.
Обладнання : підручники , зошити , роздатковий матеріал (картки , бланки з тестами) , мультимедійний проектор , ноутбук , пробірка , порошок магнію, хлоридна кислота, ложка для набирання речовини.
Лабораторний дослід «Реакція Магнію із хлоридною кислотою».
Перебіг уроку
- Організаційний момент
Психологічна хвилинка
Доброго дня діти ! Сьогоднішній урок хімії проведу для вас я. Мене звуть Слишай Альона Василівна. І розпочати наше з вами спілкування я хочу з народної мудрості : «З яким настроєм ви розпочинаєте день – таких успіхів і доб'єтеся». Тому я хочу , щоб ви зараз повернулися один до одного і посміхнулися , налаштувалися на гарний лад . У нас все сьогодні вийде гарно , все буде добре і ви найкращі.
Девізом нашого уроку сьогодні будуть слова давньогрецького філософа Сенеки : «Навчаємося не за ради школи , а задля життя !»
- Актуалізація опорних знань
На минулих уроках ви почали вивчати тему «хімічні реакції». Ви вже знаєте як класифікують реакції за кількістю і складом реагентів та продуктів реакції. Вмієте визначати ступені окиснення речовин. Тож давайте разом пригадаємо те, що ви знаєте !
1) Загадки . Відгадайте, про який тип реакції йде мова :
№ 1.
Я – одна з найлегших типів,
І проблем зовсім нема.
Речовин бери хоч три,
А в продуктах – лиш одна.(Сполучення)
№ 2.
Найщедріший тип – це я.
Результат тут фантастичний:
До реакції – одна ,
Після неї – вдвічі більше.(Розкладу)
№ 3.
А про вас ну що тут скажеш?
Були друзі хоч куди.
Я сильніший вижив з місця,
І тепер ось зайвий ти. (Заміщення)
№ 4.
Ми не знаємо обману,
Не втрачаєм доброти.
Обміняємося вмістом,
І не сваримося ми. (Обміну)
2)Робота у парах . Об'єднайтеся у пари. Користуючись підказками із загадок складіть будь – ласка по 1 хімічному рівнянню , що відповідають поданим схемам.
Пара №1 – рівняння сполучення;
Пара № 2 – рівняння розкладу;
Пара №3 – рівняння заміщення;
Пара № 4 – рівняння обміну.
Пара №5 – рівняння сполучення.
- Вправа «Хрестики та нулики»
а) Закресліть речовини, які мають ступінь окиснення 0:
|
Cl₂
|
HCl |
H₂O |
|
NH₃
|
N₂ |
NO |
|
N₂O
|
NO₂ |
O₂ |
б)Закреслити речовини, в яких елементи мають ступінь окиснення +2:
|
Cl₂О
|
NH₃
|
H₂O |
|
MgCl₂
|
СаО |
NO |
|
N₂O
|
NO₂ |
O₂ |
4) Гра « Морський бій»
Завдання гри таке : один з вас називає координати пострілу за таблицею яка показана на екрані , а хто з учнів у себе на столі знайде ці координати , той іде до дошки і виконує завдання , що сховане у конверті.
|
|
А |
Б |
Г |
|
1 |
NaCl |
Al2O3 |
Не влучили :) |
|
2 |
Нажаль ви промахнулись :) |
H2SO4 |
P2O5 |
|
3 |
K3PO4 |
FeCl2 |
Ви намагалися , але не влучили :) |
Ви гарно справились із завданнями, ви молодці!
- Мотивація навчальної діяльності учнів, повідомлення теми та мети уроку.
У III столітті до н.е. на острові Родос був побудований пам'ятник у вигляді величезної статуї Геліоса (у греків Бог Сонця). Грандіозний задум і досконалість виконання Колоса Родоського - одного з чудес світу - вражали всіх, хто його бачив. (показ колоса на слайді). Ми зараз не можемо сказати, як виглядала статуя, але відомо, що вона була зроблена з бронзи і досягла у висоту близько 33 м. Статуя була створена скульптором Харетом, на її будівництво пішло 12 років. Бронзова оболонка кріпилась до залізного каркасу. Порожнисту статую почали будувати знизу і, у міру того як вона росла, заповнювали каменями, щоб зробити її стійкішою. Приблизно через 50 років після завершення будівництва Колос звалився. Під час землетрусу він зламався на рівні колін. Вчені вважають, що причиною недовговічності цього чуда стала корозія металу, а в основі процесу корозії лежать окисно-відновні реакції.
Повідомлення теми та мети уроку
Завдання уроку:
- Дізнатися що таке окисно – відновні реакції.
- Зрозуміти суть понять «окисник» , «відновник» та «процеси окиснення» , «процеси відновлення».
- Навчитися визначати ступені окиснення елементів у хімічних реакціях.
- Розкрити значення окисно – відновних реакцій.
- Вивчення нового матеріалу
Порівняємо кілька хімічних перетворень :
+2 -2+1 +1 -1 +2 -1 +1 -2
- Zn(OH)2 + 2HCl = ZnCl2 + 2H2O (Обміну)
0 0 +2 -2
- 2Zn + O2 = 2ZnO (Сполучення)
+2 -2 +1 +2 -2 +1 -2
- Zn(OH)2 = ZnO + H2O (Розкладу)
0 +1 -1 +2 -1 0
- Zn + HCl = ZnCl2 +H2 (Заміщення)
Визначимо ступені окиснення елементів у наведених рівняннях.
А тепер порівняємо значення ступенів окиснення елементів у реагентах і продуктах реакції для кожного з наведених рівнянь . Ми бачимо , що у рівняннях - №1 і №3 жоден хімічний елемент не змінив ступені окиснення . А у рівняннях №2 та №4 – є елементи , які змінили ступені окиснення.
Отже , усі хімічні реакції за зміною ступенів окиснення поділяються на 2 групи:
- Окисно – відновні ;
- Реакції , що протікають без зміни ступеня окиснення.
Окисно – відновні реакції (ОВР) — це реакції, в яких відбувається зміна ступенів окиснення атомів елементів.
В ОВР одночасно протікають два протилежні процеси: окиснення і відновлення.
Окиснення — процес віддачі електронів.
Елемент, який віддає електрони — відновник.
Окиснення:
N+1−4e→N+5,
O−2−2e→O0,
C−4−6e→C+2,
N+1, O−2, C−4 — відновники.
Відновлення — процес прийняття електронів.
Елемент, що приймає електрони — окисник.
Відновлення:
S+6+2e−→S+4,
N0+3e−→N−3,
Cl+1+2e−→Cl−1,
S+6, N0, Cl+1 — окисники.
Лабораторний дослід «Взаємодія Магнію з хлоридною кислотою»
Mg + 2HCl = MgCl2 + H2↑
Давайте запишемо рівняння проведеного досліду і розставимо ступені окиснення елементів у речовинах. Який тип хімічного рівняння ?
Зверніть увагу!
В ОВР відновник окиснюється, а окисник відновлюється.
Сумарний заряд всіх частинок, що беруть участь в окисно-відновній реакції, не змінюється.
Окисно-відновні реакції є найпоширенішими в природі і на виробництві.
Перегляд відео «Значення ОВР»
Фізкультхвилинка для очей
- Закріплення вивченого матеріалу
Завдання 1. «Хто швидше?» Виконайте у парах. Установіть відповідність між схемою перетворення та кількістю електронів, відданих або приєднаних атомами, вкажіть окисник і відновник, процеси окиснення та відновлення.
|
А |
|
|
Б |
|
|
В |
|
|
Г |
|
|
Д |
|
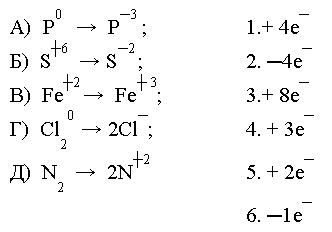
Завдання 2. Серед поданих рівнянь реакцій виберіть ті , які протікають із ступенем окиснення :
- H2S + O2→ SO2 + H2O ;
- 2NaCl + H2SO4 → Na2SO4 + 2HCl ;
- 2HgO → 2Hg + O2 ↑;
- Mg(OH)2 → MgO+H2O.
Завдання 3. Самостійна робота . Виконайте тести :
1. Вкажіть тип реакції, схема якої: А + ВС = АС + В:
А) обміну;
Б) розкладу;
В) сполучення;
Г) заміщення.
2. Елемент який приєднує електрони називається :
А) Окисник ;
Б) Розчинник ;
В) Замісник;
Г) Відновник.
3. Елемент який віддає електрони називається :
А) Окисник ;
Б) Розчинник ;
В) Замісник;
Г) Відновник.
4. Вкажіть визначення окисно-відновної реакції:
а) реакція, в якій беруть участь тільки складні речовини;
б) реакція, при протіканні якої змінюються ступені окиснення елементів;
в) реакція, протікання якої обов̓язково супроводжується тепловим ефектом;
г) реакція, яка протікає тільки між простими речовинами.
0 +5
5. Вкажіть перебіг електронів у процесі: Р → Р :
а) приєднання 5 електронів;
б) приєднання 3 електронів;
в) віддача 3 електронів;
г) віддача 5 електронів.
VI. Підсумок уроку
Вправа «Незакінчене речення»
- Реакції , що протікають із зміною ступеня окиснення називаються ….ОВР.
- Елемент , що віддає електрони – це …відновник.
- Елемент , що приєднує електрони - це…окисник.
- Процес віддачі електронів – це …окиснення.
- Процес приєднання електронів – це …відновлення.
Вправа «Поділись своїми враженнями від уроку»
(діти показують смайликами сподобався їм урок чи ні)
VІI.Домашнє завдання
Опрацювати параграф , що відповідає номеру хімічного елементу який розташований у ПСХЕ за такими координатами : 3 період , 7 група.
Виконайте вправи №1 ,№2 . * Підготуйте повідомлення значення окисно – відновних реакцій у житті людини.
Який це елемент? ( Сульфур), який параграф – 16.
Дякую вам за співпрацю , ви гарні , талановиті учні . Я бажаю вам успіхів у навчанні і високих злетів у житті. До побачення!


про публікацію авторської розробки
Додати розробку
