Урок Окисно-відновні реакції
Тема: Окисно-відновні реакції
Мета: розширити знання учнів про типи хімічних реакцій, закріпити навички розставляти коефіцієнти у хімічних рівняннях на прикладі окисно-відновних реакцій; навчити застосовувати при цьому метод електронного балансу; удосконалювати вміння визначати ступені окиснення атомів елементів у формулах складних речовин. Удосконалювати експериментальні навички. Розвивати логічне мислення, уміння аналізувати та порівнювати, навички і вміння роботи в групі. Виховувати науковий світогляд учнів, інтерес до предмета, почуття відповідальності за роботу в групі.
Тип уроку: комбінований урок засвоєння знань, умінь, навичок і творчого застосування їх на практиці.
Методи та прийоми: 1. Інформаційно-рецептивний: розповідь, бесіда,
інструктаж, робота з підручником.
2. Експериментальний: хімічні досліди.
3.Репродуктивний: тест.
4. Пошукові: евристична бесіда, виконання вправ,
робота в групах, взаємопов’язані питання.
5. Прийоми інтерактивного методу навчання: «Двоє –
третій зайвий», «Група – проект»,
6. Метод проектів: складання міні-проектів у групах.
Основні поняття і терміни: проста речовина, складна речовина; основні класи неорганічних сполук: кислоти, основи, оксиди. солі; йони; хімічні реакції:екзотермічні, ендотермічні, оборотні, необоротні, каталітичні, некаталітичні, окисно-відновні, без зміни ступеня окиснення; ступінь окиснення; окисник і відновник; процеси окиснення і відновлення; метод електронного балансу.
Обладнання: періодична система хімічних елементів Д.І.Менделєєва, таблиця розчинності, ряд активності металів; репродукція пам’ятника засновникам Києва на майдані Незалежності; таблиці «Правила роботи в групі», «Єдність процесів окиснення та відновлення»;комп’ютер, проектор, екран.
Реактиви та хімічний посуд: Fe (цвях), Zn, розчини NaOH, CuSO4, HCl; штатив із пробірками.
Епіграф до уроку: Вважай невдалим той день і ту годину, коли ти не засвоїв
нічого нового або не додав до своєї освіти.(Монтеск´є)
Хід уроку
І. Організаційний момент
ІІ. Актуалізація опорних знань.
Вправа «Двоє – третій зайвий»: вибрати зайву реакцію та пояснити свій вибір( слайд 1)
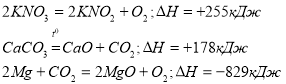 1. а)
1. а)
б)
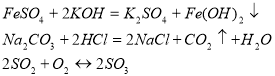 в)
в)
2. а)
б)
в)
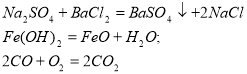 3. а)
3. а)
б)
в)
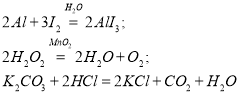
4. а)
б)
в)
ІІІ. Мотивація навчальної діяльності учнів(слайд 2- репродукція пам’ятника засновникам Києва на майдані Незалежності)
У 2002 році на Майдані Незалежності було встановлено ще один пам'ятник засновникам Києва.Виготовлений він був із залізобетону і мав залізний каркас.23 лютого 2010 року частина пам'ятника відломилась: впали фігури братів Щека та Хорива.А вже 28 травня 2010 року було відкрито відреставрований пам'ятник. Як ви думаєте, у результаті яких процесів частково зруйнувався пам'ятник? ( у результаті корозії металу)
В основі корозії металів лежать окисно-відновні реакції. Сьогоднішній урок буде присвячено саме окисно-відновним реакціям. Давайте разом сформулюємо завдання та цілі уроку.
Після відповідей учнів учитель доповнює: ви поглибите знання про даний тип реакцій, дізнаєтесь про відмінності між окисником та відновником, процесами окиснення та відновлення, навчитеся урівнювати рівняння реакцій за допомогою методу електронного балансу, попрацюєте в групі, створивши міні-проект та перевірите знання , виконавши тестові або індивідуальні.
Запишіть в робочих зошитах дату та тему уроку (слайд 3 ). Скажіть, яких результатів ви очікуєте від сьогоднішнього уроку? Можливі відповіді:
- Закріплю вміння визначати ступені окиснення елементів;
- Зрозумію різницю між окисником та відновником, процесами окиснення та відновлення;
- Спостерігатиму і пояснюватиму проведені реакції, адже на демонстраційному столі знаходяться реактиви;
- Покажу високий рівень знань;
- Отримаю консультацію з незрозумілих для мене питань від однокласників;
- Дізнаюся, про хімізм реакцій руйнування пам’ятника засновникам Києва на Майдані Незалежності.
IV. Вивчення нового матеріалу.
- Поняття про окисник та відновник
Пропоную провести наступні досліди:
- Взаємодія розчину купрум (ІІ) сульфату із лугом;
- Взаємодія цієї ж солі із залізом;
- Взаємодія цинку із хлоридною кислотою.
Перед початком роботи нам необхідно нагадати правила БЖД при проведенні дослідів. ( Потім три учні по черзі виконують досліди без запису рівнянь реакцій, але з коментуванням: якими є вихідні речовини: прості чи складні і яких класів ). Ви уважно спостерігали за реакціями і зараз за результатами проведених дослідів створите міні – проекти у групах.
Робота в групах. Групи сформовані на початку вивчення розділу «Типи хімічних реакцій». Прийом «Група-проект». Кожна група повинна опрацювати частину навчального матеріалу за підручником, скласти рівняння реакції і визначити ступінь окиснення елементів, вказати окисник та відновник та зробити висновок – це буде результатом роботи групи (міні-проект). Через 5-7 хвилин кожна група презентує свій проект іншим групам (на дошці) і робить висновок.
І етап. Визначаємо об’єкт і предмет дослідження. Об’єкт дослідження – хімічна реакція (що означає термін), предмет дослідження – зміна ступеня окиснення елементів(що означає термін).
ІІ етап. Нагадаємо правила роботи в групі під час виконання проекту (таблиця 1)
Правила роботи в групі
- Бути активним.
- Бути уважним.
- Уміти слухати.
- Поважати думку іншого.
- Бути толерантним.
- Дотримуватися відведеного часу.
ІІІ етап. Отримання карток із завданнями:
Перша група
- Опрацюйте матеріал підручника на с.86 за питанням «Реакції, що відбуваються без зміни ступеня окиснення та реакції, що відбуваються із зміною ступеня окиснення».
- На основі проведеного досліду між розчинами купрум (ІІ) сульфату та лугу складіть відповідне рівняння і визначте ступені окиснення кожного елемента.
- Зробіть висновок про належність даної реакції до окисно-відновних.
Друга група
- Опрацюйте матеріал підручника на с.86 за питанням «Реакції, що відбуваються без зміни ступеня окиснення та реакції, що відбуваються із зміною ступеня окиснення».
- На основі проведеного досліду між цинком і розчином хлоридної кислоти складіть відповідне рівняння і визначте ступені окиснення кожного елемента. Визначте окисник та відновник.
- Зробіть висновок про відмінність між окисником та відновником у вигляді таблиці.
Третя група
- Опрацюйте матеріал підручника на с.86 за питанням «Реакції, що відбуваються без зміни ступеня окиснення та реакції, що відбуваються із зміною ступеня окиснення».
- На основі проведеного досліду між залізом і розчином купрум (ІІ) сульфату складіть відповідне рівняння і визначте ступені окиснення кожного елемента. Визначте окисник та відновник.
- Зробіть висновок: чи завжди реакції заміщення є окисно-відновними?
Після захистів міні-проектів учні роблять загальний висновок про особливості окисника та відновника, наголошують, що реакції заміщення завжди є окисно-відновними.
У разі необхідності вчитель може додатково пояснити на прикладі реакціїміж залізом і розчином купрум (ІІ) сульфату поняття «окисник» та «відновник» (Рефлексія ІІ)
Fе0 -2 е-— Fе+2.Як бачимо ступінь окиснення Fе підвищився, тобто атом Fевіддав 2 е–. Отже, Fе- відновник.
Cu+2 +2 е-→Cu0.Ступінь окиснення Cu знизився, тобто Cuприйняв
2 е–. Отже, Cu – окисник.
Окисниками зазвичай є атоми або йони в таких ступенях окиснення, в яких вони здатні приєднувати електрони, тобто у високих (слайд 4).Відновниками є атоми або йони у таких ступенях окиснення, в яких вони здатні віддавати електрони, тобто в нижчих ступенях окиснення
Cl20 +1 е-·2→ 2Cl-
O20 +2 е-·2→ 2O-2
Mn+7+5 е- → Mn+2
Mn+4+2 е-·→Mn+2
Cr+6+3 е- →Cr+3
H20-1 е-·2→ 2H+
S-2-2 е- → S0
Al0-3 е- →Al+3
Fe+2-1 е- →Fe+3
2Cl--1е-·2→Cl20
- Поняття про процеси окиснення та відновлення.
Процес віддавання атомом хімічного елемента електронів – процес окиснення. Тобто Fеє відновником, а в процесі реакції окиснився.Відновники, віддаючи електрони, окиснюються.
Процес приєднання атомом хімічного елемента електронів – процес відновлення. Тобто Cuє окисником, а в результаті реакції відновився. Окисники, приєднуючи електрони, відновлюються.
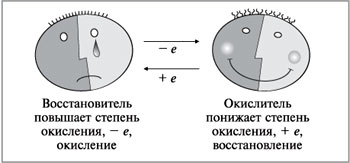
Окисно-відновні реакції – єдність двох протилежних процесів – окиснення та відновлення.( таблиця2 «Єдність процесів окиснення та відновлення»)
- Метод електронного балансу.
Існують рівняння реакцій, які досить складно урівняти, знаючи ступені окиснення, використовуючи метод електронного балансу це зробити значно легше. Розглянемо «Алгоритм добору коефіцієнтів методом електронного балансу»( слайд 5).
Алгоритм добору коефіцієнтів методом електронного балансу
- Записати схему рівняння реакції Mg + O2→MgO
- Визначити ступені окиснення атомів елементів у вихідних речовинах і продуктах реакціїMg0 + O20 →Mg+2O-2
- Визначити, які елементи змінили ступені окиснення
Mg0→Mg+2
O20→ O-2
- За необхідності урівняти кількість атомів O20→ 2O-2. Пам’ятайте! Лише у випадку простої речовини, яка має ступінь окиснення 0, ми вказуємо кількість атомів: H20,I20,N20 , але не Cl2-, а Cl-
- Скласти рівняння переходу електронів
Mg0- 2е-→Mg+2
O20+2 е-·2→ 2O-2
- Визначити кількість приєднаних та відданих електронів, знайти спільне кратне, дібрати коефіцієнти
Mg0- 2е-→Mg+2 2 2
4
O20+2 е-·2→ 2O-2 4 1
- Дописати рівняння реакції, розставивши коефіцієнти
2Mg + O2=2MgO
- Вказати окисник та відновник, процеси окиснення та відновлення
від-кMg0 - 2е-→ Mg+2 2 2 процес ок-ня
4
ок-кO20 +2 е-·2→ 2O-2 4 1 процес від-ня
- Всі інші коефіцієнти отримуємо простим підбором.
Розглянемо приклади ( виконують учні біля дошки з допомогою вчителя)
1. Урівняти реакцію методом електронного балансу H2 + Cl2→ HCl
H20 + Cl20→ H+Cl–
від-к H20 - 1е-·2→ 2H+ 2 1 процес ок-ня
2
ок-кCl20 +1 е-·2→ 2Cl– 2 1процес від-ня
H2 + Cl2= 2HCl
2. Урівняти реакцію методом електронного балансу
H2S + KMnO4+ H2SO4→S+ MnSO4+ K2SO4+ H2O
H2S-2 + KMn+7O4 + H2SO4→S0 + Mn+2SO4 + K2SO4 + H2O
від-кS-2- 2е- →S0 2 5 процес ок-ня
10
ок-кMn+7 +5е-→Mn+2 5 2процес від-ня
5H2S +2KMnO4+ 3H2SO4 = 5S+2MnSO4+ K2SO4+ 8H2O
3. Які ж хімічні зміни сталися із пам’ятником засновникам Києва на Майдані Незалежності? Ми зараз з вами складемо лише схеми реакцій, а вдома ви закінчите ці рівняння, зрівнявши методом електронного балансу. Корозія заліза стала причиною руйнування пам’ятника Щеку, Хориву та їхній сестрі Либідь. Залізо, перебуваючи за звичайних умов на повітрі, повільно реагує водночас із киснем і водою (водяною парою). Таке перетворення можна описати схемами:
Fе0 + О20+ Н2О→Fе+2(О-2 Н )2
Fе+2(ОН)2 + О20 + Н2О →Fе+3(О-2Н)3
Окисно-відновний баланс до цих реакцій ви складете вдома.
V. Перевірка засвоєння вивченого матеріалу.
Тест
І варіант
- Схема S0→S-2 відображає процес:
а) окиснення; б) відновлення.
- Відповідно до схеми Al0→Al+3 алюміній:
а) віддав 3 електрони; б) приєднав 3 електрони.
- В реакції H2 + I2→ 2HI водень виступає:
а) окисником; б) відновником.
- Завжди окисно-відновними реакціями є реакції:
а) сполучення; б) розкладу; в) заміщення; в) обміну.
- Ступінь окиснення простих речовин:
а) позитивний; б) негативний; в) нейтральний.
6. Урівняйте рівняння реакції, використовуючи метод електронного
балансу, вкажіть окисник та відновник, процеси окиснення та
відновлення:K + H2→KH
ІІ варіант
- Схема Fe+2→Fe+3 відображає процес:
а)відновлення; б) окиснення.
- Відповідно до схеми Mn+4→Mn+2манган:
а) віддав 2 електрони; б) приєднав 2 електрони.
- В реакції H2 + S = H2Sсірка виступає:
а) окисником; б) відновником.
- Окисно-відновною є реакція: а) H2SO4 + K2O = K2SO4 + H2O;
б) CaCO3 = CaO + CO2 ; в) 3Mg + N2 = Mg3N2
5. Відповідно до схемиS0→S-2 :
а) приєднано 4 електрони; б) приєднано 2 електрони; в) віддано 2 електрони.
6. Урівняйте рівняння реакції, використовуючи метод електронного
балансу, вкажіть окисник та відновник, процеси окиснення та
відновлення: H2 + O2→H2О
VI. Оцінювання.
Ви сьогодні здобули найцінніший скарб – знання, які вам обов’язково знадобляться у подальшому життя. Ви активно і творчо співпрацювали в групах, відчули важливість підтримки товаришів, були уважними і наполегливими. Відповідно до нашого девізу урок не минув дарма. І, як результат, ви отримали такі бали…..
VII. Домашнє завдання.
Вивчити § 14; письмово: №2,3 (С.91), урівняти реакції методом електронного балансу Fе0 + О20 + Н2О →Fе+2(О-2 Н )2 та
Fе+2(ОН)2 + О20 + Н2О →Fе+3(О-2Н)3
Використана література
- Байкова О.А. «Класифікація хімічних реакцій», журнал «Хімія» , видавництво «Основа», №15-16, 2011р.
- Васильковська Т.О. «Реакції сполучення, розкладу, заміщення, обміну. 9 клас», журнал «Хімія» , видавництво «Основа», №22, 2011р.
- Ковешникова Т.П. «Окисно-відновні реакції та їх значення», », журнал «Хімія» , видавництво «Основа», №5, 2012р.
Алгоритм визначення ступенів окиснення елементів
|
Кроки |
Що необхідно зробити |
Приклад 1 |
Приклад 2 |
Приклад 3 |
|
1 |
Записати над символами хімічних елементів у формулах сполук відомі ступені окиснення, невідомий ступінь окиснення позначити через х |
Feх2O-2 3 |
K+ 2Crх2O-2 7
|
[ СrхO-2 4]-2 |
|
2 |
Скласти рівняння для розрахунку відомого ступеня окиснення: суму добутків ступенів окиснення на число атомів відповідних елементів прирівняти до загального заряду. Пам’ятайте, що молекула електронейтральна, тобто має заряд 0 |
2х + 3(-2) =0 |
1·2 + 2х + 7·2 =0 |
Х+4·(-2) =-2 |
|
3 |
Розв’язати отримане рівняння і знайти Х |
Х=+3 Fe+32O-2 3
|
Х=+6 K+ 2Cr+62O-2 7
|
Х=+6 [ Сr+6O-2 4]-2 |


про публікацію авторської розробки
Додати розробку
