Урок: "Періодична система хімічних елементів"
- Урок4.ppt ppt
- Урок№4.doc doc
Урок №5
Тема. Періодична система хімічних елементів
Мета: сформувати знання про структуру періодичної системи, малі та великі періоди, групи елементів та поділ їх на підгрупи: головні та побічні. Звернути увагу на зміну властивостей металів і неметалів у головних підгрупах і на винятки, що зустрічаються в елементів побічних підгруп.
хід уроку
- Організація класу
-
Актуалізація опорних знань
- Ким і коли був відкритий періодичний закон?
- Сформулюйте періодичний закон.
- Яку характеристику обрав Д.І.Менделєєв за основу їх класифікації?
- Який зміст вкладається в поняття «періодичність»?
- Які властивості елементів та їх сполук змінюються періодично?
- Для чого Д.І.Менделєєв використав порядковий номер?
- Що таке період?
- Як змінюються властивості елементів у періоді?
- Що таке група?
- Чи можна спрогнозувати властивості хімічного елемента, якщо відомо його положення в періоді?
- Мотивація навчальної діяльності
Сьогоднішнє заняття сприятиме розширенню знань про періоди і групи та дасть початок використанню періодичної системи хімічних елементів як джерела інформації про хімічні елементи та їх сполуки.
- Вивчення нового матеріалу
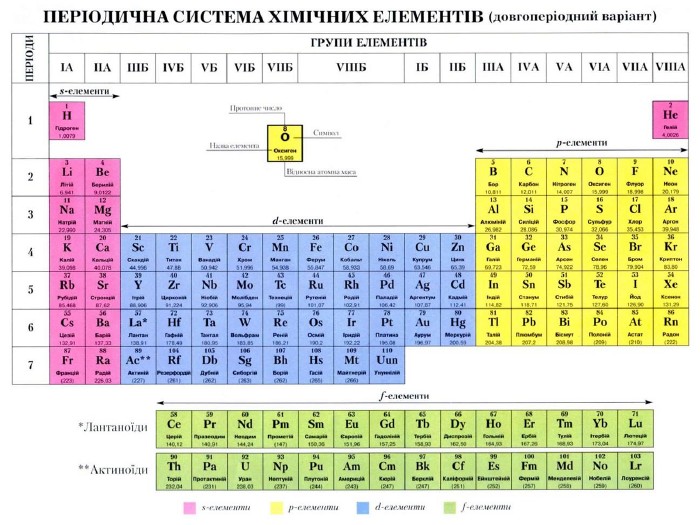
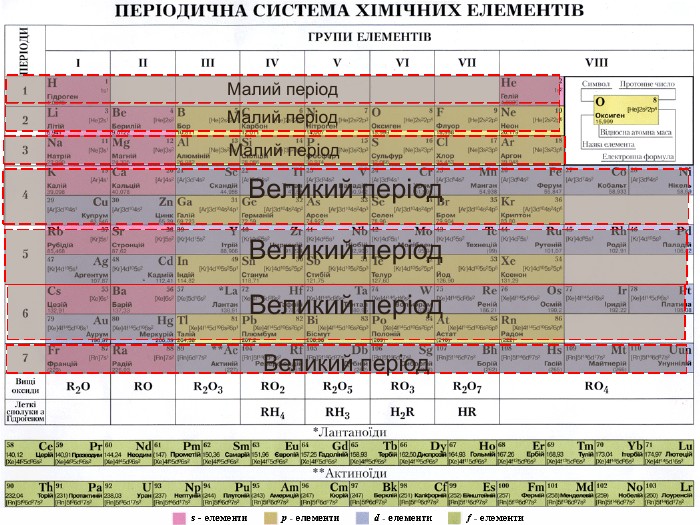
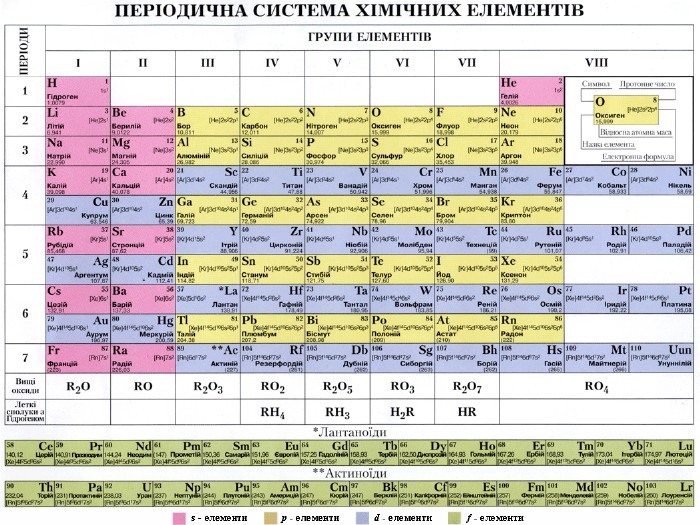
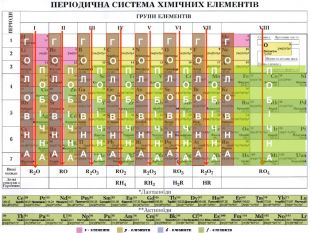
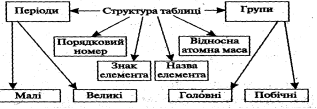
Базуючись на періодичному законі, Д.І.Менделєєв побудував класифікацію хімічних елементів, що називають періодичною системою. Зазвичай її представляють у вигляді таблиці. Якщо записати символи елементів кожного періоду в окремий рядок так, щоб природні сімейства(лужні елементи, галогени, інертні елементи) утворювали вертикальні стовпчики, то одержимо довгий варіант періодичної таблиці. Д.І.Менделєєв частіше використовував більш компактну коротку форму періодичної таблиці. У ній великі періоди розбиті на два ряди, а групи на підгрупи: головну і побічну. Кожний хімічний елемент займає в таблиці певне місце і має свій порядковий номер.
При цьому звертається увага на положення періодів та груп у системі, на кількість елементів у періодах, існування малих і великих періодів, парних і непарних рядів, на зміну властивостей елементів у малих і великих періодах. Після засвоєння знань про періоди формуємо знання про групи та підгрупи, про зміну властивостей їх елементів.
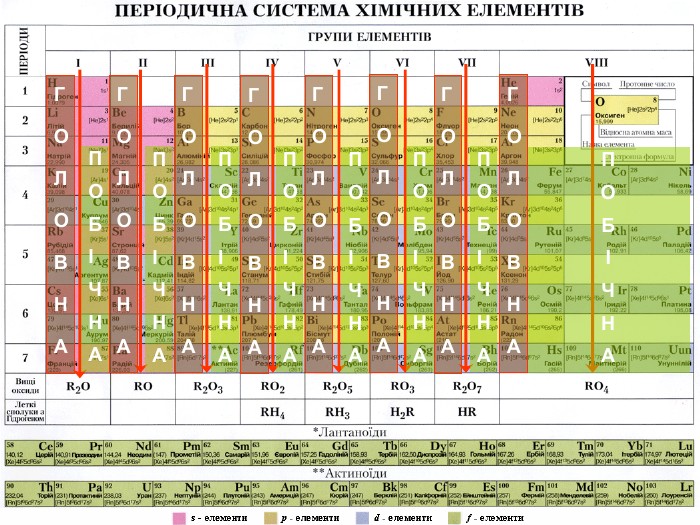
Зазначаємо появу діагональної подібності елементів із зміною властивостей у періодах і групах.
В кінці пояснюємо зміну валентності за Оксигеном та Гідрогеном в оксидах та летких сполуках неметалів із Гідрогеном у періодах та групах.
Для зацікавлення учнів вивченням подальшого матеріалу, зазначити, що ні Д.І.Менделєєв не міг пояснити, ні вони на даний час не можуть зрозуміти і пояснити, в чому ж причина у змінах властивостей, що спостерігаються. Але найближчим часом, зможуть це зробити самостійно, та ще й зрозуміти, чому не під силу було зробити це Д.І.Менделєєву.
- Осмислення вивченого
- Заповнення опорної схеми
- Розв’язування вправ за підручником №196, №198, №199
- Завдання з вибором однієї правильної відповіді
(гра «Нехай посміхаються люди»)
3) Завдання відкритої форми з диференційованим підходом
А)Відносна молекулярна маса леткої сполуки Гідрогену з елементом шостої групи дорівнює 34. Назвіть цей елемент.
Б)Визначте хімічний елемент за такими даними: належить до ІV групи періодичної системи елементів. Відносна густина за воднем вищого оксиду елемента дорівнює 22.
ІХ. Домашнє завдання
Опрацювати параграф 22, вправи 193 – 195 (усно), 197 (письмово)
Вибірково на роздаткових картках:
Елемент, що належить до V групи періодичної системи елементів утворює з Гідрогеном летку сполуку, в якій масова частка Гідрогену складає 3,85%. Визначте цей елемент.


про публікацію авторської розробки
Додати розробку