Урок "Поняття про pH розчину"
СПЕЦІАЛЬНА ШКОЛА № 9
МІСТА КИЄВА
( за навчальними програмами для спеціальних загальноосвітніх навчальних закладів для дітей зі зниженим слухом)
Урок хімії в 10 класі
Тема. Поняття про рН розчину.
Мета:
Формування ключових компетентностей :
- саморозвитку й самоосвіти — створення проблемних ситуацій
- інформаційної – вміння робити скорочені записи, висновки й
узагальнення;
- комунікативної — вміння працювати в групі;
- дослідницька.
Формування предметних компетентностей:
- формувати поняття про рН розчину, визначати рН розчину за допомогою індикаторів;
- виховувати інтерес до хімії.
Обладнання: штатив з пробірками, індикатори, розчин оцту, розчин натрій гідрокарбонату, натрій хлориду, харчові продукти : лимонний сік, вода «Поляна квасова», солодка газована вода, господарське мило, шампунь, зубна паста.
Форми роботи: бесіда, лекція, гра «Знайди відповідність», робота в парах, робота з ПС, демонстрація, дослід.
Хід уроку
І. Організація класу.
ІІ. Оголошення теми та мети уроку.
ІІІ. Актуалізація опорних знань
Вивчається тема «Розчини, теорія електролітичної дисоціації, йонні рівняння».
- Учням пропонується гра «Знайди відповідність»
Установіть відповідність між реагентами та скороченими іонними рівняннями реакцій:
- Na2S + 2HCl а) H+ + OH¯ = H2O
- BaCl2 + Na2SO4 б) Cu2+ + 2OH¯ = Cu(OH)2
-
CuSO4 + 2NaOH в) CO
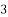 ²- + 2H+ = CO2 + H2O
²- + 2H+ = CO2 + H2O
- HCL + NaOH г) S2- + 2H+ = H2S
- K2CO3 + H2SO4 д) Ba2+ + SO42- = BaSO4
- Кожному учню пропонується завдання:
Складіть повні та скорочені іонні рівняння , які відповідають таким молекулярним :
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
BaCl2 + Na2SO4 = BaSO4 + 2NaCl
AgNO3 + NaCl = AgCl + NaNO3
Після виконання завдання , учням пропонується перевірити правильність виконання, поставити собі оцінки:
|
Кількість виправлень |
Оцінка |
|
1 |
9 |
|
2-3 |
8 |
|
4-5 |
7 |
|
6-7 |
6 |
|
8-9 |
5 |
ІV.Мотивація навчальної діяльності.
На парті І групи стоїть пробірка з розчином хлоридної кислоти
На парті ІІ групи стоїть пробірка з розчином натрій гідроксиду
У вчителя на столі стоїть пробірка з водою. Кожна група учнів виявляє як змінюється забарвлення індикатора у виданих розчинах.
І група – індикатор змінив забарвлення на червоне
ІІ група – індикатор змінив забарвлення на синє
У вчителя – забарвлення індикатора не змінилося
Робим висновок : зміна забарвлення залежить від того, які йони утворюються під час дисоціації електролітів.
V. Вивчення нового матеріалу.
5.1. Кислотність середовища. (слайд 1)
Кислотність розчинів характеризує вміст кислот, або лугів у розчині, тому можна сказати, що визначитися з характеристикою кислотності середовища можна за допомогою умісту іонів Н+, та ОН¯.
НCl = H+ + Cl¯ середовище кисле, лакмус червоний
NaOH = Na+ + OH¯ середовище лужне, лакмус синій
Н2О = Н+ + ОН¯ середовище нейтральне, лакмус забарвлення не
змінив
У чистій воді концентрація іонів Н+ і ОН¯ однакова ( вода слабкий електроліт), тому середовище нейтральне.
- Кількісна характеристика середовища. (слайд 2)
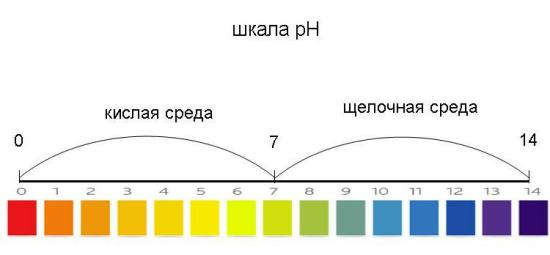
Кількісно кислотність середовища характеризується водневим показником рН, що пов'язаний з вмістом катіонів Гідрогену в 1 л розчину.
В нейтральному розчині рН = 7
В кислому розчині рН < 7
В лужному розчині рН > 7
Поняття рН було введено в 1909 році датським хіміком Серенсеном.
- Лабораторний дослід 1. (слайд 3)
Випробуйте індикаторами : грунт для квітів, розчин питної соди, розчин оцету, розчин мила.
Дані дослідів занесіть у таблицю
|
Рідина, що досліджується |
Показник рН |
Середовище |
|
Грунт для квітів |
рН = |
|
|
Розчин питної соди |
рН = |
|
|
Розчин оцету |
рН= |
|
|
Розчин мила |
рН= |
|
- Застосування водневого показника (слайд 4)
Давно помічено, що соки деяких рослин змінюють забарвлення при дії певних речовин. Якщо немає хімічних індикаторів , то для визначення середовища розчинів можна використати саморобні індикатори із рослинних матеріалів. Ними можуть бути квіти пеларгонії, пелюстки мальви, півону, ірису, плоди чорниці, черемхи, винограду. Звичайний чай – також індикатор. Якщо в чашку з міцним чаєм додати краплини лимонного соку, він зразу посвітліє. Якщо розчинити в чаєві харчову соду, розчин стане темнішим ( пити такий чай не рекомендують). Рослинні індикатори можна використовувати в побуті. Сік буряку в кислому середовищі змінює свій рубіновий колір на яскраво червоний, а в лужному - на жовтий. Знаючи цю якість можна зробити борщ яскравішим. Для цього до страви додають трохи оцту або лимонного соку.
Слайд 5
Для здорового життя людини дуже неприємний стан, коли рН не норма. Живі істоти теж реагують на показники рН. Вся риба гине при рН = 4,2, яйця жаби гинуть при рН = 5.
Для використання косметичних засобів теж необхідно мати уявлення про рН. Наприклад - рН шкіри людини 5,5, тому важливо використовувати різні косметичні засоби з близьким до природного рН щкіри. Проте кожний з нас настільки індивідуальний , що говорити про те , що рН шкіри у всіх повинен бути 5,5 - не можна . Навіть різні частинки тіла мають різні значення рН: шкіра голови : 4,5 – 5,5; шкіра обличчя: 4,3 – 5,9; долоні: 5,0 – 5,3; ступні : 6,5.
VІ. Підбиття підсумків уроку. Оголошення оцінок.
VІІ. Домашнє завдання .
Підручник §13 читати, визначити середовище деяких розчинів, заповнити таблицю. За бажанням додайте фото.
|
Рідина, що досліджується |
Показник рН |
Середовище |
|
Грунт для квітів |
рН = |
|
|
Розчин молока |
рН = |
|
|
Розчин лимонного соку |
рН= |
|
|
Мінеральна вода |
рН= |
|
|
Розчин нашатирного спирту |
рН = |
|
Учитель вищої категорії
Полянська Тетяна Михайлівна


про публікацію авторської розробки
Додати розробку
