Урок: "Поняття про природні родини хімічних елементів"
Урок №2
Тема. Поняття про природні родини хімічних елементів
Мета: сформувати уявлення про природні родини елементів на прикладі лужних металів, галогенів, благородних газів, на основі вивчення властивостей вищевказаних природних родин підготувати до сприйняття періодичного закону Д.І.Менделєєва; удосконалити навички порівнювати — знаходити спільне і відмінне.
хід уроку
- Організація класу
- Актуалізація опорних знань
На минулому уроці створеним нами детективним агентством була проведена грандіозна робота. Чи не була їх праця даремною? Давайте спробуємо пригадати основні моменти минулого уроку, а для цього пограємо в «Хімічну лотерею». Звичайно лотерея передбачає тільки удачу, а в нашій доведеться потрудитись, за номерком який ви виберете захований портрет необхідно впізнати вченого і пригадати його вклад у класифікацію хімічних елементів. але можна отримати й сюрприз (1 чи 2 бали до загальної оцінки за урок)
- Мотивація навчальної діяльності
Світ природи дуже різноманітний. Чи можемо ми визначити, скільки видів рослин і тварин на нашій Землі? їх дуже багато. Кожну рослину, кожну тварину вивчити неможливо. Для цього не вистачить цілого життя. Але все ж таки ми вивчаємо. Як? (Діти відповідають.) Аналізуючи ваші відповіді, я роблю висновок, що всі рослини і тварини класифікують, систематизують, об'єднують у класи, родини та інші групи на основі різних ознак. Достатньо вивчити детально один вид (наприклад, голубів) і вже можна говорити про клас птахів у цілому. Так само і в хімії. Скільки хімічних елементів відомо? Так, 110. Ми не будемо вивчати кожний хімічний елемент, а спробуємо виявити спільне між ними, об'єднати, систематизувати, знайти взаємозв'язки.
Запишемо тему уроку.
- Вивчення нового матеріалу
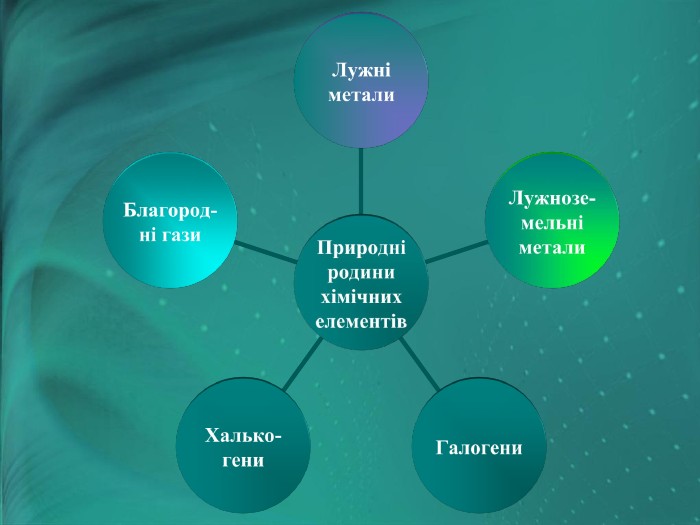
Серед металів і неметалів траплялися дуже схожі речовини. Учені об’єднали їх в окремі групи і дали їм назви. Більш детально ми з вами ознайомимось з групами: лужні метали, галогени, інертні (благородні ) гази.
Як ви думаєте чому ці елементи об’єднали в природні родини. (проводиться аналогія з родиною в класифікації тварин, людською родиною роблячи акцент на схожість)
Назвіть хімічні елементи, що відносяться до родини лужні метали, символи їх знаходяться на слайді. Зверніть увагу в якій групі періодичної системи вони розташовані?
Лужні метали — це хімічні елементи з різко-вираженими металевими властивостями.
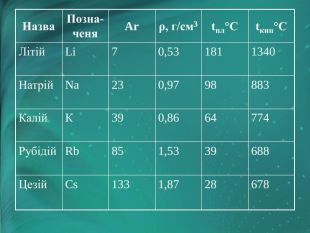
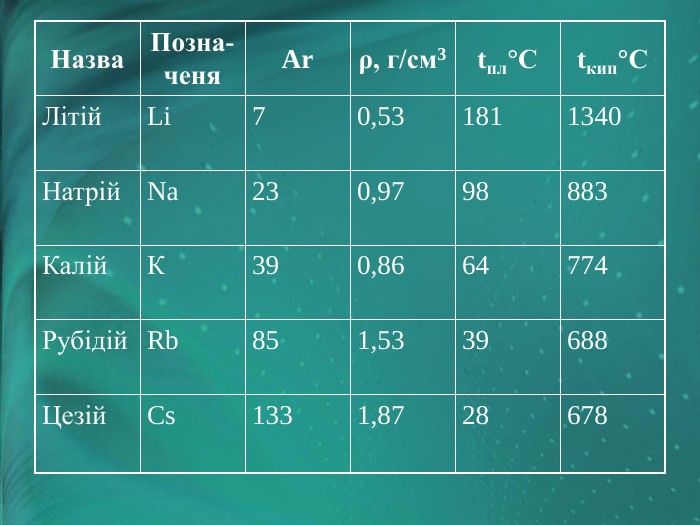
Фізичні властивості лужних металів
|
Назва |
Позначеня |
Ar |
ρ, г/см3 |
tпл°С |
tкип°С |
|
Літій |
Li |
7 |
0,53 |
181 |
1340 |
|
Натрій |
Na |
23 |
0,97 |
98 |
883 |
|
Калій |
К |
39 |
0,86 |
64 |
774 |
|
Рубідій |
Rb |
85 |
1,53 |
39 |
688 |
|
Цезій |
Cs |
133 |
1,87 |
28 |
678 |
Англійський хімік Г. Деві підчас електролізу лугу КОН відкрив новий елемент, який він назвав потассіум, оскільки англійці називали КОН їдким поташем. Деві кинув калій у воду й очікував, що метал має негайно опуститися на дно. Але калій повівся інакше. З гучним шипінням цей метал забігав по поверхні води. Потім пролунав оглушливий вибух, і над потассіумом спалахнуло лілове полум'я. Так він і носився по воді, поки, не перетворився на їдкий луг.
Давайте переглянемо відеофрагменти і запишемо відповідні рівняння реакцій
Про цезій і рубідій, відкриті іншими вченими, писали, що це легкі сріблясті метали, які так само, як літій і калій, загорялися на повітрі, бігали по воді з полум'ям і тріском, навіть більш несамовито, ніж калій і натрій. Усі лужні метали зберігають під шаром гасу. Солі Рубідію і Цезію не відрізняються від звичайної кухонної солі. Їдкий цезієвий луг та їдкий рубідієвий луг були слизькими на дотик і мильними, подібно до їдкого натру та їдкого калі.
Наступна природна родина – галогени, це — типові неметали, у періодичній системі розташовані в VII групі головної підгрупи. їх назва походить від слів галас — «сіль» і ген — «той, що народжує». Це речовини молекулярної будови, їх молекули двохатомні
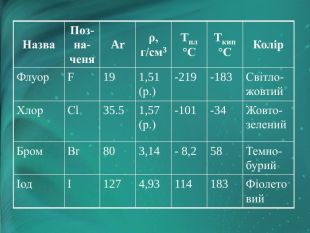
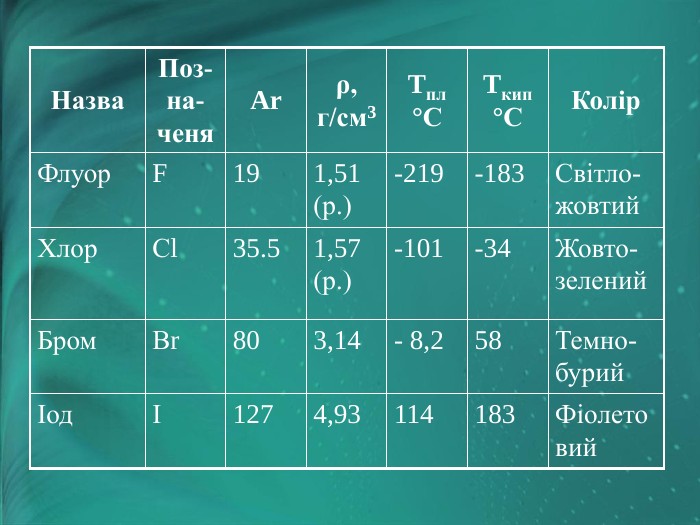
Фізичні властивості галогенів
|
Назва |
Позначеня |
Ar |
ρ, г/см3 |
tпл°С |
tкип°С |
Колір |
|
Флуор |
F |
19 |
1,51 (ж.) |
-219 |
-183 |
Світло-жовтий |
|
Хлор |
Сl |
35.5 |
1,57 (ж.) |
-101 |
-34 |
Жовто-зелений |
|
Бром |
Вr |
80 |
3,14 |
-8,2 |
58 |
Темно-бурий |
|
Іод |
І |
127 |
4,93 |
114 |
183 |
Фіолетовий |
Флуор — газ ясно-зеленого кольору, дуже отруйний. Багато вчених, які працюють із ним, постраждали від цього. Найбільш активний неметал (у флуорі навіть вода горить).
Хлор — важкий газ зеленого кольору з різким запахом, отруйний.
Бром — важка темно-коричнева рідина, дуже активний неметал, але менш активний, ніж хлор.
Іод — темно-фіолетові кристали, активний неметал, найменш активний у ряді галогенів.
Такі зміни в активності добре видно при взаємодії з металами, перегляньте відеофрагменти та запишіть рівняння відповідних реакцій
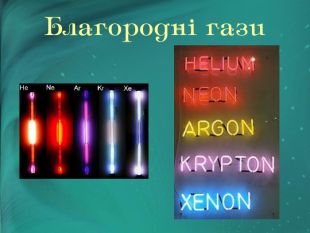
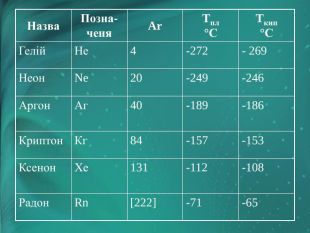
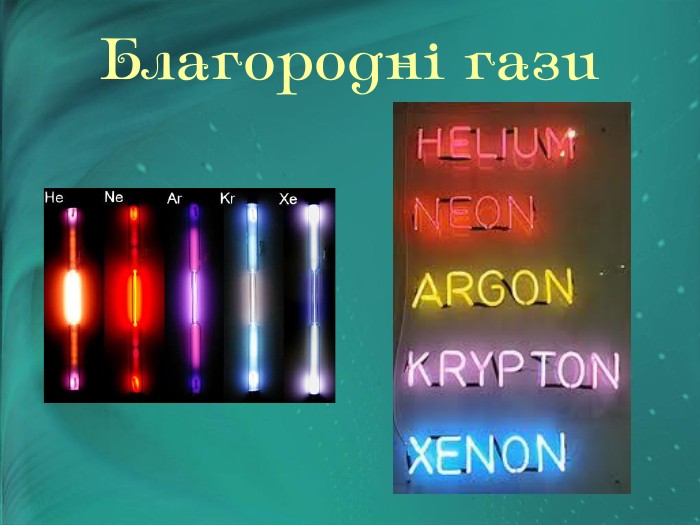
Інертні елементи — це елементи головної підгрупи VIII групи періодичної системи. Назвіть їх. У 1868 році француз Жансе й англієць Лок'єр під час вивчення сонячних протуберанців відкрили спектр нового хімічного елемента, що не належав жодному з відомих на земній кулі. «Небесний» елемент назвали Гелієм. Через 25 років Релей виявив у звичайному повітрі домішок, який , не вступав у хімічні реакції. Цей елемент назвали Аргон («ледачий»).
Незабаром Гелій був виявлений у мінералах, що містять Уран і Торій. Гелій виявився найлегшим після водню газом.
У 1897 році англієць Рамзай передбачив існування ще однієї газоподібної речовини, що мала перебувати між Гелієм і Аргоном. Це виявився відкритий у 1898 році Неон. А потім у короткий строк Рамзай та його співробітник Траверс виявили в земній атмосфері ще два елементи — Криптон («таємний») і Ксенон («прихований»).
Фізичні властивості благородних газів
|
Назва |
Позначеня |
Ar |
tпл°С |
tкип°С |
|
Гелій |
Не |
4 |
-272 |
-269 |
|
Неон |
Ne |
20 |
-249 |
-246 |
|
Аргон |
Аг |
40 |
-189 |
-186 |
|
Криптон |
Кг |
84 |
-157 |
-153 |
|
Ксенон |
Хе |
131 |
-112 |
-108 |
|
Радон |
Rn |
[222] |
-71 |
-65 |
Тривалий час не вдавалося одержати сполуки цих елементів. їх назвали інертними газами. З кожним роком розширюється сфера застосування інертних газів. Легкість і негорючість гелію використовують для заповнення ним повітряних куль і дирижаблів. В інертному середовищі аргону здійснюють електрозварювання металів, що легко окиснюються. Неоном, аргоном, криптоном і ксеноном заповнюють електричні лампочки. Суміш гелію з киснем застосовують для дихання під час підводних робіт. Якщо крізь розріджені інертні гази пропускати електричний струм, то вони випромінюють світло різного забарвлення. Наприклад, аргон дає синє світіння, неон — червоне, тому їх використовують для світлових реклам і в маяках
- Осмислення вивченого.
З вами зараз ми зіграєм
У цікаву досить гру.
Що сьогодні ми вивчали,
Зараз я вам всім назову.
Ви сидіть тихенько,
Слухайте уважненько.
Якщо з відповіддю згодні,
Плескайте в долоні.
Ну, якщо ж тут щось не так,
Ви подайте інший знак
- До групи лужних металів належать такі елементи: Літій, Рубідій, Цезій, Натрій, Кальцій. (Ні.)
- Натрій і калій мають металічний блиск. (Так.)
- Натрій і калій енергійно реагують з водою за звичайних умов. (Так.)
- У сполуках Натрій і Калій завжди двовалентні. (Ні.)
- Натрій гідроксид і калій гідроксид нерозчинні у воді. (Ні.)
- Метали натрій і калій м'які, легко ріжуться ножем. (Так.)
- Натрій і калій тугоплавкі. (Ні.)
- Лужні метали погано проводять електричний струм і теплоту. (Ні.)
- Усі лужні метали мають однакову густину, а також однакові значення температур плавлення та кипіння. (Ні.)
- Розчини гідроксидів натрію і калію змінюють забарвлення індикаторів. (Так.)
- Флор та хлор – це малоактивні неметали (ні)
- В перекладі з грецької галогени означає ті що народжують сіль (так)
- Бром за звичайних умов – рідина (так)
- Йод за звичайних умов – газ (ні)
- У галогенів із підвищенням відносної атомної маси підвищуються температури кипіння (Так)
- Хлор використовують для заповнення дирижаблів (ні)
- Молекули галогенів двохатомні (так)
- Гелій – найлегший після водню газ(так)
- Неон використовують для світлових реклам(так)
- Ксенон активно взаємодіє з галогенами(ні)
- Суміш гелію з киснем застосовують для дихання під час підводних робіт(так).
- Домашнє завдання
Вивчити §20 (повністю),


про публікацію авторської розробки
Додати розробку










![-65 -71 [222] Rn Радон -108 -112 131 Хе Ксенон -153 -186 -246 - 269 Tкип °С -157 84 Кг Криптон -189 40 Аг Аргон -249 20 Ne Неон -272 4 Не Гелій Tпл °С Ar Позна-ченя Назва -65 -71 [222] Rn Радон -108 -112 131 Хе Ксенон -153 -186 -246 - 269 Tкип °С -157 84 Кг Криптон -189 40 Аг Аргон -249 20 Ne Неон -272 4 Не Гелій Tпл °С Ar Позна-ченя Назва](/uploads/files/210043/305450/332251_images/14.jpg)