Урок: "Періодичний закон Д. І. Менделєєва"
- Урок3.ppt ppt
- Урок№3.doc doc
Урок №3
Тема. Періодичний закон Д. І. Менделєєва
Мета: ознайомити учнів з відкриттям періодичного закону; встановити взаємозв'язки між елементами; підтвердити закон переходу кількісних змін у якісні; розвивати логічне мислення; навчити прогнозувати явища.
ПІДГОТОВКА ДО УРОКУ
Окремим учням роздаються вірші та проводиться підготовка до читання в ролях.
хід уроку
- Організація класу
- Актуалізація опорних знань
- На які групи вчені поділили відомі елементи?
- За якими ознаками?
- Чи можна провести різку межу між металами і неметалами?
- Які факти про це свідчать?
(Оксиди і гідроксиди металів амфотерні. За фізичними властивостями деяких неметалів виявлені суперечності: елемент Карбон існує у вигляді алотропних видозмін — алмазу і графіту. Алмаз блищить, а графіт електропровідний. Це ознаки металів, хоча Карбон — неметал. Кристали йоду мають металічний блиск.
- Які групи подібних елементів вам відомі?
- Мотивація навчальної діяльності
Сьогодні ми з'ясуємо, як видатний російський учений Д.І.Менделєєв встановив зв'язки між цими групами, знайшов загальний природний зв'язок, який об'єднав усі елементи в систему..
Мир сложен.
Он полон событий, сомнений,
И тайн бесконечных, и смелых загадок,
Как чудо Природы
Является гений
И в хаосе этом находит порядок.
Весь мир большой:
Жара и стужа,
Планет круженье, свет зари-
Все то, что видим мы снаружи,
Законом связано внутри.
Найдется ль правило простое,
Что целый мир объединит?
Таблицу Менделеев строит.
Природы ищет алфавит.
- Вивчення нового матеріалу
Відкриттю періодичного закону передував довгий і напружений труд Д. І. Менделєєва на протязі 15 років. А подальшому його поглибленню було присвячено ще 25 років.
Свої розуміння про періодичну систему елементів Д. І. Менделєєв дуже довго не міг представити у вигляді ясного узагальнення, суворої та наочної системи. Якось після трьох добової напруженої роботи він ліг відпочити і забувся сном. Потім він розповідав: «Ясно бачу у вісні таблицю, де елементи розставлені, як треба. Проснувся, негайно записав на клаптику паперу і заснув знов. Тільки в одному місці згодом стала необхідною поправка». Ця розповідь породила масу наукоподібних тлумачень і міфів. В той же час сам вчений про те, як народилася думка про періодичну систему, розповідав: «…Не п’ятак за строчку! Не так як ви! Я над нею мабуть 25 років думав, а ви думаєте сидів і раптом п’ятак за строчку, п’ятак за строчку, і готово…!».
М.О. Меншуткін про Д.І Менделєєва: «… У справу викладання хімії Дмитро Іванович вніс великий вклад і складанням навчальних книг з усіх галузях хімії, однаково як і характером свого викладання… Я не зупиняюсь на хімічних дослідженнях невеликого обсягу, всі вони никнуть перед величчю значення відкритого Д.І. Менделєєвим періодичного закону…
Періодичний закон є законом природи, він залишиться назавжди в науці…»
В. Тищенко: «… Д.І. Менделєєв був великою геніальною людиною і, як більшість великих людей, великим трудівником. А працював він, справді, не шкодуючи себе. Працю Менделєєв ставив вище за все. Він не любив, коли його називали генієм. «Який там геній! Працював усе життя, от і став генієм…»
К часу відкриття періодичного закону було відомо 63 хімічних елемента. Спроби попередників Д.І. Менделєєва класифікувати їх за спільними ознаками не увінчались успіхом. Між тим, хімічна наука продовжувала відчувати гостру необхідність в класифікації хімічних елементів. Молодий професор Санкт-Петербурзького університету Д.І. Менделєєв взявся за справу за власним бажанням. Навчаючи студентів і працюючи над створенням підручника «Основи хімії», розумів наскільки важливо чітко класифікувати елементи.
Учень.
Случилось в Петербурге это
Профессор университета
Писал учебник для студентов…
Задумался невольно он:
«Как рассказать про элементы?
Нельзя ли тут найти закон»
Искали многие решение,
Но проходя лишь полпути,
Бросали. Мучило сомненье:
«А можно ли закон найти?»
Мир состоит из элементов
(В то время знали шестьдесят)
А сколько их всего?
На это нельзя ответить наугад.
Но не гадал, а верил он:
«Тут должен, должен быть закон!»
Упрямо он искал решенье.
Был труд, надежда и терпенье
И Вера в то, что он найдет!
Он так работал целый год.
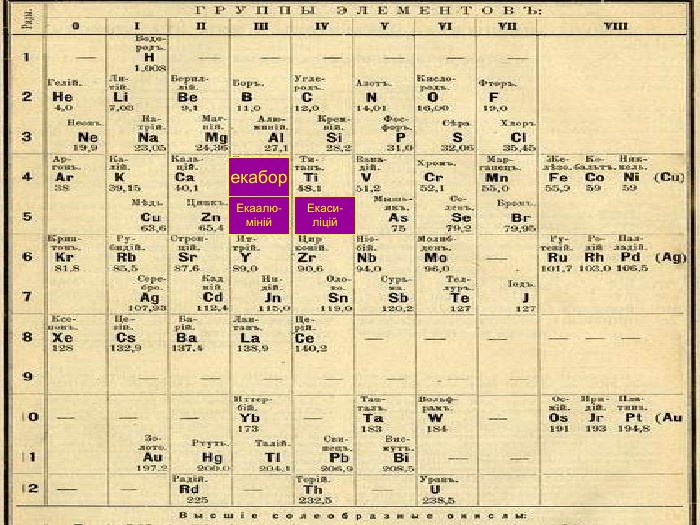
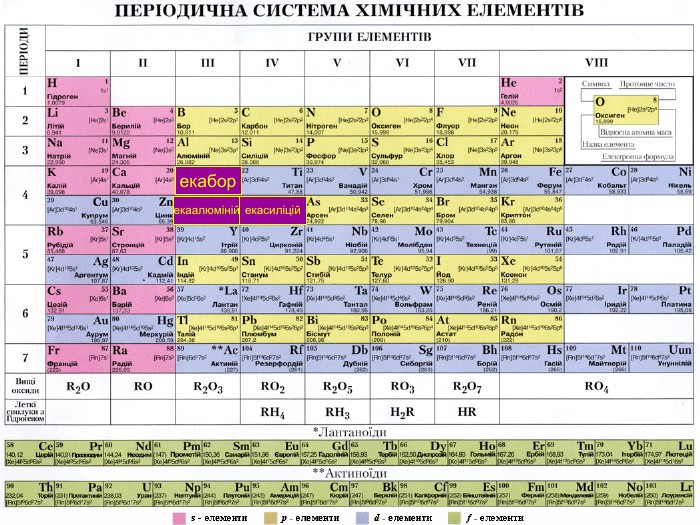
Перед вченим постало питання вибору ознаки, який слід було покласти в основу класифікації. Звичайно, ця ознака мала проявитися у всіх без винятку елементах. На той час ознак було відомо дві - валентність і атомна маса елементів. Д. І. Менделєєв обрав атомну масу, тому що вона була незмінною характеристикою хімічного елемента. Валентність може бути як постійною, так і змінної, до того ж однакову валентність можуть виявляти елементи з різними хімічними властивостями. Але це не означало, що вчений відмовився від використання валентності. Він ретельно аналізував і порівнював валентності атомів в різних з'єднаннях, і це допомагало йому в роботі над класифікацією хімічних елементів. Щоб з'ясувати, чи існує загальна залежність властивостей хімічних елементів та їхніх сполук від атомної маси, Д. І. Менделєєв розмістив картки із записами символу хімічного елемента за зростанням їх атомної маси, починаючи з Гідрогену. Крім символу елемента на кожній картці були записані округлена атомна маса, формула оксиду, вища валентність в поєднанні з Оксигеном, формула летючого з'єднання з Гідрогеном (для неметалів), валентність елемента в ньому. Розташовані в ряд елементи були пронумеровані, а проставлений їм номер названий порядковим номером.
З'ясувавши, що при постійному збільшенні атомної маси властивості елементів і їх з'єднань періодично повторюються, Д. І. Менделєєв повідомив про своє відкриття. Незабаром воно отримало назву періодичного закону Д. І. Менделєєва. Сталося це 1 березня 1869.
Властивості простих речовин, а також форми і властивості сполук хімічних елементів перебувають у періодичній залежності від величини атомної ваги елементів. Д. І. Менделєєв розбив єдиний ряд елементів на понад короткі ряди так, щоб елементи сімейств були один під одним. Так з'явилося графічне відображення періодичного закону - періодична система.
Навколо Періодичного закону відразу ж після його відкриття розвернулась гостра тривала боротьба, яка сильно відбивалася на душевному стані Д. І. Менделєєва.
Прихильників у нього спочатку було мало. навіть серед російських хіміків. Противників саме багато, особливо в Німеччині та Англії. До них належали Бунзен в Німеччині, Зінін в Росії, Нільсон в Швеції.
Д. І. Менделєєв, спираючись на схожість у властивостях елементів і вірячи в правильність їх місцезнаходження в періодичній системі, змінив прийняті в той час атомні маси і валентності в сполуках з Оксигеном у 10 елементів.
До початку роботи Д. І. Менделєєва над створенням класифікації елементів вважали, що Ar (Be) = 13,5. У такому випадку він повинен був розміститися між Карбоном і Нітрогеном. Але тоді схожі елементи не потрапили б в одну групу. Д. І. Менделєєв звернув увагу на те, що відповідно до форми і властивостей сполук цей елемент повинен зайняти місце між Літієм і Бором, і висловив припущення про помилку в визначенні відносної атомної маси Берилію. Експериментальні дослідження підтвердили правильність припущення Д. І. Менделєєва.
- Діти, як Ви вважаєте, як європейські вчені сприйняли виправлення атомних мас у деяких хімічних елементів?
Зараз ми про це дізнаємося, повернувшись в XIX сторіччя.
Рольова гра.
1 учений. Виправляти загальноприйняті атомні маси - це нечувано!
2 учений. Це немислимо!
3 учений. Що він собі дозволяє, цей Менделєєв!
1 учений. А Ви читали, що сказав з цього приводу Лотар Мейєр, автор книги «Сучасні теорії хімії»?
2 учений. Вельмишановні колеги, це цікаво, ознайомте нас з його думкою.
1 учений. (читає). Періодичний закон - це «спекуляція», тобто умовність, яка не спирається на досвідчені дані? Було б передчасно на підставі таких хитких доказів починати змінювати загальноприйняті зараз атомні маси.
2 учений. Цей закон вимагає перевірки часом.
3 учений. І перевірки на практиці. Адже практика - це критерій істини.
Відкриття періодичного закону дозволило Д. І. Менделєєву дати блискучий зразок наукового передбачення.
У 1870 році він передбачив існування трьох ще невідомих елементів під номерами 21, 31, 32, які назвав Екасіцілієм, Екаалюмінієм і Екабором - вони повинні були заповнити порожні клітини в періодичній системі. Д. І. Менделєєв не тільки передбачив під цими номерами ще не відкриті елементи, а й правильно описав їхні властивості.
Был четвертый ряд нарушен
Элемент не обнаружен
Элемент не обнаружен
Тот, что в этом месте нужен.
Но напрасно беспокойство
Существует где-то он!
« Я найду сначала свойства,
и поможет мне закон».
Удельный вес назвал и цвет,
летуч на воздухе иль нет,
как плавится, в чем растворим…
Законом пользуясь своим
Три элемента предсказал
Как будто их в глаза видал!
Быть может, раз в тысячелетье
Свершить подобное дано.
Но мир открытья не заметил
иль не поверил, все равно.
И кто-то говорил по-свойски:
«Забудь об этой ерунде!
Как можно обнаружить свойства веществ,
Не найденных нигде!»
У 1875 році Лекок де Буабодран, нічого не знаючи про роботи Д.І Менделєєва, відкрив новий метал, назвавши його Галієм. По ряду властивостей Галій збігся з Екаалюмінієм Д. І. Менделєєва. Але питома вага Галлія виявилася менше передбаченої. Незважаючи на це Д.І.Менделєєв послав до Франції «Нотатку з приводу відкриття Галію».
Рольова гра.
Ведучий.
Вот как-то раз узнали ученые всех стран:
металл чудесный Галлий
(в честь Франции назвали)
Открыл Буабодран
Довольный и счастливый
Рассматривал металл
Но писем из России
Никак не ожидал.
Он взял письмо, прочел его.
Буабодран.
От русского ученого?
- Ошибся я! Слыхали?!-
Ведучий.
Француз был удивлен.
Буабодран.
- В глаза не видел Галлий
А свойства знает он!
Вес высчитал удельный
Точней, чем я стократ
Какой-то Менделеев
Еще пять лет назад!
Ведучий.
Глаза его сверкали,
Топорщились усы.
Но вот металл свой, Галлий
Он кинул на весы!..
Ответ в Россию мчится:
Буабодран.
-Прекрасная таблица!
Я Вами восхищен!
Проверен мной практически
Закон периодический,
И я категорически
Приветствую закон!»
Це був перший тріумф періодичного закону, який викликав великий інтерес до праць Д.І. Менделєєва і його прогнозів. Вчений світ був приголомшений тим, що пророкування Д.І. Менделєєвим властивостей Екалюмінію виявилося таким точним. З цього моменту періодичний закон починає затверджуватися в хімії, переходячи з гіпотези в строго доведену істину.
Учень № 5.
У химиков переполох!
Ведь Галлий был одним из трех,
Предсказанных заранее!..
И следом, как из-под земли,
Вдруг Скандий в Швеции нашли,
На свет Германий извлекли
(Естественно в Германии).
У нашому класі є діти, які захоплюються хімією та історією. Вони підготували повідомлення про відкриття Скандія та Германія.
Рольова гра.
Учень № 1.
У 1879 році шведський вчений Ларс Фредерік Нільсон відкрив новий елемент, який назвав на честь своєї вітчизни Скандієм. У 1880 році він писав: «Немає ніякого сумніву в тому, що в Скандії відкритий Екабор!». Нільсон подарував Менделєєву шматочок скандію, але через чотири роки попросив повернути цю порцію, тому що йому бракувало металу для дослідження. Подарунок був повернутий, обидва вчених не надали значення порушенню правил етикету, тому що цього вимагали інтереси науки.
Учень № 2.
Слідом за Екабором німецьким хіміком Клеменсом Вінклером в 1885 році був відкритий Екасіцілій, який він назвав Германієм. Властивості цього елемента були описані Менделєєвим більш повно, тому тільки лише з'явилася стаття Вінклера, багато вчених, які повірили в справедливість періодичного закону, взялися зіставляти її з надрукованою 15 років тому статтею Менделєєва. Клеменс Вінклер пише Менделєєву: «Повідомляю Вам про новий тріумф Вашого геніального дослідження і висловлюю Вам свою глибоку повагу!»
Відкриття передбачених Менделєєвим невідомих елементів мало не тільки наукове, теоретичне значення. Коли ще в 20-і роки минулого століття розвиток електротехніки вимагав нових матеріалів, які за своїми якостями перевершували б вольфрам, періодичний закон показав, що таким повинен бути елемент, для якого Д. І. Менделєєв залишив місце в одній групі з Манганом (що це означає ?). Власники електротехнічних фірм побоялися виділити гроші на пошуки нового елемента. У 1925 році німецькі вчені Вальтер і Ноддак відкрили Реній і переконалися, що з нього можна виготовляти чудові нитки для лампочок розжарювання.
- Осмислення вивченого
Наведіть приклади періодичних змін в природі
Пригадайте як Дмитро Іванович Менделєєв сформулював періодичний закон
Інтерактивна технологія колективно–групового навчання «Незакінчене речення».Учні продовжують речення: «Найцікавішим на цьому уроці для мене було…».
- Домашнє завдання
Вивчити §21


про публікацію авторської розробки
Додати розробку