Урок “Солі, їх поширення в природі. Середні й кислі солі. Поняття про жорсткість води та способи її усунення”
Дата 21.11.2019
Розробка уроку з хімії для учнів 11 класу за темою
“Солі, їх поширення в природі. Середні й кислі солі. Поняття про жорсткість води та способи її усунення”
Наскрізні змістові лінії
Громадянська відповідальність
Поняття про жорсткість води та способи її усунення.
Здоров’я і безпека
Поняття про жорсткість води та способи її усунення.
Підприємливість і фінансова грамотність
Поняття про жорсткість води та способи її усунення.
Обчислення кількості речовини, маси або об’єму продукту за рівнянням хімічної реакції, якщо один із реагентів взято в надлишку.
Мета:
формування ключових компетентностей:
- основні компетентності у природничих науках і технологіях;
- соціальна та громадянська компетентності;
- екологічна грамотність і здорове життя;
формування предметних компетентностей:
- формувати знання про солі, середні й кислі солі, їх поширення в природі
та властивості, про жорсткість води і способи її усунення, вміння складати формули речовин та рівняння хімічних реакцій;
- розвивати хімічну мову, екологічне мислення;
- виховувати інтерес до вивчення хімії.
Обладнання: мультимедійний проектор, комп’ютер, 2 ноутбуки, гаджети, роздавальний матеріал.
Реактиви: Розчини солей BaCl2, FeCl3, розчин кислоти H2SO4, лугу NaOH, індикатори фенолфталеїн, метилоранж, хімічні стакани.
Тип уроку: ВНМ (Д) — вивчення нового матеріалу(додатковий об’єм);
Форми роботи: бесіда, евристична лекція, робота в групах, робота з підручником, захист проєктів, прийоми «Гронування», «Міні-практикум», метод проектів, групові форми роботи, вправа “Мікрофон”, метод “Зоряні перегони”, робота з інтернет-ресурсами https://learningapps.org/display?v=pucfshhcj01 тощо.
До початку урока перед входом до класу кожен учень одержує смайлик певного кольру. Усього 2 кольори смайликів. Увійшовши до класу, кожен сідає за стіл відповідного кольору та підписує своє ім’я на смайлику та кріпить його в якості бейджа. Тож, учні об’єднуються у дві команди: команда червоних смайликів та команда синіх смайликів.
1 хв. І. Організація класу слайд 1
Учитель. Доброго дня, шановні одинадцятикласники! Рада вітати на уроці. Сподіваюсь, що смайлики, які ви одержали, трошки налаштували вас на позитивний настрій. Я бажаю нам плідної і цікавої роботи.
На смайлику ви написали своє ім’я, я теж написала своє. І таким чином ми з вами познайомимось і будемо далі співпрацювати. Дякую!
Сьогодні ви будуте працювати в групах-командах. За кожну правильну відповідь ви одержуєте оціночні фішки (показує). Учні команди, яка переможе, одержать додатково +2 бали до своїх оцінок. Подивимось, який у вас командний дух! При відповіді на запитання команда вкючає лампу свого кольору (оберіть, будь ласка у кожній команді капітана для цієї місії). Давайте потронуємось. Команда, яка першою включила лампу, має змогу відповідати першою. Тільки при неправильній відповіді право відповідати переходить до іншої команди. Умови зрозумілі? Тож бажаю успіхів!
2 хв. ІІ. Актуалізація опорних знань
Учитель. Давайте згадаємо класифікацію речовин, яку ви почали вивчати ще у 7 класі.
Прийом «Гронування». Учні записують схему, яка є на слайді слайд 2, у зошит і заповнюють її. Після закінчення виконання завдання, учитель показує слайд з правильною схемою. Класифікація неорганічних сполук
слайд 3
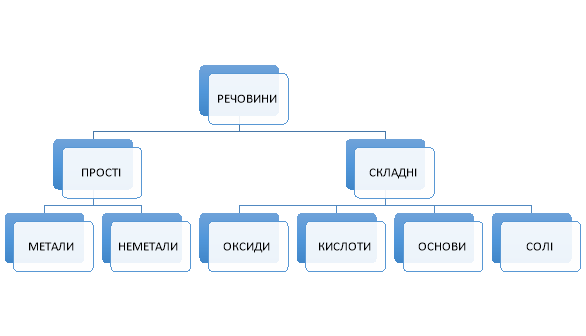
ІІІ. Оголошення теми і мети уроку слайд 4
Тему уроку записують у зошит.
2 хв. IV. Мотивація навчальної діяльності
Учитель. Сьогодні на уроці ми продовжимо знайомство зі сполуками металів, їхніми властивостями та застосуванням. Кожен по черзі називає те, що він пам’ятає з курсу хімії про солі. слайд 5
Вправа «Мікрофон» «Я знаю про солі…»
4 хв. Учитель. А тепер пропоную пройти тест онлайн на знання основних класів неорганічних сполук (оксидів, кислот, основ, солей). Для цього виконаємо вправу “Зоряні перегони” з викоористанням платформи learningapps.org ). Для цього кожному необхідно відсканувати QR-код і пройти невелике тестування. На виконання завдання 4 хвили за таймером (вкючає таймер, кожен проходить тестування, завдання відображуються на екрані).
https://learningapps.org/display?v=pucfshhcj01
1 хв. Учитель. Давайте визначимо завдання сьогоднішноьго уроку (пропозиції дітей). Завдання на слайді слайд 6 та на зворотьому боці дошки.
- Повторити властивості основних класів неорганічних сполук.
- Розглянути класифікацію солей, їх поширення в природі та використання.
- Пригадати хімічні властивості середніх солей.
- З’ясувати способи одержання кислих солей.
- Узагальнити знання з теми.
- Створити узагальнюючий проєкт інтелект-карта на одну з тем: «Застосування солей»; «Зв’язок теми з іншими науками», «Солі в природі» слайд 7-8
Епіграф уроку: “Інтелект-карта: мистецтво мислити ширше!”
3 хв. Учитель. Над створенням проєкту ви працюєте протягом уроку. В кінці уроку захищаєте проєкти. Теми проєктів записано також у роздатковому матеріалі у кожної команди на столі. Я нагадаю на конкретних прикладах, як створюються інтелект-карти (слайди 9-12) (пояснення учителя)
Учитель. Я сподіваюсь, що хімічні властивості основних класів неорганічних сполук ви теж пам’ятаєте. Тому пропоную трохи погартись і взяти участь у конкурсі «Барменів»
5 хв. Конкурс «барменів» слайд 13.
Видаються на кожний стіл підноси зі склянками і реактивами. З виданих речовин приготувати:
1) молоко BaCl2H2SO4BaSO42HCl
2) малиновий компот лугфенолфталеїн
3) Соса-Соlа FeCl33NaOHFe(OH)33NaCl
4) яблучний сік кислотаметилоранж
До всіх реакцій написати в зошиті рівняння. По 1-му балу за кожний «напій»
Учитель. Вам необхідно за 5 хвилини «приготувати напої», записані на слайді слайд. До всіх реакцій записати в зошит рівняння хімічнитх реакцій. За кожне правильно виконане завдання з чотирьох команда одержує по 1 балу. Команда, яка виконала перше завдання, включає лампу. Не забувайте користуватися сигнальними лампами, коли команда готова відповідати. Умови записано на слайді. Давайте пригадаємо правила техніки безпеки при роботі з реактивами, які у вас також є на столах в роздатках (відповіді учнів).
Після закінчення роботи і відповідей команд учитель демонструє на слайді правильні відповіді. слайд 14
V. Вивчення нового матеріалу
2 хв. Евристична лекція + робота біля дошки
Кислота + Основа → ???
(учитель та учні записують на дошці та в зошитах рівняння реакцій між кислотами і основами і доходять висновків, що при взаємодії кислот з основами можуть утворюватись не лише середні солі, а й кислі)
Кислі солі — MeHK.
Одержання кислих солей:
NaOH+H3PO4=NaH2PO4+H2O
2NaOH+H3PO4=Na2HPO4+2H2O
3NaOH+H3PO4=Na3PO4+3H2O
2CO2+Ca(OH)2=Ca(HCO3)2
CO2+Ca(OH)2=CaCO3+H2O
Учитель. Давайте пригадаємо класифікацію солей (записують в зошитах).
1 хв. Прийом «Гронування» слайд 15
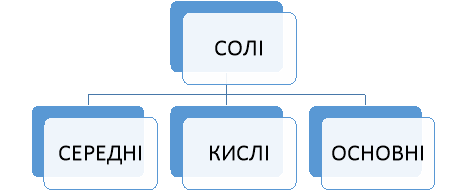
5 хв. Робота в групах
- Поширеність у природі солей та їх практичне значення.
На допомогу учням платформа Googl, YouТubе. На виконання завдання 5 хвилин. Користуватись можна підручником, роздатковим матеріалом ноутбуками і мобільними телефонами.
Після виконання завдання команди озвучують відповіді (3 хвилини). Нагадую, що команда, яка першою виконає завдання має можливість одержати більше балів. НЕ ЗАБУВАЙТЕ ПРО СИГНАЛЬНІ ЛАМПОЧКИ.
3 хв. Учитель. Пропоную спробувати установити відповідності між хімічними властивостями середніх солей і рівняннями реакцій. слайд 16 Працюємо в зошитах та перевіряємо.
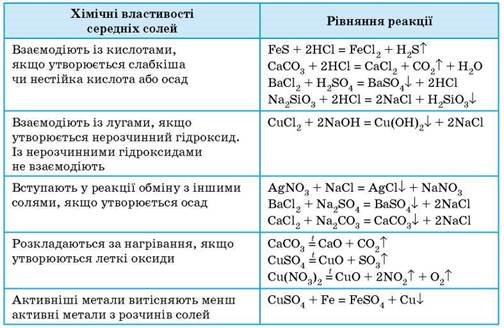
3 хв. Поняття про твердість води.
Учитель. Всі добре та попрацювали, а значить заробили хвилинку релаксу. Подивіться, будь ласка, коротенький фільм. Увага! Просмотр навчального фільму “Твердість води” (1 хв. 27 с)
Учитель. Та не все так просто. Звичайно ж учні 11 класу не можуть просто дивитись кіно. Запишіть у зошит 3 запитання до фільму.
VІ. Закріплення вивченого матеріалу
5 хв. Захист проектів.
Учитель. Закінчуємо протягом 3-х хвилин роботу над проєктами. Захист.
(під час роботи над проектом звучить релаксаційна музика)
3 хв. Прийом «Експрес-тести» (роздруковані тести лежать на столах для кожного, після роботи на тестом, їх здають вчителеві)
1) Солі, які у своєму складі крім атомів металів мають атоми Гідрогену:
а) основні;
б) кислі;
в) подвійні;
г) середні.
2) Солі, які у своєму складі крім кислотного залишку мають гідроксильні групи:
а) основні;
б) кислі;
в) подвійні;
г) середні.
3) Тимчасова жорсткість води зумовлюється наявністю:
а) Ca(HCO3)2 ;
б) MgSO4;
в) NH4Cl;
г) CaCl2.
4) Постійна жорсткість води зумовлюється наявністю:
а) Ca(HCO3)2;
б) MgSO4;
в) NH4Cl ;
г) Mg(HCO3)2 .
224 Усі уроки хімії. 11 клас
5) Усунути тимчасову жорсткість води можна:
а) додаванням соди;
б) додаванням вапняного молока;
в) відстоюванням;
г) кип’ятінням.
6) Усунути постійну жорсткість води можна:
а) додаванням соди;
б) додаванням вапняного молока;
в) відстоюванням;
г) кип’ятінням.
7) Натрій сульфат взаємодіє з:
а) KCl;
б) Mg(OH)2 ;
в) BaCl2;
г) Al (NO3)3.
8) Нітрати Калію і Натрію застосовуються в:
а) сільському господарстві;
б) літакобудуванні;
в) приладобудуванні;
г) харчовій промисловості.
9) Калій карбонат взаємодіє з:
а) NaCl;
б) Ba(OH)2;
в) H2O;
г) HCl.
10) Кальцій карбонат застосовується в:
а) сільському господарстві;
б) літакобудуванні;
в) будівництві;
г) харчовій промисловості.
VІІ. Підбиття підсумків уроку
1 хв. Учитель. Оцінювання команд. ДЛЯ ОЦІНЮВАННЯ ДОСЯГЕНЬ ПРОШУ КАПІТАНІВ КОМАНД ПРИНЕСТИ АРКУШИ З ПРІЗВИЩАМИ УЧНІВ ТА КІЛЬКІСТЮ ФІШОК.
1 хв. VІІІ. Домашнє завдання
- Параграф …..
- Записати по 2 рівняння реакцій, які характеризують хімічні властивості солей.
- Створити інтелек-карту на одну з тем у цифровому варіанті (за бажаням): «Застосування солей»; «Зв’язок теми “Солі” іншими науками», «Солі в природі» (за бажангям).
1 хв. ІХ. Рефлексія.
«Чемодан, м’ясорубка, кошик»
Чемодан - все, що знадобиться в подальшому.
М’ясорубка - інформацію опрацюю.
Кошик - все викину.
Учням пропонується вибрати, що вони зроблять з інформацією, одержаною на уроці, промовив вголос відповідне слово.
Учитель. Я дякую вам за урок. Давайте подякуємо оплисками один одному за роботу (оплиски).
«Експрес-тести»
1) Солі, які у своєму складі крім атомів металів мають атоми Гідрогену:
а) основні;
б) кислі;
в) подвійні;
г) середні.
2) Солі, які у своєму складі крім кислотного залишку мають гідроксильні групи:
а) основні;
б) кислі;
в) подвійні;
г) середні.
3) Тимчасова жорсткість води зумовлюється наявністю:
а) Ca(HCO3)2 ;
б) MgSO4;
в) NH4Cl;
г) CaCl2.
4) Постійна жорсткість води зумовлюється наявністю:
а) Ca(HCO3)2;
б) MgSO4;
в) NH4Cl ;
г) Mg(HCO3)2 .
224 Усі уроки хімії. 11 клас
5) Усунути тимчасову жорсткість води можна:
а) додаванням соди;
б) додаванням вапняного молока;
в) відстоюванням;
г) кип’ятінням.
6) Усунути постійну жорсткість води можна:
а) додаванням соди;
б) додаванням вапняного молока;
в) відстоюванням;
г) кип’ятінням.
7) Натрій сульфат взаємодіє з:
а) KCl;
б) Mg(OH)2 ;
в) BaCl2;
г) Al (NO3)3.
8) Нітрати Калію і Натрію застосовуються в:
а) сільському господарстві;
б) літакобудуванні;
в) приладобудуванні;
г) харчовій промисловості.
9) Калій карбонат взаємодіє з:
а) NaCl;
б) Ba(OH)2;
в) H2O;
г) HCl.
10) Кальцій карбонат застосовується в:
а) сільському господарстві;
б) літакобудуванні;
в) будівництві;
г) харчовій промисловості.
«Експрес-тести»
1) Солі, які у своєму складі крім атомів металів мають атоми Гідрогену:
а) основні;
б) кислі;
в) подвійні;
г) середні.
2) Солі, які у своєму складі крім кислотного залишку мають гідроксильні групи:
а) основні;
б) кислі;
в) подвійні;
г) середні.
3) Тимчасова жорсткість води зумовлюється наявністю:
а) Ca(HCO3)2 ;
б) MgSO4;
в) NH4Cl;
г) CaCl2.
4) Постійна жорсткість води зумовлюється наявністю:
а) Ca(HCO3)2;
б) MgSO4;
в) NH4Cl ;
г) Mg(HCO3)2 .
224 Усі уроки хімії. 11 клас
5) Усунути тимчасову жорсткість води можна:
а) додаванням соди;
б) додаванням вапняного молока;
в) відстоюванням;
г) кип’ятінням.
6) Усунути постійну жорсткість води можна:
а) додаванням соди;
б) додаванням вапняного молока;
в) відстоюванням;
г) кип’ятінням.
7) Натрій сульфат взаємодіє з:
а) KCl;
б) Mg(OH)2 ;
в) BaCl2;
г) Al (NO3)3.
8) Нітрати Калію і Натрію застосовуються в:
а) сільському господарстві;
б) літакобудуванні;
в) приладобудуванні;
г) харчовій промисловості.
9) Калій карбонат взаємодіє з:
а) NaCl;
б) Ba(OH)2;
в) H2O;
г) HCl.
10) Кальцій карбонат застосовується в:
а) сільському господарстві;
б) літакобудуванні;
в) будівництві;
г) харчовій промисловості.


про публікацію авторської розробки
Додати розробку
