Урок Тема: Електролітична дисоціація. Електроліти і неелектроліти.
Тема: Електролітична дисоціація. Електроліти і неелектроліти.
Мета: формувати уявлення учнів про процеси, що відбуваються в розчинах. Ознайомити з поняттями «електроліти», «неелектроліти», «електролітична дисоціація». Пояснити залежність електролітичної дисоціації від будови молекул розчиненої речовини й розчинника.
Тема: Електролітична дисоціація. Електроліти і неелектроліти.
Мета: формувати уявлення учнів про процеси, що відбуваються в розчинах. Ознайомити з поняттями «електроліти», «неелектроліти», «електролітична дисоціація». Пояснити залежність електролітичної дисоціації від будови молекул розчиненої речовини й розчинника.
Обладнання: підручник «Хімія. 9 кл.» таблиця розчинності.
Тип уроку: вивчення нового матеріалу.
Хід уроку
І. Організаційний етап.
ІІ. Мотивація навчальної діяльності.
З курсу природознавства та фізики ви знаєте, що метали проводять електричний струм. Чому ця властивість притаманна металам? (рух електронів) Ag, Au, Cu мають найвищу електропровідність.
Деякі неметали, наприклад графіт, теж може проводити струм.
А чи проводить струм вода? (дистильована – ні, з криниці, річки, моря – так).
Розглянемо досліди.
Дослід №1. Дистильована вода не проводить струм
Дослід №2 Суха сіль не проводить струм.
Дослід № 3 Розчин солі проводить струм.
Чому одні речовини проводять струм, а інші - ні? Як їх класифікують? Що відбувається з ними, коли їх розчиняють? Відповіді на ці запитання ми дамо на сьогоднішньому уроці.
ІІІ. Вивчення нового матеріалу.
За здатністю проводити струм речовини поділяються на дві групи:
Діти заповнюють схему під керівництвом учителя.
Поділ речовин на електроліти та неелектроліти вперше запропонував англійський вчений Майкл Фарадей .
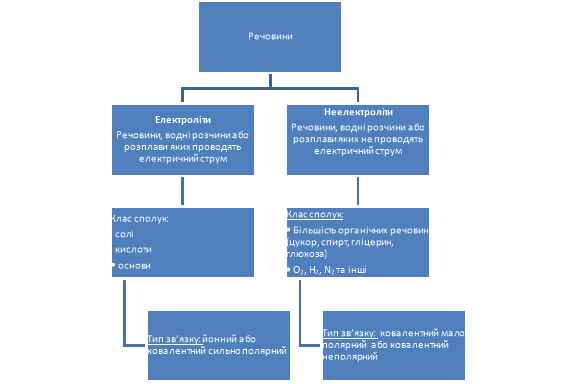
Чому електроліти проводять струм?
Бо при розчиненні речовини чи при сплавленні з’являються зарядженні частинки, які можуть вільно рухатися. Ці частинки називаються йонами. Пригадайте, що таке йони?
Електролітична дисоціація – процес розщеплення електролітів на йони під час розчинення або розплавлення.
Теорію електролітичної дисоціації сформулював швед Сванте Арреніус (1887 р.), за що у 1901 р. отримав Нобелівську премію з хімії.
Як відбувається процес розчинення?
Механізм дисоціації сполук з йонним зв’язком Малюнок підручника
Прослідовність процесів:
- Орієнтація диполей води біля йонів кристалу.
- Гідратація - взаємодія молекул води з йонами
- Дисоціація (розпад) кристала на гідратовані йони.
Рівняння: NaCl ↔ Na+ + Cl-
Механізм дисоціації сполук з ковалентним полярним зв’язком Малюнок підручника
Прослідовність процесів:
- Орієнтація диполей води навколо полюсів молекули НСl
- Гідратація - взаємодія молекул води з НСl
- Йонізація молекули електроліта (перетворення ковалентного зв’язку на йонний)
- Дисоціація (розпад) молекули електроліту на гідратовані йони.
Рівняння: НCl ↔ Н+ + Cl-
Узагальнення і закріплення набутих знань
( Фронтальна бесіда, складання таблиці, ігрові вправи)
- На які групи можна поділити речовини за їх здатністю проводити електричний струм?
- Який вчений запропонував поділ речовин на ці дві групи?
- Узагальнимо наші знання з теми, заповнимо таблицю:
|
|
Електроліти |
Неелектроліти
|
|
Визначення понять
|
|
|
|
Речовини, що належать до даної групи |
|
|
|
Тип зв’язку
|
|
|
- Я називаю речовину. Якщо вона є електролітом, ви плескаєте в долоні, а якщо – неелектроліт, то ви робите долонями рухи вліво і вправо.
Речовини: хлоридна кислота, кисень, натрій хлорид, натрій гідроксид, спирт, ацетон, кальцій гідроксид, глюкоза, вуглекислий газ, сульфатна кислота.
- Які із речовин будуть проводити електричний струм:
Крейда Мінеральна вода Сода кухонна сіль розчини солей цукор Оцет Олія Сульфатна кислота Пісок Інертний газ та кисень Розчин натрій гідроксиду
Домашнє завдання:
§


про публікацію авторської розробки
Додати розробку
