Урок Тема: Закон збереження маси речовин під час хімічних реакцій. Схема хімічної реакції. Хімічні рівняння.
Тема: Закон збереження маси речовин під час хімічних реакцій. Схема хімічної реакції. Хімічні рівняння.
Мета:
- ознайомити учнів із законом збереження маси речовини,розкрити суть цього закону, сформувати уявлення про роботи А.Лавуазьє, М.Ломоносова в цій галузі, пояснити значення закону збереження маси в хімії; пояснити схему хімічної реакції, її суть, сформувати поняття про хімічні рівняння, пояснити правила складання рівнянь хімічних реакцій;
- розвивати вміння розставляти коефіцієнти в рівняннях хімічних реакцій; пізнавальний інтерес, логічне мислення; предметну і ключові компетентності учня, його екологічну культуру, навички безпечного поводження з речовинами, роль хімічних знань у поясненні природи речовин і суті хімічних явищ; значення хімії в житті людини, здатність до самоосвіти;
- виховувати загальної культури, світоглядні орієнтири, екологічного стиль мислення і поведінку, творчі здібності, дослідницькі навички і навичоки життєзабезпечення; самостійність,бережливе ставлення до навколишнього середовища.
Тип уроку: урок вивчення нового матеріалу.
Базові поняття і терміни: закон збереження маси речовини, коефіцієнт.
І Організація початку уроку
Створення ситуації успіху.
Доброго дня діти! Сьогоднішній урок я хочу розпочати словами з китайської народної мудрості «Не бійся, що не знаєш, бійся, що не навчишся». Тож я всім вам бажаю впевненості, сумлінної праці й успіхів на сьогоднішньому уроці.
II Актуалізація опорних знань та мотивація навчальної діяльності
А зараз, закрийте очі, уявіть: середина XIII століття, старовинний замок, а в ньому розмістилася величезна хімічна лабораторія, в якій день і ніч працюють найвидатніші алхіміки того часу. І вони, дозволили нам попрацювати в цьому замку. Але, перед тим як вирушити до замку й розпочати працювати там, ми повинні переконатися, чи вистачить у вас знань. Тож давайте згадаємо, що ми вивчали на минулих уроках. Світ такий різноманітний й таємничий. А наука хімія розкриває деякі його таємниці.
На попередніх уроках ми з вами говорили про те, що все, що знаходиться навколо нас не стоїть на місці, все змінюється.
1. Як називають зміни, які відбуваються у навколишньому середовищі? (Явищами).
2. Які види явищ вам відомі? (Біологічні, фізичні, хімічні, політичні, соціальні тощо).
3. Яке явище називають хімічним? (Явище, під час якого одні речовини перетворюються на інші).
Хімічний диктант.
Позначте фізичні та хімічні явища літерами «ф» та «х».
1. Прокисання молока (х) .
2. Танення льоду (ф)
3. Випаровування спирту (ф) .
4. Обвуглення деревини (х) .
5. Рубання дров (ф) .
6. Випадання снігу (ф) .
7. Згіркнення масла (х) .
8. Утворення веселки (ф) .
9. Горіння свічки (х) .
10. Витягування золота у довгу нитку (ф) .
11. Бродіння виноградного соку . (х)
12. Потемніння мідної монети (х).
13. Притягання заліза до магніту(ф).
14. Гасіння соди оцтом(х).
15. Горіння бенгальських вогників(х) .
16.Утворення «сонячного зайчика» (ф).
Вправа «Знайди та поясни».
- Із запропонованих карток, вивішених на дошці, виберіть ті, що належать до хімічних явищ. Поясніть свій вибір.
|
Випадіння дощу |
Почорніння срібних предметів |
Скисання молока |
|
Вивітрювання гірських порід |
Пожежа |
Пожовтіння листя |
Які ж зміни відбулися під час хімічного перетворення? (Під час хімічного перетворення атоми перегрупувалися).
Так, дійсно, під час хімічної реакції відбувається перегрупування атомів, що дає початок новим речовинам. Це і є суть хімічного перетворення.
Кожний атом має свою масу. Тому виникає доречне запитання. Чи залишається незмінною маса речовин під час перегрупування атомів?
Саме відповідь на це запитання ми повинні знайти сьогодні на уроці. А для цього розглянемо матеріал уроку тема якого…( Оголошення теми та мети уроку)
ІІІ. Мотивація учнів. Повідомлення теми і мети уроку.
Розгадування ребусів, з допомогою яких закодована тема.

Всі науки базуються на законах. Що таке закон? Які ви знаєте закони? Яке їх значення?
Закон — теоретично обґрунтоване та експериментально доведене наукове твердження. Закон з’являється після пояснення та узагальнення великої кількості фактів. Його відкриття є справжньою подією в науці. Вивчення законів хімії ми розпочнемо із закону збереження маси речовин.
Відкрийте зошити і запишіть тему уроку.
IV. Вивчення нового матеріалу.
Трішки історії. Відкриттю будь-якого закону передує величезна експериментальна праця. Багато учених проводили досліди із нагріванням речовин. Одним з них був Р. Бойль.
- Знаменитий англійський фізик Роберт Бойль, прожарюючи у відкритій реторті різні метали та зважуючи їх до і після нагрівання, з’ясував, що маса металів збільшується. Він зробив висновок, що маса речовин у результаті хімічної реакції змінюється. Р. Бойль стверджував, що існує якась «вогняна матерія», що в разі нагрівання металу з’єднується з ним, збільшуючи його масу.
- Як і всіх хіміків, Антуана Лавуазьє цікавив процес горіння. У 1772 році Лавуазьє спільно з іншими хіміками придбав алмаз. Він помістив його в закриту посудину і нагрівав доти, поки алмаз не зник. При цьому утворився вуглекислий газ. Але маса посудини з умістом не змінилася. Продовжуючи досліди, він нагрівав у закритих посудинах метали. Обмірковуючи результати дослідів, Лавуазьє дійшов висновку, що, якщо враховувати всі речовини, які беруть участь у хімічній реакції й утворюються в результаті реакції, то жодних змін не відбувається.
- Аналогічні досліди проводив М. В. Ломоносов. Ще в 1748 році він сформулював результати своїх досліджень як закон збереження речовини — один з фундаментальних законів природи.
Успіхи Лавуазьє були настільки великими й очевидними, що цей закон було прийнято всіма хіміками.
Закон збереження маси ввійшов в історію як закон Ломоносова — Лавуазьє. Його сучасне формулювання знайдіть у підручнику с. 101 й запишіть:
Загальна маса речовин, що вступили в хімічну реакцію, дорівнює загальній масі речовин, одержаних у результаті реакції.
Короткий запис закону:
m (реагентів) = m (продуктів)
За яких умов дійсний? (закрита посудина).
Проблемне запитання: чому маса речовин зберігається?
Згадаємо з чого складаються речовини? Чи можуть частинки зникати?
Отже, в чому суть хімічної реакції? ( в перегрупуванні атомів)
Отже, під час хімічних реакцій молекули вихідних речовин руйнуються до атомів. Молекули нових речовин утворюються з тих же атомів, з яких складалися молекули вихідних речовин. Оскільки кожен атом мае певну масу й атоми під час хімічних реакцій зберігаються, то й загальні маси речовин до і після реакції будуть рівними.
Яке значения закону збереження маси речовин?
1) Він підтверджує, що речовини не зникають безвісти й не утворю ються з нічого.
2) Закон підтверджує висновок про те, що сутність хімічних реакцій полягає в перерозподілі атомів вихідних речовин і утворенні нових сполук
3) Закон дозволяє складати рівняння реакцій і здійснювати за ними розрахунки.
Закон збереження маси речовин є основою для складання рівнянь хімічних реакцій. Хімічні рівняння — це спосіб записувати хімічні процеси та їхні явища. До цього вдавалися ще в середні віки. Однак тоді алхіміки приховували свої знания й зашифровували свої записи. Сьогодні рівняння реакцій записують на підставі загальноприйнятих положень, прочитати їх може будь-хто, знайомий з основами хімії. Якщо сказати, що символи хімічних елементів — це літери хімічної мови, то формули сполук — це слова, а рівняння — цілі фрази. Так, фразу «вода розкладається з утворенням водню й кисню» можна записати з допомогою такої схеми:
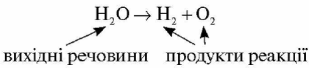
Оскільки маса речовин, що вступили в хімічні реакції, дорівнюють масі речовин, що утворилися в результаті реакції, то кільйсть усіх атомів хімічних елементів у схемі потрібно зрівняти. Для рівняння використовують коефіцієнти.
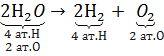
Рівність числа атомів у лівій частині числу атомів у правій частині й зумовлена цим рівність мае речовин є доказом правильності розміщення коефіцієнтів.
Хімічне рівняння — це умовний запис хімічних реакцій з допомогою хімічних формул і коефіцієнтів
V. Осмислення і закріплення нового матеріалу.
1. Після догоряння багаття залишається купка попелу набагато меншої маси, ніж була маса дров. Чи не суперечить це закону збереження маси речовин?
Під час хімічних реакцій молекули вихідних речовин руйнуються до атомів. Молекули нових речовин утворюються з тих же атомів, з яких складалися молекули вихідних речовин. Оскільки кожен атом має певну масу й атоми під час хімічних реакцій зберігаються, то загальні маси речовин до і після реакції теж будуть однаковими.
Н2О---- Н2+О2 С+О2-------СО2 СН4+О2------СО2+Н2О
Вих. ----- Продукти
Схема показує, які речовини прореагували та які утворилися після реакції. Щоб довести закон збереження маси речовини ми повинні підібрати коефіцієнти у схемах і перетворити їх на рівняння.
Робота з підручником. Знайти, прочитати і записати в зошити визначення - «Хімічне рівняння» с. 104.
Розставляючи коефіцієнти, слід пам'ятати такі правила:
1. Коефіцієнт велика цифра, яка ставиться перед формулою речовини.
2. Коефіцієнт належить всім хімічним елементам, які утворюють речовину.
3. Не можна ставити коефіцієнт всередину формули відповідної речовини.
4. Під час підбору коефіцієнтів перевіряють кількість атомів кожного елемента.
5. Коефіцієнт 1, як і індекс 1, не записується.
6. Оксиген завжди зрівнюють останнім.
7. Якщо кількість атомів елементів у лівій частині відповідає кількості атомів елементів у правій частині заміни знак → у схемі рівняння на знак =.
Робота біля дошки. Розставте коефіцієнти в схемах хімічних рівнянь
1) Fe + Cl2 → FеСІ2
2) Na + С12 → NaС1
3) Аg + S → Аg2S
4) А1 + О2→ А12О3
5) НgО → Нg + О2
6) Na + О2→Nа2О
Розв’язання задач на картках (для учнів лідерів).
А) Унаслідок взаємодії 10 г метану з 42 г кисню утворилося 34 г вуглекислого газу й вода. Обчисліть, яка маса води виділилась в результаті цієї реакції (18 г).
Б) У виробництві негашеного вапна (CaO) використовують вапняк (CaCO3). При розкладанні 1 т вапняку утворюється 560 кг негашеного вапна і вуглекислий газ (CO 2). Яка маса вуглекислого газу? (440 кг).
1. … + O2 → CO2 4. Ba + … → BaS
2. … + Cl2 → AlCl 3 5. Na + O2 → …
3. Al + … → Al2O3
Запишіть рівняння взаємодії таких простих речовин і доберіть коефіцієнти:
а) водень та азот; г) калій і хлор;
б) кальцій і кисень; д) алюміній і йод;
в) магній і бром.
VІ. Підсумки уроку. Оцінювання роботи учнів, мотивація оцінок.
Вправа «Ланцюжок» Поставити запитання один одному з вивченого матеріалу.
Яке значення закону збереження маси ?
1) він підтверджує, що речовини не зникають без сліду й не утворюються з нічого;
2) підтверджується висновок про те, що суть хімічних реакцій полягає в перегрупуванні атомів вихідних речовин й утворенні нових сполук;
3) завдяки йому можна складати рівняння реакцій і робити за ними розрахунки.
4) відкриття закону збереження маси речовин сприяло подальшому розвитку хімічної науки і виробництва, розумінню законів природи та зв’язку між ними.
VIІ. Домашнє завдання.
1. Опрацювати матеріал підручника : §16 виконати № 1-6 ст. 118
VІІІ. Рефлексія. Я дізнався…….Я навчився….. Мені сподобалось….
1. Яке явище спостерігав М. В. Ломоносов?
2. Чим відрізняється результат досліду, якщо проводити його у відкритому посуді?
3. Чому маса золи менше маси згорілої деревини? (Вуглекислий газ, вода випаровуються)
4. Аеронавти завантажили на повітряну кулю 3 кг продуктів і вирушили в політ. Як змінилася маса повітряної кулі з аеронавтами після того, як усі продукти було з’їдено?
5. Поясніть, чи не суперечить закону збереження маси речовин те, що маса проржавілого відра може виявитися більше, ніж маса такого самогонового відра?
6. Чому закон має назву «закон збереження речовини»?


про публікацію авторської розробки
Додати розробку






