Урок "Тепловий ефект реакції. Екзотермічні та ендотермічні реакції. Термохімічні рівняння."
розширити уявлення про класифікацію хімічних реакцій; сформувати поняття про тепловий ефект хімічної реакції, розкрити його фізичний зміст; вивчити поняття «екзо-» та «ендотермічні реакції»; сформувати поняття про термохімічні рівняння як наслідок законів збереження маси та енергії; формувати вміння складати термохімічні рівняння; навчити розрізняти екзо- та ендотермічні реакції за рівнянням реакції
Тема: Тепловий ефект реакції. Екзотермічні та ендотермічні реакції. Термохімічні рівняння.
Мета: розширити уявлення про класифікацію хімічних реакцій; сформувати поняття про тепловий ефект хімічної реакції, розкрити його фізичний зміст; вивчити поняття «екзо-» та «ендотермічні реакції»; сформувати поняття про термохімічні рівняння як наслідок законів збереження маси та енергії; формувати вміння складати термохімічні рівняння; навчити розрізняти екзо- та ендотермічні реакції за рівнянням реакції (знаннєвий компонент); розвивати навички і вміння самостійно складати рівняння реакцій, класифікувати за різними ознаками, розставляти коефіцієнти; розвивати спостережливість, логічне мислення, вміння порівнювати, аналізувати; розвивати науковий світогляд (діяльнісний компонент); виховувати ініціативність та відповідальність учнів; вміння працювати в парах(соціальна та громадянська компетентність); вміння пояснювати природні явища на основі хімічних знань; проводити досліди з речовинами з урахуванням їхніх фізичних і хімічних властивостей (природнича компетентність); розуміти важливість гармонійної взаємодії людини і природи (ціннісний компонент).
Тип уроку: комбінований урок засвоєння нових знань, узагальнення вмінь і навичок та застосування їх на практиці.
Форма уроку: урок – дослідження
Форми роботи: розповідь учителя, фронтальна робота, робота в парах, індивідуальна.
Міжпредметні зв’язки: фізика (закон Гесса), математика (розв’язування задач)
Очікувані результати: учні мають визначати екзотермічні та ендотермічні реакції за знаком теплового ефекту; учні мають складати термохімічні рівняння.
Базові поняття та терміни: хімічні реакції, енергетичний ефект хімічних реакцій, внутрішня енергія, реакції: ендотермічні, екзотермічні, термохімічні рівняння, тепловий ефект реакції. Обладнання: таблиця розчинності; Періодична система Д.І.Менделєєва, ряд активності металів, дидактичний матеріал, комп’ютер, лабораторне обладнання та реактиви.
Хід уроку
Девіз уроку
«Не махай на все рукою,
не лінуйся, а учись.
Бо, чого навчишся в школі
знадобиться ще колись!»
І. Організація класу.
Я пропоную вам взяти аркуш паперу, зігнути його пополам, на одній стороні прикріпити вираз свого обличчя, на початку уроку, в кінці уроку ми прикріпимо ще одне обличчя і порівняємо їх.
ІІ. Актуалізація опорних знань.
- Інтелектуальна гра “Ти – мені, я – тобі”.
Робота в парах. Взаємоопитування, взаємооцінка. Корекція
(правильна відповідь 1 бал, частково правильна – 0,5бала)
- Завдання «Відновіть сторінки зошита».
До нас звернувся учень зі своєю проблемою: «Я знайшов старий зошит з хімії моєї сестри, який я порвав, коли був малим. Учитель завжди говорить, що зошити з хімії слід зберігати. А зараз мені потрібно відновити порвані сторінки. Хто мені допоможе?»
![]()
![]() Закінчіть… та складіть… реакції, назви їх.
Закінчіть… та складіть… реакції, назви їх.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(Учитель пропонує учням відновити записи в зошиті та допомогти учневі — закінчити рівняння реакцій і дати їм назву. Завдання учні виконують самостійно, а потім обговорюють результати роботи)
ІІІ. Мотивація навчальної діяльності.
За два роки знайомства з хімією ми вивчили величезну кількість речовин, познайомилися з їх фізичними і хімічними властивостями, навчилися писати рівняння хімічних реакцій. Щоб наше “намисто” знань було бездоганним і повним, давайте додамо до нього ще декілька намистин після сьогоднішнього уроку.
Відомо дуже багато хімічних реакцій. Всі вони індивідуальні. Але хімічні реакції мають ряд спільних ознак, що дає змогу об’єднати їх у кілька типів.
Бесіда.
1. Яку хімічну реакцію людина використовує з давніх часів? (Горіння.)
2. Для чого прадавній людині потрібний був вогонь? (Обігріватися, готувати їжу.)
4. Назвіть умови, які необхідні для того, щоб розпочалася реакція горіння.
5. Що називають реакцією окиснення?
Слово вчителя
Будь-яка хімічна реакція супроводжується виділенням або поглинанням енергії. Найчастіше енергія виділяється або поглинається у вигляді теплоти (рідше — у вигляді світлової або механічної енергії). Цю теплоту можна виміряти. Вона називається тепловим ефектом. Саме з цими реакціями ми з вами будемо говорити на сьогоднішньому уроці.(запис теми уроку та складання плану)
План уроку:
1.Термохімія. Екзотермічні та ендотермічні реакції.
3. Тепловий ефект реакції.
2. Закон Гесса.
4. Термохімічне рівняння.
5. Розв’язування задач
IV. Вивчення нового матеріалу
- Розповідь вчителя з елементами бесіди. Я чула таке визначення: «хімія – це фізика, тільки в іншому кабінеті». Дійсно і фізики і хіміки займаються вивченням речовин. От наприклад, термохімія тісно пов’язана з фізикою.
А що таке термохімія? (відповіді учнів)
Термохімія – це розділ хімії, який вивчає хімічні процеси з точки зору поглинання або виділення теплоти.
Однією з ознак хімічної реакції є поглинання або виділення теплоти.
Із виділенням тепла відбуваються всі реакції горіння, наприклад деревини, вугілля, газу. Ці реакції люди здавна використовують для обігріву й освітлення приміщень, приготування їжі. Ті самі реакції горіння використовують у роботі автомобільних двигунів внутрішнього згоряння, для руху ракет і навіть у космічних човнах. Це все окисно-відновні реакції.
Ми вже з вами знаємо, що під час розведення сульфатної кислоти виділяється велика кількість теплоти. Вона виділяється й під час розчинення лугів у воді, і під час реакцій нейтралізації.
НСl + NaOH = NaCl +H2O
Або під час взаємодії кальцій оксиду з водою (гашення вапна)
(робота біля дошки записати рівняння реакції гашення вапна)
СаО +Н2О = Са(ОН)2
Реакції, під час яких теплота виділяється, можуть відбуватися й самовільно, наприклад гниття органічних речовин.
Існують реакції, що відбуваються з поглинанням теплоти, можна навести багато реакцій розкладу:
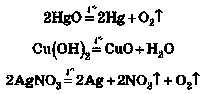
У цьому випадку енергія необхідна для руйнування кристалічних ґраток і молекул. Ці реакції відбуваються за постійного нагрівання. Самовільно процеси, які відбуваються з поглинанням теплоти, перебігати не можуть, їм увесь час потрібне надходження енергії ззовні.
Отже, хімічні реакції, під час яких теплота виділяється називають екзотермічними (від грецького екзо – назовні), а реакції під час яких теплота поглинається – ендотермічними (від грецького ендо – всередину). (повторити правило по черзі стр. 91)
- Часто потрібно точно знати, скільки теплоти поглинається або виділяється під час проведення хімічної реакції.
Наприклад, під час виробництва будь-яких хімічних речовин відбуваються екзо- або ендотермічні процеси. Відтак необхідно знати, скільки тепла необхідно підвести або як остудити зону проведення хімічних реакцій. Ця інформація також необхідна для наукових досліджень.
Для вимірювання теплових ефектів хімічних реакцій використовують спеціальний прилад – калориметр. Кількість теплоти, яка виділяється (екзотермічні реакції) або поглинається (ендотермічні реакції) при проходженні хімічної реакції, називають тепловим ефектом хімічної реакції та вимірюють у кДж, позначають ∆Н (дельта аш).
Основний принцип, на якому базуються всі термохімічні розрахунки, встановлено російським академіком Г.І. Гессом. (повідомлення учня)
3. Повідомлення учня
Г.І. Гесс у 1840 році на підставі експериментальних даних відкрив Закон, так званий Закон Гесса. Формулювання закону звучить так: тепловий ефект реакції залежить лише від початкового та кінцевого стану реагуючих речовин, але не залежить від проміжних стадій процесу. Закон Гесса дає можливість розраховувати теплові ефекти реакцій у тих випадках, коли вони чим-небудь не можуть бути виміряні. Іншими словами, тепловий ефект хімічної реакції залежить тільки від виду та стану вихідних речовин та продуктів реакції і не залежить від шляху переходу. Із закону Гесса випливають висновки, які мають велике практичне значення.
1 Тепловий ефект прямої реакції ∆Н1 дорівнює за величиною та протилежний за знаком тепловому ефекту зворотної реакції ∆Н2, тобто ∆Н1 = - ∆Н2.
2 Якщо здійснюються дві реакції з різними початковими станами, результатом яких є однаковий кінцевий стан, то різниця між їх тепловими ефектами являє собою тепловий ефект переходу з одного початкового стану в інший.
4. Вчитель. Отже, Причиною виникнення теплового ефекту є зміна внутрішньої енергії речовин. Тому, що під час перебігу хімічних реакцій, коли утворюються нові речовини, змінюється й кількість внутрішньої енергії. Якщо внутрішня енергія продуктів реакції менше, ніж реагентів, то зайва енергія виділяється назовні — реакція екзотермічна ∆Н<0. Якщо внутрішня енергія продуктів реакції більше, ніж реагентів, то енергія буде поглинатися із зовнішнього середовища — реакція ендотермічна ∆H>0
(робота з підручником стр.92, робота біля дошки)
Як зазначалося раніше, для визначення виділеної або поглиненої енергії використовують таке поняття, як ентальпія — тепловміст речовини. Значення ∆H реакції прийнято записувати справа, зі знаком «+» або «-», відокремлюючи від рівняння комою або крапкою з комою. (підручник стр.93). Якщо під час реакції виділяється теплота, то в правій частині рівняння тепловий ефект записують зі знаком «-», якщо поглинається зі знаком «+».
Зазвичай тепловий ефект реакції відносять до 1 моль продуктів або реагентів. Наприклад: CaCO3 = CaO + CO2, AH =+178 кДж/моль.
У рівняннях указують ще й агрегатний стан речовин, які беруть участь у реакції: (г.) — газоподібна, (р.) — рідка, (тв.) — тверда, або (крист.) або кристалічна, тому що агрегатний стан речовин також впливає на тепловий ефект реакції.
Рівняння реакцій, в яких указано чисельне значення теплового ефекту реакції, а також агрегатний стан речовин, називають термохімічними.
![]()
Це рівняння показує, що під час взаємодії 1 моль Cl2 з 1 моль Н2 виділяється 184,6 кДж теплоти, а продукти й реагенти газоподібні.
- Первинне застосування одержаних знань (керована практика)
Термохімічні рівняння можна використати для хімічних розрахунків.
Завдання 1. У процесі згоряння 12 г вуглецю виділяється 393 кДж тепла. Запишіть термохімічне рівняння.
C + О2 =CО2 +393 кДж/моль
або C + О2 = CО2; ΔH = -393 кДж.
Завдання 2. (самостійно) Вправа 127
Завдання 3 (згідно вправи 127, робота біля дошки). При утворенні 1 моль хлороводню з простих речовин виділяється 92,2 кДж. Обчислити кількість теплоти яка виділиться при утворенні 4 моль хлороводню.
Н2 + Сl2= 2HCl – 92,2 кДж , або Н2 + Сl2= 2HCl, ∆Н=+92,2кДж
1 моль – 92,2 кДж
4 моль – х
Х= 4х92,2=368,8 кДж
Запам’ятайте: Теплота, що поглинається або виділяється прямо пропорційна масі, об’єму, кількості речовини кожної речовини у реакції.
Завдання 4. (робота біля дошки) Обчисліть кількість теплоти, що виділиться при спалюванні: а) 4 моль; б) 4г; в) 4л (н.у) карбон (ІІ) оксиду. Термохімічне рівняння реакції горіння карбон (ІІ) оксиду
2СО(г) + О2(г)= 2СО2(г), ∆Н = -566кДж
Завдання 5. Письмова робота на картках
Укажіть тип хімічних реакцій (за знаком теплового ефекту):
N2 + O2 = 2NO – 90,4 кДж (Ендотермічна.)
CaCO3 = CaO + CO2 – 157 кДж (Ендотермічна.)
2NO + O2 = 2NO2 + 116 кДж (Екзотермічна.)
2CO + O2 = 2CO2; Q = –566 кДж (Екзотермічна.)
2HBr = Н2 + Вr2; Q = +72 кДж (Ендотермічна.)
- Підсумок уроку
- «Вільний мікрофон» (закінчи речення)
Сьогодні на уроці я дізнався…
- «Оціни урок» (1,2,3,4,5)
- Домашнє завдання
- Прочитати параграф 16 вивчити правила, Впр. 128
- Реферат «Л.В. Писаржевський – видатний український хімік»
Укажіть тип хімічних реакцій (за знаком теплового ефекту):
N2 + O2 = 2NO – 90,4 кДж
CaCO3 = CaO + CO2 – 157 кДж
2NO + O2 = 2NO2 + 116 кДж
2CO + O2 = 2CO2; Q = –566 кДж
2HBr = Н2 + Вr2; Q = +72 кДж
Укажіть тип хімічних реакцій (за знаком теплового ефекту):
N2 + O2 = 2NO – 90,4 кДж
CaCO3 = CaO + CO2 – 157 кДж
2NO + O2 = 2NO2 + 116 кДж
2CO + O2 = 2CO2; Q = –566 кДж
2HBr = Н2 + Вr2; Q = +72 кДж
Укажіть тип хімічних реакцій (за знаком теплового ефекту):
N2 + O2 = 2NO – 90,4 кДж
CaCO3 = CaO + CO2 – 157 кДж
2NO + O2 = 2NO2 + 116 кДж
2CO + O2 = 2CO2; Q = –566 кДж
2HBr = Н2 + Вr2; Q = +72 кДж
Укажіть тип хімічних реакцій (за знаком теплового ефекту):
N2 + O2 = 2NO – 90,4 кДж
CaCO3 = CaO + CO2 – 157 кДж
2NO + O2 = 2NO2 + 116 кДж
2CO + O2 = 2CO2; Q = –566 кДж
2HBr = Н2 + Вr2; Q = +72 кДж
Укажіть тип хімічних реакцій (за знаком теплового ефекту):
N2 + O2 = 2NO – 90,4 кДж
CaCO3 = CaO + CO2 – 157 кДж
2NO + O2 = 2NO2 + 116 кДж
2CO + O2 = 2CO2; Q = –566 кДж
2HBr = Н2 + Вr2; Q = +72 кДж


про публікацію авторської розробки
Додати розробку
