Урок у 8 класі "Поняття про лужні метали, галогени, інертні елементи"
Тема. Поняття про лужні метали, галогени, інертні елементи.
Мета: розширити знання учнів про хімічні елементи та їхні властивості на прикладі природних родин хімічних елементів (лужні метали, інертні елементи, галогени); розкрити залежність властивостей усередині груп лужних металів і галогенів від порядкового номера елемента.
ХІД УРОКУ
- Організація класу
II. Перевірка домашнього завдання
Завд.18 – таблиця «З історії класифікації хімічних елементів»
III. Мотивація навчальної діяльності
Розподіліть запропоновані хімічні елементи на три групи:
Гелій, Натрій, Хлор, Калій, Бром, Літій, Аргон, Флуор, Криптон.
Зараз на дошці представлений один зі способів класифікації хімічних елементів за приналежністю до природних родин хімічних елементів. Наскільки схожі ці елементи за фізичними й хімічними властивостями всередині родини? Чим відрізняються один від одного? Який зв’язок існує між елементами різних груп? Спробуємо відповісти на ці питання на сьогоднішньому уроці.
IV. Вивчення нової теми
1. Лужні метали
— Назвіть хімічні елементи, що утворюють групу лужних металів.
Li, Na, К, Rb, Cs, Fr
Учні одержують для роботи таблицю із властивостями лужних металів.
— В якій групі періодичної системи вони розташовані?
Лужні метали — це хімічні елементи з різко вираженими металевими властивостями.
Англійський хімік Г. Деві під час електролізу лугу КОН відкрив новий елемент, який він назвав потассіум, оскільки англійці називали КОН їдким поташем. Деві кинув калій у воду й очікував, що метал має негайно опуститися на дно. Але калій повівся інакше. З гучним шипінням цей метал забігав по поверхні води. Потім пролунав оглушливий вибух, і над потассіумом спалахнуло лілове полум’я. Так він і носився по воді, поки не перетворився на їдкий луг.
Про цезій і рубідій, відкриті іншими вченими, писали, що це легкі сріблясті метали, які так само, як літій і калій, загорялися на повітрі, бігали по воді з полум’ям і тріском, навіть більш несамовито, ніж калій і натрій. Усі лужні метали зберігають під шаром гасу. Солі Рубідію і Цезію не відрізняються від звичайної кухонної солі. їдкий цезієвий луг та їдкий рубідієвий луг були слизькими на дотик і мильними, подібно до їдкого натру та їдкого калі.
Властивості лужних металів
|
Характеристики |
Літій |
Натрій |
Калій |
Рубідій |
Цезій |
Францій |
|
Символ |
Li |
Na |
К |
Rb |
Cs |
Fr |
|
Атомна маса |
6,94 |
22,99 |
39,10 |
85,47 |
132,91 |
[223] |
|
Порядковий номер |
3 |
11 |
19 |
37 |
55 |
87 |
|
Валентність |
І |
І |
І |
І |
І |
І |
|
Радіус атома, нм |
0,156 |
0,192 |
0,238 |
0,251 |
0,271 |
|
|
Густина, г/см3 |
0,53 |
0,97 |
0,86 |
1,52 |
1,87 |
|
|
Температура плавлення, °С |
179 |
97,8 |
6305 |
39 |
28,5 |
|
|
Температура кипіння, °С |
1 340 |
883 |
760 |
696 |
708 |
|
|
Агрегатний стан (Н. у.) |
Твердий |
Твердий |
Твердий |
Твердий |
Твердий |
Твердий |
|
Колір полум’я |
Червоно-коричневий |
Жовтий |
Фіолетовий |
Червоний |
Фіолетовий |
|
Якою є типова валентність для всіх лужних металів?
Li, Na, К, Rb, Cs, Fr — валентність I.
Фізичні властивості: дуже м'які метали, легко ріжуться ножем, металевий блиск, гарна електро- й теплопровідність, незначна густина (легші за воду).
У ряді Li, Na, К, Rb, Cs, Fr tкип ° tплавл ° зменшуються (зі збільшенням атомної маси), густина збільшується, активність підвищується (щодо кисню й води).
Li, Na, К загоряються на повітрі лише за нагрівання, а метали з більшою атомною масою без нагрівання:
4Li + O2 ![]() 2LiO2
2LiO2
З водою літій реагує повільно, натрій значно швидше, а калій так швидко й виділяє стільки тепла, що водень, виділяючись, загоряється.
Демонстрація відео «Лужні метали»
У перший підготовлений заздалегідь кристалізатор з дистильованою водою акуратно додаємо пінцетом маленький шматочок магнію. Що спостерігаємо? Видимих змін немає.
У другий кристалізатор кладемо шматочок кальцію. Що спостерігаємо? Шматочок кальцію повільно розчиняється у воді.
У третій кристалізатор — шматочок натрію. Що спостерігаємо? Натрій швидко розчиняється у воді та згоряє жовтуватим полум'ям.
Тепер у всі три кристалізатори додаємо по дві-три краплі фенолфталеїну. Про що свідчить зміну забарвлення розчину? Середовище в кристалізаторі лужне. Запишемо на дошці рівняння реакцій:
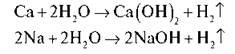
2. Галогени
Галогени — типові неметали, у періодичній системі розташовані в VII групі головної підгрупи. їх назва походить від слів галос — «сіль» і ген — «той, що народжує».
Назвіть їх.
F, Cl, Br, I, At
Демонстрація відео «Галогени»
Учні одержують для роботи таблицю із властивостями галогенів.
Властивості галогенів
|
Характеристики |
Флуор |
Хлор |
Бром |
Іод |
Астат |
|
Символ |
F |
Сl |
Вr |
І |
At |
|
Атомна маса |
19,00 |
35,45 |
79,90 |
126,90 |
[210] |
|
Порядковий номер |
9 |
17 |
35 |
53 |
85 |
|
Валентність |
І |
І |
І |
І |
І |
|
Радіус атома, нм |
0,071 |
0,099 |
0,114 |
0,133 |
|
|
Густина, г/см3 |
1,11 |
1,56 |
3,12 |
4,94 |
|
|
Температура плавлення, °С |
-220 |
-101 |
-7 |
114 |
|
|
Температура кипіння, °С |
-188 |
-34 |
59 |
186 |
|
|
Агрегатний стан (н. у.) |
Газ |
Газ |
Рідина |
Твердий |
|
|
Колір |
Зеленкувато-жовтий |
Жовто-зеленкуватий |
Червоно - бурий |
Темно-фіолетовий |
|
Флуор — газ ясно-зеленого кольору, дуже отруйний. Багато вчених, які працюють із ним, постраждали від цього. Найбільш активний неметал (у флуорі навіть вода горить), реагує з воднем за значного охолодження в темряві.
Хлор — важкий газ зеленого кольору з різким запахом, отруйний, за звичайних умов реагує з воднем дуже повільно, а за температури або на світлі — з вибухом:
Н2 + Сl2 ![]() 2НСl
2НСl
Бром — важка темно-коричнева рідина, дуже активний неметал, але менш активний, ніж хлор. З воднем реагує виключно за нагрівання.
Іод — темно-фіолетові кристали, активний неметал, найменш активний у ряді галогенів, реакція з воднем навіть за нагрівання оборотна.
Флуор, Хлор, Бром, Іод — представники родини подібних за властивостями елементів, які називають галогенами. Типова валентність — І.
У ряді: F, Cl, Br, I, At tкип ° tплавл ° збільшуються, активність зменшується (найбільш активний — Флуор).
Запишемо кілька рівнянь, що характеризують хімічні властивості галогенів.
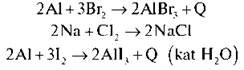
3. Інертні елементи
Інертні елементи — це елементи головної підгрупи VIII групи періодичної системи. Назвіть їх.
Не, Ne, Аr, Кr, Хе, Rn
Демонстрація відео «Інертні елементи»
Розповідь учителя
У 1868 році француз Жансе й англієць Лок'єр під час вивчення сонячних протуберанців відкрили спектр нового хімічного елемента, що не належав жодному з відомих на земній кулі. «Небесний» елемент назвали Гелієм. Через 25 років Релей виявив у звичайному повітрі домішок, який не вступав у хімічні реакції. Цей елемент назвали Аргон («ледачий»).
Незабаром Гелій був виявлений у мінералах, що містять Уран і Торій. Гелій виявився найлегшим після водню газом.
У 1897 році англієць Рамзай передбачив існування ще однієї газоподібної речовини, що мала перебувати між Гелієм і Аргоном. Це виявився відкритий у 1898 році Неон. А потім у короткий строк Рамзай та його співробітник Траверс виявили в земній атмосфері ще два елементи — Криптон («таємний») і Ксенон («прихований»).
До складу повітря, крім кисню й азоту, входять ще п'ять газоподібних простих речовин: гелій Не, неон Me, аргон Аr, криптон Кr, ксенон Хе. Тривалий час не вдавалося одержати сполуки цих елементів. їх назвали інертними газами.
|
Інертні гази |
Інертні гази |
||||
|
Не |
Ne |
Аr |
Кr |
Хе |
Rn |
|
Безбарвні гази без запаху і смаку, помірно розчинні у воді, за значного охолодження переходять у рідкий і твердий стани. |
|||||
|
Густина, tкип ° tплавл ° збільшуються |
|
|
|
|
|
|
|
|
|
|
|
|
Хімічні сполуки Не та Ne не відомі, тому їх називають інертними, у той час як Кr і Хе утворюють хімічні сполуки. Аr, Кrі Хе утворюють також клатрати.
З кожним роком розширюється сфера застосування інертних газів. Легкість і негорючість гелію використовують для заповнення ним повітряних куль і дирижаблів. В інертному середовищі аргону здійснюють електрозварювання металів, що легко окислюються. Неоном, аргоном, криптоном і ксеноном заповнюють електричні лампочки. Суміш гелію з киснем застосовують для дихання під час підводних робіт. Якщо крізь розріджені інертні гази пропускати електричний струм, то вони випромінюють світло різного забарвлення. Наприклад, аргон дає синє світіння, неон — червоне, тому їх використовують для світлових реклам і в маяках.
IV. Підбиття підсумків уроку
Що нового ви дізналися сьогодні на уроці?
Які природні родини хімічних елементів ви вивчили?
Чим відрізняються ці три родини?
Учитель узагальнює відповіді учнів, відзначає, що така класифікація хімічних елементів не є універсальною. Спроби класифікації хімічних елементів тривали багато років аж до відкриття періодичної системи хімічних елементів Д. І. Менделєєвим у 1869 році.
V. Домашнє завдання
§5-чит, завд.1-6-усно, завд.19,20,22 –письмово, §6-чит., завд.1-6-усно,24,25-письмово
Творче завдання. Представити одну з груп елементів у вигляді родини, розповісти про неї та про кожного члена родини.


про публікацію авторської розробки
Додати розробку
